
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів

Органічні речовини
|
|
|
|
|
|
|
|
|
Функціональні гру- |
|
|
Вуглеводні |
||
|
|
|
пи відсутні |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гідроксильна група |
|
|
Спирти |
|
|
|
|
|
— ОН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Карбонові |
|
Карбоксильна група |
|
|
кислоти |
|
— СООН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аміни |
|
Аміногрупа — NH2 |
|
|
|
||
|
|
|
|
|
Багато органічних молекул містять відразу кілька функціональних груп. Такі сполуки називають поліфункціональними. До них відносять
вуглеводи, амінокислоти, білки, нуклеїнові кислоти тощо.
загальна характеристика ОрганіЧних спОлук
У 1861 році видатний російський учений Олександр Михайлович Бутлеров, спираючись на колосальний експериментальний і теоретичний досвід, сформулював один з основних законів органічної хімії про будову органічних сполук, що з деякими змінами дійшов і до наших днів. Значення теорії будови в органічній хімії можна порівняти хіба що з відкриттям Періодичного закону в неорганічній хімії.
порівняльна характеристика органічних і неорганічних сполук
У таблиці наведена порівняльна характеристика властивостей органічних і неорганічних сполук.
властивість |
Органічні сполуки |
неорганічні сполуки |
|
|
|
|
|
Переважний |
тип |
Ковалентний слабополярний |
Йонний, ковалентний сильнополярний |
хімічного зв’язку |
|
|
|
Температури |
плав- |
У більшості випадків низькі, |
Високі, зазвичай понад +600 °С |
лення й кипіння |
до +350 °С |
|
|
|
|
|
|
Стійкість при висо- |
Зазвичай розкладаються на більш |
Більшість сполук стійкі до кількох ти- |
|
ких температурах |
прості речовини при температурі близь- |
сяч градусів |
|
|
|
ко 300 450 °С |
|
|
|
|
|
Розчинність |
|
Добре розчиняються в деяких органіч- |
Більшість розчинні у воді |
|
|
них розчинниках, рідко — у воді |
|
|
|
|
|
Електричні власти- |
Майже всі сполуки — діелектрики і їхні |
Багато речовин добре проводять елект- |
|
вості |
|
розчини — неелектроліти |
ричний струм, багато з них у розчине- |
|
|
|
ному або розплавленому стані є елект- |
|
|
|
ролітами |
|
|
|
|
Швидкість |
проті- |
Повільна |
Швидка |
кання обмінних ре- |
|
|
|
акцій |
|
|
|
Поширеність |
|
У живій природі (флора й фауна) |
У неживій природі (атмосфера, гід- |
|
|
|
росфера, літосфера) |
|
|
|
|
хімічна структура та хімічна будова
Перший постулат Бутлерова. У молекулах речовин існує певний порядок зв’язування атомів, що називається хімічною структурою, або будовою речовини.
Кожній індивідуальній речовині відповідає одна-єдина певна хімічна структура.
Ворганічній хімії Карбон завжди перебуває
вчотиривалентному стані, тобто може утворювати щонайбільше чотири хімічні зв’язки.
Розгляньмо будову молекули метану CH4. У цій сполуці ступінь окиснення атома Карбону дорівнює –4, а атомів Гідрогену +1. У просторі атоми Гідрогену можуть перебувати в такий спосіб: або
вплощині у вершинах квадрата, або у вершинах трикутної піраміди, так званого тетраедра. Це
158
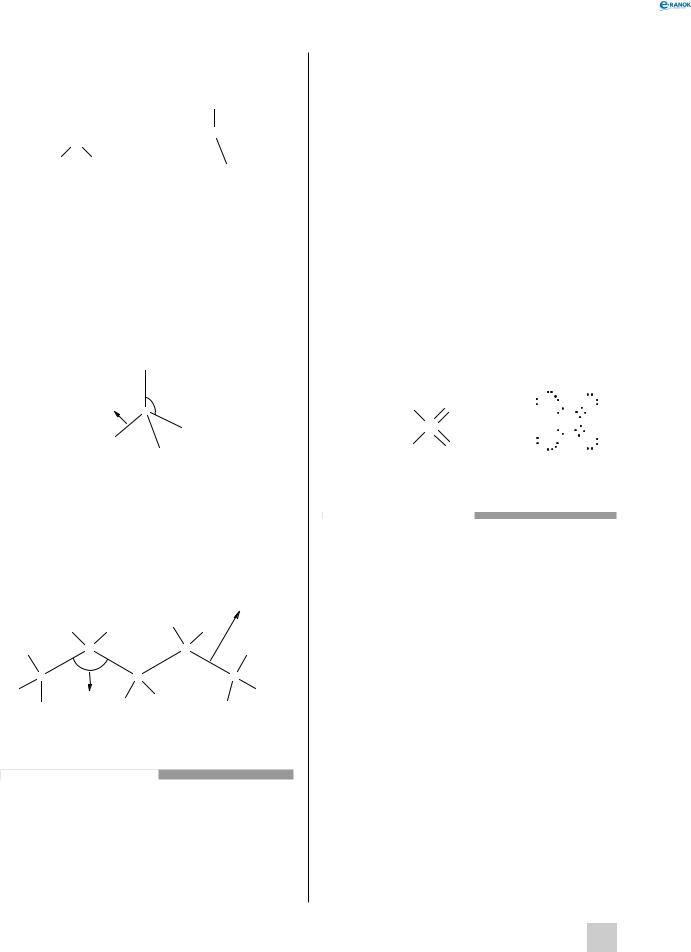
можна проілюструвати за допомогою структурних формул, в яких зв’язки між атомами позначають рисками:
H
H H
 C
C
 C
C H
H
H H H H
Однак форма квадрата неможлива, тому що через відштовхування атомів Гідрогену один від одного відбуватиметься деформація структури, і насамкінець молекула досягне стану, в якому атоми Гідрогену перебувають у вершинах тетраедра. При рентгеноструктурному аналізі метану було з’ясовано, що довжина зв’язків C −H дорівнює 0,11 нанометрів (1 нм дорівнює 10—9 метра), а з погляду стереометрії було з’ясовано, що кут HCH дорівнює 109,28°.
Отже, наочно будову молекули метану можна подати так:
H
0,11 нм C 109,28o
нм C 109,28o
H
H
H
У принципі, і в більш складних органічних молекулах, в яких атоми Гідрогену заміщені різними замісниками, кути й довжини зв’язків будуть прагнути до наведених вище значень, тобто ланцюжок атомів Карбону (довжина C −C зв’язку дорівнює 0,154 нм) буде не лінійним, а зигзагоподібним, з кутом CCC, який приблизно дорівнює 110°. Наприклад, будову молекули пентану C5H12 можна подати так:
|
|
|
|
0,154нм |
|
H |
H |
H |
H |
|
|
|||
H |
|
C |
C |
H |
C |
|
C |
|
C |
H |
|
o |
H |
H |
H |
|
H |
||
109,31 H |
|
|||
Брутто, структурні та електронні формули сполук
Другий постулат Бутлерова. Хімічні реак-
ційні здатності певних груп атомів суттєво залежать від їхнього хімічного оточення, тобто від того, з якими атомами або групами атомів сусідить певна група.
Формули сполук, якими ми користалися при вивченні неорганічної хімії, відображають тільки кількість атомів того чи іншого елемента в моле-
кулі. Такі формули називають «бруттоформулами», або «молекулярними формулами».
Як випливає з першого постулату Бутлерова, в органічній хімії важлива не тільки кількість тих чи інших атомів у молекулі, а ще й порядок їхнього зв’язування, тобто брутто-формули не завжди доцільно використовувати для органічних сполук. Наприклад, для наочності при розгляді структури молекули метану ми використовували структурні формули — схематичне зображення порядку зв’язування атомів у молекулу. При зображенні структурних формул хімічний зв’язок позначають рискою, подвійний зв’язок — двома рисками тощо.
Електронна формула (або формула Льюїса) дуже схожа на структурну формулу, але в цьому випадку зображають не утворені зв’язки, а електрони, як ті, що утворюють зв’язок, так і ті, що його не утворюють.
Наприклад, уже розглянуту сульфатну кислоту можна записати за допомогою таких формул. Брутто-формула — H2SO4 , структурна й електронна формули мають такий вигляд:
H |
|
|
O |
O |
H |
O |
O |
|
|
||||||
|
|
|
|
S |
|
|
S |
|
|
|
|
|
O |
O |
|
H |
|
|
O |
O |
H |
||
|
|
|
|
|
|||
|
|
|
|
||||
Структурна формула |
Електронна формула |
||||||
структурні формули органічних сполук
Майже всі органічні речовини складаються з молекул, склад яких виражається хімічними формулами, наприклад CH4, C4H10, C2H4O2 .А яку будову мають молекули органічних речовин? Це питання ставили собі в середині XIX століття засновники органічної хімії — Ф. Кекуле і О.М. Бутлеров. Досліджуючи склад і властивості різних органічних речовин, вони прийшли до наступних висновків:
—атоми в молекулах органічних речовин з’єднані хімічними зв’язками в певній послідовності, відповідно до їх валентності. Цю послідовність прийнято називати хімічною будовою;
—атоми Карбону у всіх органічних сполуках чотиривалентні, а інші елементи виявляють характерні для них валентності.
Ці положення є основою теорії будови органічних сполук, сформульованої О.М. Бутлеровим
в1861 році.
Хімічну будову органічних сполук наочно подають структурними формулами, в яких хімічні зв’язки між атомами позначають рисками. Загальне число рисок, що відходять від символу кожного елемента, дорівнює валентності його атома. Кратні зв’язки зображують двома або трьома рисками.
159
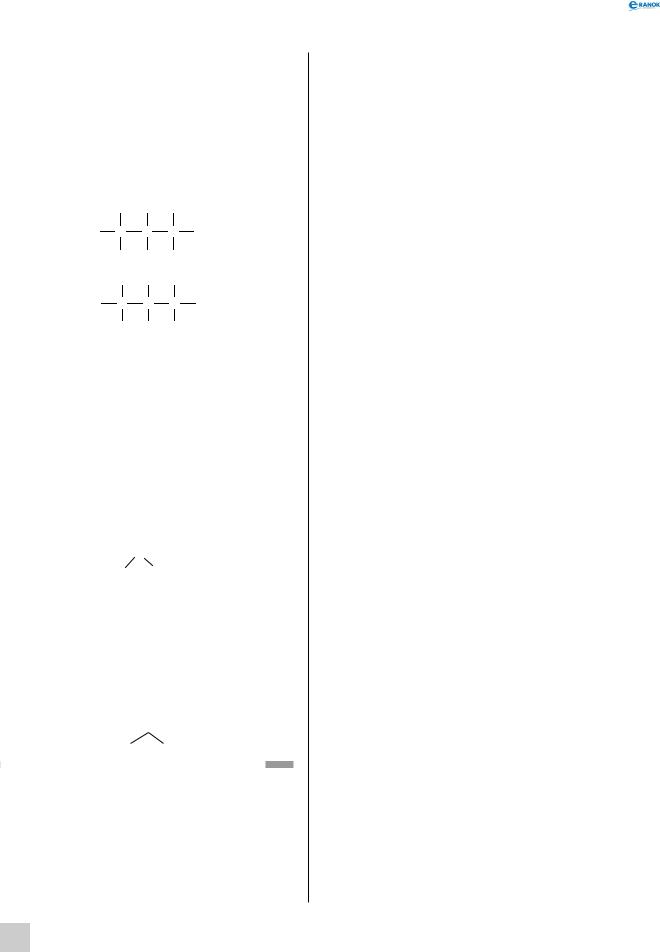
На прикладі насиченого вуглеводню пропану C3H8 розглянемо, як скласти структурну формулу органічної речовини.
1.Зображуємо карбоновий кістяк. У даному випадку ланцюг складається з трьох атомів Карбону:
С— С — С
2.Карбон чотиривалентний, тому від кожного атома Карбону зображуємо недостатні риски таким чином, щоб поряд з кожним атомом було по чотири риски:
C C C
3. Дописуємо символи атомів Гідрогену:
H H H
H C C C H
H H H
Часто структурні формули записують у скороченому вигляді, не зображуючи зв’язки С—Н. Скорочені структурні формули набагато компактніше, ніж розгорнуті:
СН3 — СН2 — СН3.
Структурні формули показують тільки послідовність з’єднання атомів, але не відображують просторової будови молекул, зокрема валентні кути. Відомо, наприклад, що кут між зв’язками C в пропані дорівнює 109,5°. Проте структурна формула пропану виглядає так, начебто цей кут дорівнює 180°. Тому вірніше було б записувати структурну формулу пропану в менш
зручному, але у більш правдивому вигляді:
CH2
CH3 CH3
Професійні хіміки використовують такі структурні формули, в яких взагалі не показані ні атоми Карбону, ні атоми Гідрогену, а зображений лише карбоновий кістяк у вигляді з’єднаних між собою С—С-зв’язків, а також функціональні групи. Для того щоб кістяк не виглядав однією суцільною лінією, хімічні зв’язки зображують під кутом один до одного. Так, у молекулі пропану C3H8 усього два зв’язки С—С,тому пропан зображують двома рисками:
гомологічні ряди органічних сполук
Розглянемо структурні формули двох сполук одного класу, наприклад спиртів:
|
|
H |
|
|
H |
|
|
H |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
C |
|
O |
|
H |
H |
|
C |
|
|
C |
|
|
O |
|
H |
|||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
H |
|
|
H |
|
|
H |
|
|||||||||||
|
|
|
|
|||||||||||||||||
метиловий спирт |
етиловий спирт |
|||||||||||||||||||
(метанол) |
|
|
(етанол) |
|||||||||||||||||
Молекули метилового CH3OH й етилового C2H5OH спиртів мають однакову функціональну групу OH, загальну для всього класу спиртів, але відрізняються довжиною карбонового кістяка: в етанолі на один атом Карбону більше. Порівнюючи структурні формули, можна помітити, що при збільшенні карбонового ланцюга на один атом Карбону склад речовини змінюється на групу CH2 , при подовженні карбонового ланцюга на два атоми — на дві групи CH2 тощо.
Сполуки одного класу, що мають подібну будову, але відрізняються за складом на одну або кілька груп CH2 , називають гомологами.
Групу CH2 називають гомологічною різницею. Сукупність всіх гомологів утворює гомологічний ряд. Метанол і етанол належать до гомологічного ряду спиртів. Усі речовини одного ряду мають подібні хімічні властивості, а їхній склад можна виразити загальною формулою. Наприклад, загальна формула гомологічного ряду спиртів — CnH2n+1OH, де n — натуральне число.
|
|
загальна формула |
|
клас сполук |
загальна |
з виокремленням |
|
формула |
функціональної |
||
|
|||
|
|
групи |
|
|
|
|
|
Алкани |
CnH2n+2 |
|
|
Циклоалкани |
CnH2n |
|
|
Алкени |
CnH2n |
|
|
Алкадієни |
CnH2n−2 |
|
|
Алкіни |
CnH2n−2 |
|
|
Одноядерні |
|
|
|
арени (гомоло- |
CnH2n−6 |
|
|
гічний ряд бен- |
|
||
зену) |
|
|
|
|
|
|
|
Одноатомні на- |
CnH2n+2O |
CnH2n+1OH |
|
сичені спирти |
|||
Багатоатомні |
CnH2n+2Ox |
CnH2n+2−x (OH)x |
|
спирти |
|||
Альдегіди |
CnH2nO |
CnH2n+1CHO |
|
Одноосновні |
|
|
|
карбонові кис- |
CnH2nO2 |
CnH2n+1COOH |
|
лоти |
|
|
|
|
|
|
|
Естери |
CnH2nO |
CnH2n+1 COOCnH2n+1 |
|
Вуглеводи |
Cn (H2O)m |
|
|
Аміни первин- |
CnH2n+3N |
CnH2n+1NH2 |
|
ні |
|||
Амінокислоти |
CnH2n+1NO |
H2NCnH2n COOH |
160
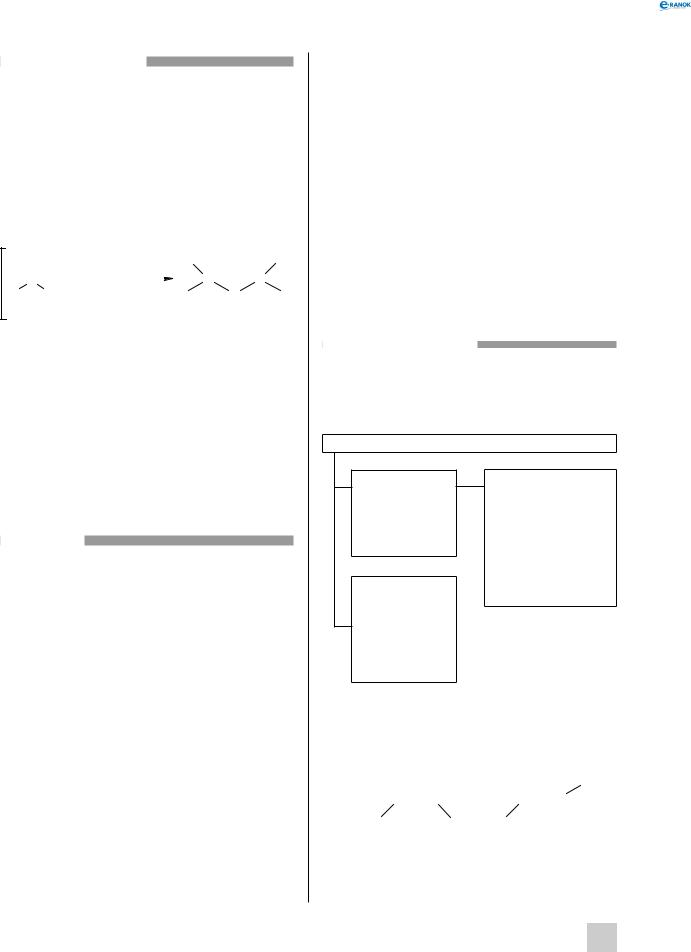
явище ізомерії
Третій постулат Бутлерова. Деякі різні ре-
човини мають однакову хімічну формулу, але різну структуру. Таке явище називають ізомерією.
Із проявом ізомерії вперше зіштовхнувся німецький учений Фрідріх Велер. Він розжарював розчин амоній ціанату (NH4CNO) й одержав се-
човину ((NH2 )2 CO). Очевидно, що ці дві сполуки мають однакову брутто-формулу N2H4CO,але відповідають різним структурним формулам. Амоній ціанат — типова йонна сполука, а сечовина — ковалентна:
|
H |
|
|
|
+ |
|
|
|
|
|
|
|
|
to |
H |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
C |
|
|
|
N |
|
O |
|
|
|
N |
N |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
H |
N |
H |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
C |
H |
||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
||
|
Амоній ціанат |
|
|
|
|
Сечовина |
||||||||||||||
|
Ці дві сполуки є ізомерами, тобто в 1828 році |
|||||||||||||||||||
Веллер провів реакцію ізомеризації амоній ціанату. Ізомерія — це дуже розповсюджене явище. З явищем ізомерії значною мірою пов’язане величезне різноманіття органічних сполук. Кількість ізомерів з великою швидкістю зростає при збільшенні кількості атомів Карбону. Наприклад, кількість ізомерів бутану C4H10 дорівнює 2, декану C10H22 — 75, а ейкозану C20H42 — вже
336 319!
ізомери
Одній молекулярній формулі можуть відповідати різні речовини. Наприклад, для сполуки зі складом C4H10 можна запропонувати дві структурні формули, в яких карбоновий кістяк буде містити чотири атоми, з’єднані один з одним двома різними способами:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
C |
|
|
|
|
C |
|
|
C |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
C |
|
|
|
C |
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
нерозгалужений |
|
розгалужений |
|||||||||||||||||||||||||||||||||||||
карбоновий ланцюг |
карбоновий ланцюг |
|||||||||||||||||||||||||||||||||||||||
|
Кожному з них відповідає свій вуглеводень: |
|||||||||||||||||||||||||||||||||||||||
|
|
|
H |
|
|
H |
H H |
|
|
H |
|
|
|
|
H |
H |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H |
|
C |
|
|
C |
|
|
C |
|
|
C |
|
H H |
|
C |
|
|
|
|
C |
|
|
|
|
C |
|
H |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H |
H H |
|
|
H |
|
|
|
|
|
|
|
|
|
|
H |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
C |
|
H |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
або |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH3— CH2— CH2— CH3 |
CH3— |
|
CH — CH3 |
|||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
бутан |
|
|
|
|
|
|
|
|
|
ізобутан |
|
|
|
|
||||||||||||||||||||
Таким чином, одній молекулярній формулі відповідають дві різні речовини — їх називають ізомерами.
Ізомери — це речовини, що мають однакову молекулярну формулу, але різну будову.
Будова молекул визначає їхні властивості, тому ізомери відрізняються один від одного за фізичними і хімічними показниками. Наприклад, складу C2H6O відповідають дві речовини — ета-
нол і диметиловий етер: |
|
|
СН3 |
— СН2 — О — Н |
СН3 — О — СН3 |
|
етанол |
диметиловий етер |
Етанол — це рідина, що реагує з натрієм. Диметиловий етер — газ, з натрієм не взаємодіє.
Явище ізомерії для органічних сполук відкрив О.М. Бутлеров. Спочатку він передбачив його теоретично, а потім підтвердив експериментально: синтезував ізобутан і довів, що два ізомери — бутан та ізобутан — мають різні властивості.
різновиди ізомерії
Ізомери відрізняються один від одного будовою молекул, але ці відмінності можуть бути різними. Залежно від того, за якою ознакою відрізняється будова молекул ізомерів, розрізняють декілька видів ізомерії:
Види ізомерії
Структура
Ізомери відрізняються порядком з’єднання атомів
Геометрична
Порядок з’єднання атомів, але ізомери відрізняються геометрією
Розрізняють:
—ізомерію карбонового ланцюга;
—ізомерію положення функціональної групи;
—ізомерію положення кратного зв’язку.
Усі різновиди ізомерії можна згрупувати у два типи: структурна і геометрична. Структурні ізомери відрізняються один від одного порядком з’єднання атомів, а у геометричних ізомерів порядок з’єднання однаковий, але геометрично молекули відрізняються одна від одної, наприклад:
CH3
С4Н8 |
CH |
|
CH |
CH |
|
CH |
|
|
|||||
|
|
|||||
|
CH3 |
CH3 CH3 |
||||
Якщо два ізомери належать до одного класу органічних сполук, то вони можуть відрізнятися один від одного за різними ознаками. Найчастіше трапляється ізомерія карбонового ланцюга: в цьому випадку ізомери відрізняються порядком
161
з’єднання атомів Карбону карбонового кістяка, |
електрони. Для цього атом Карбону поглинає не- |
||||||||||||||||
як, наприклад: C4H10 |
|
|
|
велику кількість енергії і переходить у збуджений |
|||||||||||||
С4Н10 |
|
CH |
CH |
CH CH |
CH CH |
CH |
стан, в якому будова його електронної оболонки |
||||||||||
|
виявляється наступною: |
|
|
|
|||||||||||||
|
|
3 |
|
2 |
2 |
3 |
3 |
3 |
|
|
|
||||||
|
|
|
|
|
|
|
CH3 |
|
6C* |
2 |
↑ |
↑ ↑ |
↑ |
|
|
|
|
|
|
|
|
|
ізобутан |
|
|
|
1 |
↑↓ |
p |
|
|
|
|
||
Багато сполук містять у своєму складі |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
||||||||||
функціональні групи. Якщо карбоновий ланцюг має |
|
|
s |
|
|
|
|
|
|||||||||
достатню довжину, то функціональна група може |
|
Під |
час |
переходу |
одного |
електрона на |
|||||||||||
з’єднуватися з різними атомами Карбону в ланцюзі — |
p-орбіталь орбіталі зовнішнього рівня атома кар- |
||||||||||||||||
це ізомерія положення функціональної групи: |
бону також змінюються: одна sорбіталь та три |
||||||||||||||||
C3H7OH |
|
|
CH2 CH2 CH3 |
CH3 CH |
CH3 |
p-орбіталі утворюють чотири однакові за енергією |
|||||||||||
|
|
|
OH |
|
|
OH |
|
та формою орбіталі: |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
ізопропанол |
|
|
+ |
+ |
+ |
→ |
+ |
+ |
+ |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Якщо сполука з великим карбоновим ланцю- |
|
s-орбіталь + 3 p-орбіталі = 4 sp3-орбіталі. |
|||||||||||||||
гом також має кратні зв’язки (подвійні або по- |
|
||||||||||||||||
|
Ці орбіталі називають гібридизованими, а про |
||||||||||||||||
трійні), то такі зв’язки можуть бути утворені між |
|
||||||||||||||||
стан самого атома Карбону говорять, що він пере- |
|||||||||||||||||
різними атомами Карбону — це ізомерія положен- |
|||||||||||||||||
буває у стані sp3-гібридизації. Оскільки нові орбі- |
|||||||||||||||||
ня кратного зв’язку: |
|
|
|
||||||||||||||
|
|
|
талі однакові за енергією, вони мають однаково |
||||||||||||||
C4H8 |
CH2 |
CH CH2 CH3 |
CH3 CH CH CH3 |
||||||||||||||
відштовхуватися одна від одної і тому, на відмі- |
|||||||||||||||||
|
|
|
бутен1 |
|
бутен2 |
||||||||||||
|
|
|
|
ну від звичайних p-орбіталей, які розташовані |
|||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
Структурні ізомери можуть належати не тільки |
по взаємноперпендикулярних вісях, sp3-гібри- |
||||||||||||||||
до одного, але і до різних класів сполук. У такому |
дизовані орбіталі у просторі розташовані таким |
||||||||||||||||
випадку ізомерію називають міжкласовою. Так, |
чином, що вони спрямовані до вершин тетраедра |
||||||||||||||||
розглянуті |
вже |
етанол |
і |
диметиловий етер |
(правильної трикутної піраміди): |
|
|
||||||||||
є міжкласовими ізомерами: перша сполука нале- |
|
|
|
|
|
|
|
|
|||||||||
жить до класу спиртів, а друга — до етерів. Також |
|
|
|
|
|
|
|
|
|||||||||
можуть існувати пари речовин, одна з яких є нена- |
|
|
|
|
|
|
|
|
|||||||||
сиченим вуглеводнем, а друга — циклічним вугле- |
|
|
|
|
|
|
|
|
|||||||||
воднем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C4H8 |
|
CH2 |
CH |
CH2 |
CH3 |
CH CH |
|
|
|
|
|
|
|
|
|||
|
|
|
|
бутен1 |
|
2 |
2 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
При утворенні хімічних зв’язків атоми Карбону утворюють спільні електронні пари з атомами Гідрогену:
гібридизація атомів карбону |
|
•H |
|
H |
|
|
H |
|||||||||
• |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
•H |
|
•• |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
•C• + |
|
H• •H |
або H |
|
C |
|
H |
||
і геометрія органічних сполук |
|
|
|
|
||||||||||||
|
• |
•H |
|
•C• |
|
|
|
|
|
|
||||||
|
|
•• |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
В молекулах насичених вуглеводнів існує два |
|
•H |
|
H |
|
|
H |
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
типи зв’язків: С—С — ковалентний неполярний |
Оскільки спільні електроні пари можуть |
|||||||||||||||
і С—Н — ковалентний слабополярний. У всіх ор- |
утворюватися тільки при перекриванні орбіталей, |
|||||||||||||||
ганічних сполуках атоми Карбону утворюють по |
то хімічні зв’язки утворюються в тих самих на- |
|||||||||||||||
чотири хімічні зв’язки. Валентність атома Карбо- |
прямках, в яких спрямовані гібридизовані |
|||||||||||||||
ну має обумовлюватися будовою його електронної |
орбіталі атома Карбону. Отже, найпростіший |
|||||||||||||||
оболонки. У звичайному (основному стані) на зов- |
алкан — метан — має форму тетраедра: атоми |
|||||||||||||||
нішньому енергетичному рівні атома Карбону міс- |
Гідрогену розташовані у його вершинах, а атом |
|||||||||||||||
титься 4 електрони: одна пара на sорбіталі і два |
Карбону — в його центрі: |
|
|
|
|
|
|
|||||||||
неспарені на p-орбіталях: |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6C |
2 ↑↓ |
↑ |
↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 ↑↓ |
|
p |
|
|
|
|
|
|
|
|
|
|
|||
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Але для утворення чотирьох зв’язків на зовнішньому рівні має бути чотири неспарені
162

Складніші алкани мають схожу будову — це комбінація декількох тетраедрів. Завдяки такій особливості утворення зв’язків в алканах карбоновий ланцюг не утворює лінію, а є зигзагоподібним, причому кут між хімічними зв’язками становить приблизно 109,5 °. В молекулах алканів карбоновий кістяк може по-різному розташовуватися в просторі завдяки вільному обертанню атомів Карбону навколо одинарних зв’язків. Наприклад, карбоновий ланцюг пентану C5H12 може виглядати так:
C C C C C C C C C C C C C
C C C
Але всі ці карбонові кістяки відповідають одній речовині з нерозгалуженим ланцюгом:
СН3—СН2—СН2—СН2—СН3.
В молекулах ненасичених вуглеводнів атоми Карбону також чотиривалентні, але хімічні зв’язки вони утворюють не чотирма іншими атомами, а з меншою кількістю. Тому атоми Карбону також мають бути в певному стані гібридизації.
В молекулі етилену атоми Карбону з’єднуються з трьома атомами: два атоми Гідрогену і один атом Карбону. Для утворення такого числа зв’язків атом Карбону перебуває в стані sp2-гіб- ридизації:
У такому стані в атома Карбону є три sp2- гібридизовані орбіталі, що розташовані в одній площині під кутом 120° одна до одної. А одна p-орбіталь, що не бере участі в гібридизації, розташована перпендикулярно до площини гібридизованих орбіталей.
При утворенні хімічних зв’язків такий атом Карбону за участю гібридизованих орбіталей утворює по одному зв’язку (одній спільній електронній парі), з двома атомами Гідрогену і з іншим атомом Карбону. А p-орбіталі двох сусідніх атомів Карбону утворюють додатковий зв’язок:
Таким чином між двома атомами Карбону утворюються дві спільні електронні пари:
• • |
|
• |
•H |
|
H• |
|
• |
H |
||||
H |
|
|
|
|
|
• |
|
|
||||
|
+ •C |
•+ •C• + |
|
|
|
•• |
|
• |
||||
|
|
|
|
|
||||||||
• |
|
|
|
|
|
|
|
C |
C |
|
|
|
|
|
|
|
|
|
|
|
•• |
|
• |
||
H |
• |
|
• |
•H |
|
•• |
|
|
||||
|
|
|
|
• |
||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
H |
|
|
|
H |
|
|
H |
|
|
|
|
||
|
або |
C |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
H |
|
|
H |
|
|
|
|
||
Завдяки такому розташуванню орбіталей молекула етилену є плоскою: всі атоми розташовані в одній площині, і всі валентні кути в ній по 120 °:
0,111HM
H  H
H
C C 120o
C 120o
H H
0,133 HM
На відміну від етилену, в ацетилені атоми Карбону перебувають у стані sp-гібридизації. В такому стані в атома є тільки дві гібридизовані орбіталі, що розташовані на одній лінії, тобто під кутом 180 °:
А дві p-орбіталі, що не беруть участі в гібридизації, розташовані взаємно перпендикулярно до гібридизованих орбіталей. При утворенні хімічних зв’язків в ацетилені гібридизовані орбіталі утворюють зв’язки з одним атомом Гідрогену й одним атомом Карбону. При цьому між атомами Карбону утворюється ще два додаткові зв’язки за участю негібридизованих p-орбіталей:
Таким чином між атомами Карбону утворюється три спільні електронні пари, що відпові-
дає потрійному зв’язку: |
|
|
||||||||
• |
• |
|
|
• •• • |
||||||
H•+•C•+•C•+•H |
||||||||||
|
H•C••C•H |
|||||||||
• |
• |
|
|
|||||||
або H |
|
C |
|
C |
|
H |
||||
|
||||||||||
|
|
|
||||||||
|
||||||||||
Зверніть |
увагу, що |
молекула ацетилену |
||||||||
є лінійною: всі атоми розташовані на одній прямій. І зі збільшенням кратності зв’язку зменшується його довжина: якщо в алканах довжина зв’язку С—С становить 0,154 нм, в алкенах зв’язок С=С має довжину 0,133 нм, то в ацетилені потрійний зв’язок вже 0,121 нм.
163
