
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
алкіни
гомологічний ряд алкінів
Алкінами називають ненасичені вуглеводні, молекули яких мають один потрійний зв’язок. Перший представник цього класу — ацетилен HC ≡ CH, у зв’язку із чим алкіни також називають ацетиленовими вуглеводнями. Найближчі го-
мологи ацетилену: |
|
|
CH3 |
−C ≡ CH |
пропін |
CH3 |
−CH2 −C ≡ CH |
бутин1 |
CH3 |
−C ≡ C −CH3 |
бутин2 |
Загальна формула |
гомологічного ряду |
|
алкінів |
CnH2n−2. Вона |
збігається із загальною |
формулою алкадієнів, тому алкіни й алкадієни є міжкласовими ізомерами.
ізомерія й номенклатура
Структурна ізомерія алкінів обумовлена ізомерієюкарбоновогокістяка,таксамояківалканів таалкенів(наприклад,3-метилбутин-1іпентин-1), та ізомерією положення потрійного зв’язку (бу- тин-1 і бутин-2). Просторова ізомерія для алкінів не характерна.
В алкінах з нерозгалуженим карбоновим ланцюгом нумерацію починають із того кінця, ближче до якого перебуває потрійний зв’язок. У назві відповідного алкану закінчення ан змінюється на ін (ин). У розгалужених алкінах вибирають головний ланцюг так, щоб він містив потрійний зв’язок, навіть якщо він при цьому й не буде найдовшим. Перед назвою головного ланцюга вказують номер атома Карбону, при якому перебуває замісник, і назву цього замісника. Номер після назви головного ланцюга вказує положення потрійного зв’язку, наприклад:
1 |
2 |
3 |
4 |
5 |
|||||
H3C |
|
C |
|
C |
|
|
CH |
|
CH3 |
|
|
|
|
||||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
CH3
4метилпентин2
Будова алкінів
Атоми Карбону при потрійному зв’язку перебувають у стані sp-гібридизації. Два σ -зв’язки, утворені гібридними орбіталями, розташовуються вздовж однієї лінії під кутом 180° один щодо одного; два π -зв’язки утворені при перекриванні двох пар негібридних p-орбіталей сусідніх атомів Карбону. Додаткове зв’язування двох атомів Карбону призводить до того, що відстань між ядрами зменшується, оскільки потрійний зв’язок є поєднанням одного σ -зв’язку і двох π -зв’язків. Довжина потрійного зв’язку C ≡ C становить0,121нм,щоменшезадовжину як одинарного, так і подвійного зв’язку. Енергія потрійного зв’язку становить 828 кДж/моль.
Фізичні властивості алкінів
Фізичні властивості алкінів схожі на властивості алканів та алкенів. При звичайних
умовах (C2 −C4 ) — гази, (C5 −C16 ) — рідини, починаючи із C17 — тверді речовини. Температури
кипіння алкінів вищі, ніж у відповідних алкенів. Так, етилен має температуру кипіння –103 °С, ацетилен кипить при –83,6 °С; пропен і пропін відповідно при –47 °С і –23 °С.
Розчинність нижчих алкінів у воді трохи вища, ніж алкенів та алканів, однак усе-таки вона дуже мала. Алкіни добре розчиняються в різних органічних розчинниках.
добування алкінів
1. Загальний спосіб добування алкінів — відщеплення двох молекул галогеноводню від дигалогеналканів, які містять два атоми галогену або в сусідніх, або в одного атома Карбону, під дією спиртового розчину лугу:
CH2Br −CH2Br +2KOH(спирт. розчин) →
→ HC ≡ CH +2KBr +2H2O, CH3 −CBr2 −CH3 +2KOH(спирт. розчин) →
→CH ≡ C −CH3 +2KBr +2H2O.
2.Гомологи ацетилену можна також добува-
ти, діючи галогеналканами на солі ацетиленових вуглеводнів (ацетиленіди):
CH3 −C ≡ CNa +Br −R → CH3 −C ≡ C −R +NaBr. 3. У промисловості ацетилен добувають шля-
хом високотемпературного крекінгу метану: 2CH4 → CH ≡ CH +3H2
або його найближчих гомологів — етану й пропану, причому в цьому разі ацетилен утворюється при більш низьких температурах 1200 °С:
C2H6 → C2H2 +2H2, 2C3H8 →3C2H2 +5H2 .
Сировиною в цих способах є природний газ або нафта.
4. У лабораторних умовах ацетилен добувають гідролізом кальцій карбіду:
CaC2 +2H2O = Ca(OH)2 +C2H2 ↑.
хімічні властивості алкінів
Хімічні властивості алкінів обумовлені наявністю в їхніх молекулах потрійного зв’язку. Типовими реакціями для ацетилену та його гомологів є реакції приєднання. Відмінність алкінів від алкенів полягає в тому, що реакції приєднання можуть протікати у дві стадії. На першій стадії йде приєднання до потрійного зв’язку утворенням подвійного зв’язку, а на другій стадії — приєднання за подвійним зв’язком. Реакції приєднання для алкінів протікають повільніше, ніж для алкенів.
1. Галогенування. Галогени приєднуються до алкінів у дві стадії. Наприклад, приєднання
172
брому до ацетилену призводить до утворення диброметену, який, у свою чергу, реагує з надлишком Вr2 з утворенням тетраброметану:
CH ≡ CH +Br2 → CHBr = CHBr ,
CHBr = CHBr +Br2 →CHBr2 −CHBr2 .
Алкіни, так само як і алкени, знебарвлюють бромну воду.
2. Гідрогалогенування. Галогеноводні при-
єднуються до потрійного зв’язку важче, ніж до подвійного. Для активації галогеноводню використовують AlCl3 . З ацетилену при цьому можна добувати вінілхлорид (хлоретен), який використовують для добування важливого полімеру — полівінілхлориду:
CH ≡ CH +HCl → CH2 = CHCl.
У разі надлишку галогеноводню відбувається повне гідрогалогенування, причому для несиметричних алкінів на кожній стадії приєднання йде за правилом Марковникова, наприклад:
CH3 −C ≡ CH +2HBr → CH3 −CBr2 −CH3 .
3. Гідратація. Приєднання води до алкінів каталізується солями ртуті (II):
|
|
→ CH3 |
−CH |
= O. |
HC ≡ CH +H2O → CH2 |
= CH −OH |
|||
На першій стадії |
реакції утворюється |
не- |
||
насичений спирт, в якому гідроксильна група перебуває безпосередньо в атома Карбону при подвійному зв’язку. Такі спирти заведено називати вініловими, або енолами. Прикметною рисою енолів єїхнянестійкість.У моментутвореннявони ізомеризуються в більш стабільні карбонільні сполуки (альдегіди або кетони) за рахунок перенесення протона від гідроксильної групи до сусіднього атома Карбону при подвійному зв’язку. При цьому подвійний зв’язок між атомами Карбону розривається й утворюється подвійний зв’язок з атомом Карбону та атомом Оксигену. Причиною ізомеризації є більша міцність подвійного зв’язку C = O порівняно з подвійним C = C.
Урезультатіреакціїгідратаціїтількиацетилен перетворюється в альдегід; гідратація гомологів ацетилену протікає за правилом Марковникова, і утворені еноли ізомеризуються в кетони. Наприклад, пропін перетворюється в ацетон:
|
|
→ |
CH3 −C ≡ CH +H2O → CH3 |
−C(OH) = CH2 |
|
|
→ CH3 −CO −CH3. |
|
Реакцію гідратації алкінів відкрив М.Г. Кучеров (1881 р.), саме тому її й називають реакцією Кучерова.
4. Кислотні властивості. Особливістю алкінів, що мають кінцевий кратний зв’язок, є їхня здатність відщеплювати протон під дією сильних основ, тобто проявляти слабкі кислотні властивості. Таким чином, алкіни, на відміну від алкенів та алканів, здатні утворювати солі, які називають ацетиленідами:
R −C ≡ C −H +NaH → R −C ≡ C −Na +H2 .
Ацетиленіди Аргентуму й Купруму(I) легко утворюються й випадають в осад при пропусканні
ацетилену через аміачний розчин аргентум оксиду абокупрум(І)хлориду.Ціреакціїслугуютьдлявиявлення алкінів з потрійним зв’язком у кінці ланцюга: HC ≡ CH +2Ag(NH3 )2 OH →
→ Ag −C ≡ C −Ag ↓+4NH3 +2H2O .
білий
осад
R −C ≡ CH + Cu(NH3 )2 Cl →
→R −C ≡ C −Cu ↓+NH4Cl +NH3 .
червоний
осад
Ацетиленіди Аргентуму й Купруму як солі дуже слабких кислот легко розкладаються при дії хлороводневої кислоти з виділенням вихідного алкіну:
R −C ≡ C −Cu +HCl → R −C ≡ CH +CuCl.
Таким чином, використовуючи реакції утворення й розкладу ацетиленідів, можна виділяти алкіни із сумішей з іншими вуглеводнями.
5. Полімеризація.Уприсутностікаталізаторів алкіни можуть реагувати один з одним, причому залежно від умов утворюються різні продукти. Так, під дією водного розчину CuCl та NH4Cl ацетилен димеризується, утворюючи вінілацетилен:
HC ≡ CH +HC ≡ CH → CH2 = CH −C ≡ CH.
Вінілацетиленмаєвеликуреакційнуздатність, приєднуючи хлороводень, він утворює хлоропрен, який використовують для добування штучного каучуку:
CH2 = CH −C ≡ CH +HCl →CH2 = CH −CHCl = CH2.
При пропусканні ацетилену над активованим вугіллям при температурі +600 °С відбувається тримеризація ацетилену з утворенням бензену:
3HC ≡ CH → C6H6 .
В аналогічні реакції тримеризації можуть також вступати й найближчі гомологи ацетилену, наприклад:
CH3
3CH3 −C ≡ CH →
H3C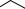
 CH3
CH3
6. Реакції окиснення й відновлення. Алкіни легко окиснюються різними окисниками, зокрема калій перманганатом. При реакції розчин калій перманганату знебарвлюється, що свідчить про наявність потрійного зв’язку. При окисненні зазвичай відбувається розщеплення потрійного зв’язку, утворюються карбонові кислоти:
R −C ≡ C −R +3[O]+H2O → R −COOH +R −COOH.
У присутності металевих каталізаторів алкіни відновлюються шляхом послідовного приєднання молекул водню, перетворюючись спочатку в алкени, а потім в алкани:
CH3 −C ≡ CH +H2 → CH3 −CH = CH2
CH3 −CH = CH2 +H2 →CH3 −CH2 −CH3 .
173
