
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
У цьому разі на допомогу приходять хіміки. Аби зарадити справі, вчені-хіміки запропонували штучно вносити в ґрунт сполуки необхідних елементів. Найнеобхіднішими для життєдіяльності рослин є такі елементи: C, H, O, N, P, K, Ca, Mg, Fe та S. Ці елементи необхідні рослинам у великих кількостях, тому добрива, які їх містять, називають макродобривами. Інші елементи, які рослини потребують у менших кількостях, також вносять у ґрунт за допомогою добрив. Такі речовини нази-
вають мікродобривами.
Залежно від складу добрив, їх поділяють на прості, складні й змішані. До складу простих добрив входить тільки один необхідний елемент (наприклад, амоній хлорид містить тільки один живильний компонент — Нітроген), до складу складних добрив входить кілька корисних компонентів (наприклад, нітрофоска містить Нітроген, Фосфор та Калій), а змішані добрива виготовляють шляхом звичайного змішування кількох добрив.
Найбільш важливими добривами є:
— нітрати лужних металів та амоніаку (селітри) — цінні природні нітратні добрива,
акалій нітрат до того ж ще й калійне добриво;
—карбамід (сечовина) CO(NH2 )2 — високоефективне нітратне добриво, яке за вмістом Нітрогену перевершує аміачну селітру, здебільшого його застосовують для вирощування таких культур, як картопля, кукурудза, буряк та рис;
—фосфористе борошно — продукт переробки кісток свійської худоби; головна перевага фосфористого борошна — повільне розчинення в ґрунті, що обумовлює тривалу дію добрива;
—простий суперфосфат — суміш сульфатів
лужноземельних металів та Ca(H2PO4 )2 H2O;розведене (малий вміст Фосфору), але досить ефективне добриво на багатьох видах ґрунтів;
—подвійний суперфосфат — концентроване фосфатне добриво, яке добувають із природних фосфатів дією фосфатної кислоти; містить до 50% Фосфору;
—преципітат — являє собою сполуку
CaHPO4 2H2О; за своїми агрохімічними властивостями дуже схожий на подвійний суперфосфат, однак вартість преципітату приблизно у 2 рази вища, що обмежує його застосування в сільському господарстві;
—хлорид та сульфат Калію — ефективне калійне добриво, яке використовують як у кристалічній формі, так і в розчиненій;
—амофос — суміш NH4H2PO4 та (NH4 )2 HPO4 ; високоефективне складне нітратно-фосфатне добриво, яке добувають нейтралізацією фосфатної кислоти амоніаком;
—нітроамофоска та амофоска — складні високоефективні потрійні добрива, що містять Нітроген, Фосфор та Калій.
карБОн. силіцій
характеристика хімічних елементів
властивості хімічних елементів
|
властивість |
карбон |
|
|
|
силіцій |
|||||||
Хімічний символ |
C |
|
|
|
Si |
||||||||
Порядковий номер |
6 |
|
|
14 |
|
|
|
||||||
Атомна маса |
12,011 |
|
|
28,0855 |
|
|
|||||||
Місце в ПС |
2 період; |
|
3 період; |
||||||||||
|
|
|
|
|
IV група |
|
|
|
IV група |
||||
Число електронів |
|
|
|
|
|
|
|
|
|
||||
на енергетичних |
2; 2 |
|
|
2; 8; 2 |
|
|
|||||||
рівнях |
|
|
|
|
|
|
|
|
|
|
|
|
|
Радіус атома, нм |
0,077 |
|
|
0,117 |
|
|
|||||||
Потенціал йоніза- |
|
|
|
|
|
|
|
|
|
||||
ції, еВ |
|
|
|
11,26 |
|
|
8,15 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||
Спорідненість |
1,27 |
|
|
1,5 |
|
|
|
||||||
з електроном, еВ |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||
Відносна електро- |
2,5 |
|
|
1,74 |
|
|
|
||||||
негативність |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||
Електронна кон- |
2s22p2 |
|
|
|
3s23p2 |
||||||||
фігурація валент- |
|
|
|
||||||||||
ного рівня |
|
|
|
|
|
|
|
|
|
||||
Можливі валент- |
II, III, IV |
|
II, IV |
||||||||||
ності |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
Можливі ступені |
–4, 0, +2, +4 |
|
–4, 0, +2, +4 |
||||||||||
окиснення |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|||||
Ізотопний склад |
12C — 98,892% |
2928Si — 92,21% |
|||||||||||
|
|
|
|
|
13 |
|
|
|
Si — 4,70% |
||||
|
|
|
|
|
C — 1,108% |
30Si — 3,09% |
|||||||
Вміст у земній |
0,15% |
|
|
20% |
|
|
|||||||
корі, мол.% |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||
|
Електронна будова атомів Карбону й Силіцію |
||||||||||||
схематично показана нижче: |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
s |
p |
|
|
d |
||||
6 |
C |
|
|
14Si 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
s |
p |
s |
p |
|
|
|
|
|
|
||||
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
У |
незбудженому стані |
атоми Карбону |
||||||||||
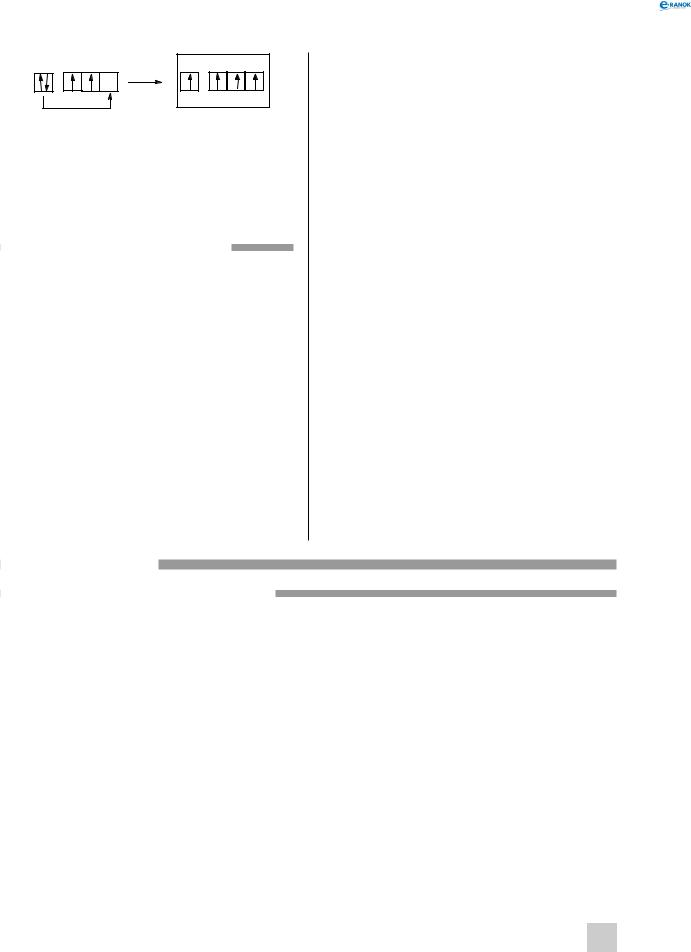
й Силіцію двовалентні, тому що на зовнішньому рівні перебуває 2 неспарених електрони:
s
 p
p
2 

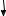


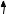

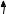

C
При збудженні атома відбувається розпаровування електронної пари, яка перебуває на 2s-підрівні. При цьому Карбон і Силіцій проявляють чотиривалентний стан. На наступній схемі зображено електронний перехід при утворенні чотиривалентного стану для атома Карбону; процеси, які відбуваються в електронній оболонці атома Силіцію, аналогічні:
134
s |
p |
s |
p |
2 |
|
2 |
|
|
C |
|
C* |
На відміну від елементів, розглянутих раніше (галогени, халькогени та пніктогени), для атомів Карбону й Силіцію нехарактерні електронні переходи за участю вакантного d-підрівня, тому найвища валентність цих атомів дорівнює 4.
Обидва елементи можуть проявляти ступені окиснення –4, +2 та +4.
поширеність атомів у природі
Карбон є досить розповсюдженим елементом на Землі. Його масова частка становить близько 0,023% за масою. У земній корі він трапляється у вигляді сполук з Гідрогеном — вуглеводнями, з яких складається нафта (близько 85% Карбону), природний газ (близько 70% Карбону), чорне (близько 90% Карбону) та буре вугілля (близько 70% Карбону) й горючі сланці. Усі ці сполуки необхідні як паливо для різних цілей. Річний видобуток цих природних горючих речовин становить мільйони тонн.
Атоми Карбону входять також до складу багатьох мінералів, таких як вапняк, крейда, мармур, основним компонентом яких є кальцій карбонат (CaCO3 ); доломіт — CaMg(CO3 )2 ; трона — суміш Na2CO3 таNaHCO3;магнезит—MgCO3;смітсоніт—
ZnCO3; церусит — PbCO3; сидерит — FeCO3; родо-
хрозит — MnCO3 та деякі інші. Окрім твердої поверхні землі, Карбон міститься також в атмосфері нашої планети, входячи до складу вуглекислого
газу — CO2. Близько 2,3 1012 тонн або 0,03% (за об’ємом) атмосфери становить вуглекислий газ. У Світовому океані міститься близько 4 1013 тонн зв’язаного Карбону у вигляді карбонатів (CO23− ) та гідрогенкарбонатів (HCO3− ).
Карбон є початком життя на Землі. Починаючи від найпростішого одноклітинного організму й закінчуючи людиною, усе живе на нашій планеті містить величезні кількості Карбону. Він необхідний для життя так само, як цегла для спорудження будинку. Сполуки Карбону з деякими елементами (Гідрогеном H, Оксигеном O, Нітрогеном N та іншими) вивчає окрема хімічна дисципліна — органічна хімія. Карбон входить до складу білків, жирів, вуглеводів, ДНК та більшості інших біологічно важливих речовин.
Силіцій — другий за поширеністю елемент на Землі. Його вміст у земній корі становить 29,5% за масою. Якщо Карбон є найважливішим елементом для живої матерії, то Силіцій є основним компонентом неживої матерії. Сполуки, до складу яких входить атом Силіцію, становлять 74% від маси Землі.
Найпоширенішим мінералом, до складу якого входить атом Силіцію, є кварц (або кремнезем) SiО2, що зустрічається у вигляді простого піску. З інших мінералів варто виокремити такі: ортоклаз
K2Al2Si6O16; каолін Al2O3 2SiО2 2H2O; нефелін NaKO Al2O3 2SiО2; циркон ZnSiО3; полуцит
3Cs2O 2Al2O3 9SiО2 H2O.
Силіцій у малих кількостях необхідний усім живим організмам. В організмі людини Силіцію найбільше в нігтях та волоссі, а в 1 грамі легеневої тканини міститься 0,65мг Силіцію.
прості речовини
Фізичні властивості простих речовин
властивості |
|
графіт |
|
алмаз |
|
карбін |
|
кремній |
||||
Формула сполуки |
|
|
C∞ |
|
C∞ |
|
|
C∞ |
|
Si |
||
Зовнішній вигляд у зви- |
Сірий, має ме- |
Блискучі |
|
прозорі |
Чорна тверда ре- |
Темно-сіра речо- |
||||||
кристали, |
сильно |
вина з металіч- |
||||||||||
чайних умовах |
талічний блиск |
заломлює світло |
човина |
|
|
ним блиском |
||||||
|
|
|
|
|
|
|
|
|||||
Температура плавлення |
+ |
3 |
7 0 |
0 |
+1200 |
°С |
— |
+2000 |
°С |
— |
+1415 °С |
|
°С — сублімується |
перехід у графіт |
перехід у графіт |
||||||||||
|
з розкладом |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||
Температура кипіння |
|
|
— |
|
— |
|
|
— |
|
+2620 °С |
||
Густина при н. у. |
2,3 г/см3 |
|
3,5 г/см3 |
|
|
|
2 г/см3 |
|
|
2,3 г/см3 |
||
Розчинність у воді |
Нерозчинний |
|
Нерозчинний |
|
Нерозчинний |
|
Нерозчинний |
|||||
|
0,1 |
від |
електро- |
|
|
|
|
Напівпровідник |
0,001 від електро- |
|||
Електрична провідність |
Діелектрик |
|
провідності ртуті; |
|||||||||
провідності ртуті |
|
nтипу |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
напівпровідник |
Твердість (за шкалою |
2 (уздовж шарів), |
10. Найтвердіший |
|
|
|
|
||||||
5 (упоперек). До- |
3. Нетвердий |
|
7. Досить твердий |
|||||||||
Мооса) |
сить м’який |
|
мінерал |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
Провідність |
теп- |
Гарний провідник |
Теплоту |
прово- |
Гарний провідник |
||||||
Теплопровідність |
лоти в 3 рази кра- |
теплоти |
|
|
|
дить погано |
|
теплоти |
||||
|
ща, ніж у ртуті |
|
|
|
|
|
|
|
|
|||
135
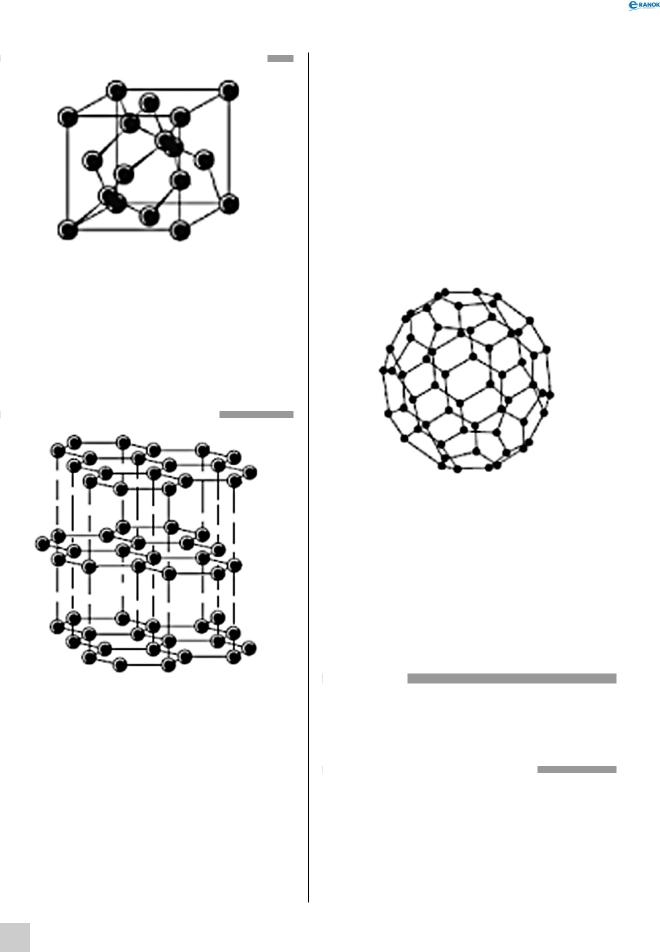
Будова кристалічної ґратки алмазу:
Як видно з малюнка, усі атоми Карбону в алмазі зв’язані з чотирма сусідніми атомами. За рахунок дуже щільної упаковки атомів у кристалі, алмаз має дуже високу твердість та густину. Попри те, що алмаз і є найтвердішою природною речовиною, він має високу крихкість, і тому огранування алмазів не складає жодних труднощів. Атоми Карбону в алмазі перебувають у sp3-гібрид- ному стані.
кристалічна будова графіту:
У графіті атоми Карбону з’єднані в шари. Шари складаються з правильних шестикутників. Відстань між шарами у 2,36 раза більша від одинарного C −C зв’язку в шарі, тому сусідні шари не мають міцного зв’язку один з одним. Саме тому графітні стрижні можна застосовувати для письма, оскільки при терті грифелем олівця об папір послідовно стираються шар за шаром, залишаючи на папері сірий слід. Атоми Карбону
вграфіті перебувають в sp2-гібридному стані, що забезпечує плоску структуру шару. Три електрони утворюють три зв’язки із сусідніми атомами
вшарі, а четвертий електрон може виконувати дві функції: забезпечувати зв’язок між шарами або забезпечувати електронну провідність.
Молекули карбіну являють собою лінійні ланцюги, що складаються з атомів Карбону, зв’язаних подвійними зв’язками (полікумулен) або навперемінними одинарними та потрійними зв’язками (карбін).
Крім того, виділяють таку алотропну форму, як «аморфний» вуглець. Насправді він являє собою маленькі (від 10 до 300 атомів) фрагменти графіту, хаотично об’єднані в одну неплоску несиметричну структуру. Залежно від методу добування та деяких фізичних властивостей, виділяють кілька типів аморфного вуглецю: деревне вугілля, тваринне вугілля та сажу.
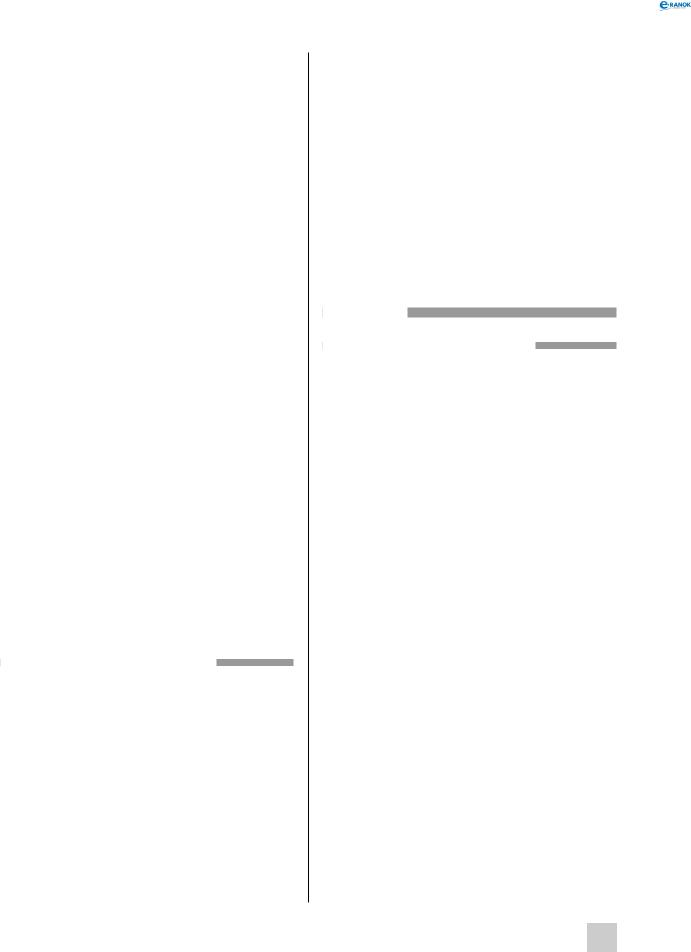
Окрім наведених модифікацій Карбону, існують іще так звані фулерени, чиї молекули мають кулясту форму:
Фулерени являють собою темні порошки, які сублімуються при температурі понад +350 °С і проявляють властивості напівпровідника.
За певних умов можуть утворюватися так звані «нанотрубки» або «тубулени», які являють собою порожнисту вуглецеву трубку, з обох кінців закриту кришками, схожими на фрагменти шматків фулерена. Розміри однієї молекули нанотрубки досить великі: довжина від 20 до 50 нм, а діаметр від 0,9 до 12 нм (1 нм = 10—9 м).
хімічні властивості простих речовин
Прості речовини, утворені атомами елементів IV групи, при нормальних умовах є досить інертними, однак при високих температурах взаємодіють із багатьма речовинами.
хімічні властивості вуглецю
Хімічні властивості алотропних модифікацій Карбону відрізняються лише активністю сполук у хімічних реакціях, тому всі реакції будемо розглядати на прикладі графіту.
Вуглець не розчиняється ні в кислотах, ні в лугах, і тільки концентровані сульфатна та нітратна кислоти окиснюють вуглець до карбон діоксиду.
При нормальних умовах роздроблений на порошок графіт реагує тільки з фтором, а при
136
високихтемпературахвідбуваєтьсяреакціязкиснем і сіркою та воднем, при цьому в більшості випадків утворюються сполуки чотиривалентного Карбону:
C +2F2 t→CF4 ,
C+2S t→CS2 , C +2H2 t→CH4 ,
C+O2 t→CO2.
Аколи кисню не вистачає, утворюється кар-
бон монооксид:
2C +O2 t→2CO.
При сплавлянні з деякими металами утворюються карбіди:
4Al +3C t→Al4C3,
Ca +2C t→CaC2 .
Карбіди металів при гідролізі (при взаємодії з водою) утворюють вуглеводні та гідроксиди металів:
Al4C3 +12H2O →4Al(OH)3 ↓ +3CH4 ↑,
CaC2 +2H2O → Ca(OH)2 +C2H2 ↑.
Вуглець є гарним відновником. Наприклад, його використовують для добування деяких металів з їхніх оксидів та деяких солей:
ZnO +C →Zn +CO,
Fe2O3 +3C →2Fe +3CO,
Na2CO3 +2C t→2Na +3CO.
За рахунок своїх відновних здатностей вуглець може взаємодіяти з кислотами-окисниками, наприклад такими, як концентрована сульфатна й нітратна кислоти:
C +2H2SO4 →CO2 ↑ +2SO2 ↑ +2H2O,
3C +4HNO3 →3CO2 ↑ + 4NO ↑ +2H2O.
З лугами вуглець не реагує.
хімічні властивості кремнію
Кремній є досить інертною речовиною за рахунок високої енергії кристалічної ґратки. При кімнатній температурі силіцій реагує тільки з фтором:
Si +2F2 → SiF4 .
При більш високих температурах кремній реагує з хлором, киснем, азотом та вуглецем. При цьому утворюються, відповідно, хлорид, оксид, нітрид та карбід силіцію:
Si +2Cl2 400 °C→SiCl4 ,
Si +O2 600 °C→SiO2 , 3Si +2N2 1000 °C→Si3N4 , Si +C 2000 °C→SiC.
При сплавлянні кремнію з металами утворюються сполуки, аналогічні до карбідів — силіциди:
Si +2Mg t→Mg2Si,
Si +2Ca t→Ca2Si.
Із чистими кислотами кремній не реагує, зате розчиняється в суміші нітратної та плавикової кислот — дуже сильного окисника, при цьому утворюється сильна гексафторсилікатна кислота:
3Si +4HNO3 +18HF →3H2SiF6 +4NO +8H2O.
Кремній взаємодіє також із гарячими розчинами лугів:
Si +2NaOH +H2O → Na2SiO3 +2H2 .
методи добування простих речовин
методи добування вуглецю
Добування вуглецю хімічними методами не вигідне, оскільки набагато дешевше й простіше добувати вуглець із природного вугілля, світовий щорічний видобуток якого становить близько 2 мільярдів тонн. Зупинімося більш докладно на добуванні різних алотропних модифікації вуглецю.
Алмаз. При температурі +1500 °С та тискові 65 тисяч атмосфер у суміші графіту й рідкого каталізатора (заліза або нікелю) утворюються штучні алмази. У такий спосіб за десять хвилин можна отримати близько 20 грамів дрібних алмазів. За іншою методикою добувають алмази дією на ту саму суміш графіту та каталізатора вибуховою хвилею, у цьому разі можна перевести в алмаз майже весь графіт, але кристали добутого алмазу дуже малі.
Великі родовища алмазів виявлені в Якутії й Африці.
Графіт. Графіт зазвичай добувають із його родовищ, які іноді бувають досить потужними. Річний видобуток графіту становить приблизно 500 тисяч тонн.
Досить розповсюджений метод добування графітних виробів заданої форми. Для цього металорганічну сполуку певної форми нагрівають до +500...800 °С за відсутності повітря. Унаслідок такого процесу відбувається графітизація речовини.
Активоване вугілля. Активоване (або активне) вугілля добувають нагріванням кам’яного або тваринного вугілля в струмені водяної пари та повітря. При цьому різні домішки з вугілля витягуються й відбувається часткове окиснення вугілля. За рахунок очищення від домішок на поверхні вугілля утворюється велика кількість пор, а за рахунок окиснення повітрям — з’являються такі структурні фрагменти, як C = O , C −OH .
137
