
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
арОматиЧні вуглевОдні (арени)
поняття про ароматичні сполуки
Ароматичними вуглеводнями (аренами) називають речовини, в молекулах яких міститься одне або кілька бензенових кілець — циклічних груп атомів Карбону з особливим характером зв’язків. Найпростішим представником ароматичних сполук є бензен. Першу структуру бензену запропо-
нував у 1865 р. німецький учений А. Кекуле:
H
HH
або просто
H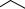
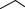 H
H
H
Ця формула правильно відтворює рівноцінність шести атомів Карбону, однак не пояснює низку особливих властивостей бензену. Наприклад, незважаючи на ненасиченість, бензен не проявляє схильності до реакцій приєднання: він не знебарвлює бромну воду й розчин калій перманганату, тобто не дає типових для ненасичених сполук якісних реакцій. Саме тому питання, пов’язане з будовою бензолу, привертало увагу дослідників упродовж десятків років.
До ароматичних сполук належать сполуки, які проявляють властивість ароматичності. Один із критеріїв ароматичності був сформульований німецьким фізиком Е. Хюккелем і відомий як правило Хюккеля. Згідно із цим правилом, ароматичні молекули повинні мати плоский циклічний карбоновий ланцюг і число узагальнених π -електронів дорівнює 4n + 2, де n = 0, 1, 2, 3 тощо. Тільки в цьому разі молекула буде мати ароматичний характер. Число узагальнених π -електронів може бути 6, 10, 14 тощо:
Структурна |
|
|
|
формула |
|
|
|
Молекулярна |
C6H6 |
C10H8 |
|
формула |
|||
Число |
6 |
10 |
|
π -електронів |
|||
|
|
||
Назва |
Бензен |
Нафталін |
|
Структурна |
|
|
|
формула |
|
|
|
Молекулярна |
C14H10 |
C14H10 |
|
формула |
|||
Число |
14 |
14 |
|
π -електронів |
|||
|
|
||
Назва |
Антрацен |
Фенантрен |
Будова бензену
Особливості будови та властивостей бензену вдалося пояснити тільки після розвитку сучасної теорії хімічних зв’язків.
Згідно із сучасними уявленнями, шість атомів Карбону в молекулі бензену перебувають у sp2-гібридному стані. Кожен атом Карбону утворює σ -зв’язки із двома іншими атомами Карбону та одним атомом Гідрогену, що лежать в одній площині. Кути між трьома σ -зв’язками дорівнюють 120°. Таким чином, усі атоми Карбону лежать в одній площині, утворюючи правильний шестикутник.
Кожен атом Карбону має одну негібридну p-орбіталь. Шість таких орбіталей розташовуються перпендикулярно до площини циклу з атомів Карбону й паралельно один до одного:
Усі шість p-електронів взаємодіють між собою, утворюючи π -зв’язки, не локалізовані в пари, як при утворенні звичайних подвійних зв’язків, а такі, що утворюють єдину π -електронну хмару. Таким чином, у молекулі бензену здійснюється кругове зв’язування. Найбільша π -електронна густина у цій зв’язаній системі розташовується над і під площиною карбонового ланцюга:
H H
H
H


 H
H
HH
Як наслідок, усі зв’язки між атомами Карбону в бензені вирівняні й мають довжину 0,139 нм. Ця величина є проміжною між довжиною одинарного зв’язку в алканах (0,154 нм) і довжиною подвійного зв’язку в алкенах (0,133 нм). Рівноцінність зв’язків заведено позначати кружечком усередині циклу:
Кругове зв’язування дає виграш в енергії 150 кДж/моль. Ця величина становить енергію зв’язування — кількість енергії, яку необхідно затратити, щоб порушити ароматичну систему бензолу. Така електронна будова пояснює всі особливості бензену. Зокрема, зрозуміло, чому бензен важко вступає в реакції приєднання — це призводить до порушення зв’язування. Такі
174
реакції можливі тільки в дуже жорстких умовах. Сукупність властивостей бензену заведено називати проявом ароматичного характеру, або ароматичністю.
гомологічний ряд аренів
Залежно від числа бензенових ядер у молекулах ароматичних сполук, арени поділяють на одноядерні, двох’ядерні, триядерні тощо. До одноядерних аренів належать бензен та його похідні, загальна формула вуглеводнів ряду бензену: CnH2n- 6. Відповідно, першим членом гомологічного ряду одноядерних аренів є вуглеводень із шістьма атомами Карбону, тобто C6H6 — бензен. Формула наступного члена гомологічного ряду відрізняється від бензолу на групу CH2 −C7H8 (метилбензен, або толуен). До двох’ядерних аренів належать нафталін та його похідні, загальна формула вуглеводнів ряду нафталіну: CnH2n-12 (першим членом гомологічного ряду є вуглеводень із десятьма атомами Карбону C10H8 — нафталін). Загальна формула триядерних аренів:
CnH2n–18 (перший член ряду містить 14 атомів Карбону C14H10).
номенклатура та ізомерія
Структурна ізомерія в ряді бензену обумовлена взаємним розташуванням замісників у кільці. Якщо в бензеновому кільці тільки один замісник, то така сполука не має ароматичних ізомерів, тому що всі атоми Карбону в бензеновому ядрі рівноцінні. Назви таких сполук складають, указуючи замісники в бензеновому ядрі:
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
CH |
|
CH3 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
метилбензен (толуен) |
етилбензен |
||||||||||||||||||||||||
|
|
|
CH |
|
CH |
|
CH3 |
H3C |
|
|
CH |
|
CH3 |
||||||||||||
|
|
|
2 |
2 |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пропілбензен |
ізопропілбензен (кумол) |
|||||||||||||||||||||||
Якщо з кільцем зв’язані два замісники, то вони можуть перебувати в трьох різних положеннях відносно один одного. Положення замісників указують цифрами або позначають словами: орто
(о-), мета (м-), пара (п-): |
|
|
|
|
||||
|
|
|
CH3 |
|
|
CH3 |
||
|
|
|
|
CH3 |
|
|
|
CH3 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
одиметилбензен мдиметилбензен (1,2диметилбензен) (1,3диметилбензен)
CH3 |
CH3 |
CH3 |
NO2 |
пдиметилбензен пнітротолуен (1,4диметилбензен) (1метил4нітробензен)
Якщо в бензеновому ядрі більше двох замісників, то їхнє положення вказують переважно цифрами, причому нумерація атомів Карбону в циклі починається з найбільш старшого замісника в бік найближчого сусіднього замісника:
|
|
NO2 |
Cl |
|
|
|
OH |
|||||||
|
1 |
Cl |
|
|
1 |
|
||||||||
2 |
||||||||||||||
6 |
|
|
|
|
|
2 |
|
|
|
|
|
|
||
5 |
|
|
4 |
|
3 |
|
3 |
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
CH3 |
|
|
|
Cl |
|||||||
4метил2хлор |
1гідрокси2,4ди |
|||||||||||||
нітробензен |
хлорбензен |
|||||||||||||
При відщепленні атома Гідрогену від молекул ароматичних вуглеводнів утворюються ароматичні радикали загальної формули CnH2n–7 (їх називають арильними радикалами), найпростіші з яких — феніл і бензил:
CH2
феніл бензил
Фізичні властивості аренів
Перші члени гомологічного ряду бензену — безбарвні рідини зі специфічним запахом. Вони легші за воду й у ній не розчиняються. Добре розчиняються в органічних розчинниках і самі є гарними розчинниками для багатьох органічних речовин. Бензен має характерний, досить приємний запах, але при цьому є дуже токсичним.
Вдихання парів бензену викликає запаморочення й головний біль. При високих концентраціях бензену можливі випадки втрати свідомості. Його пари подразнюють очі й слизову оболонку. Рідкий бензен проникає в організм через шкіру, і це може призвести до отруєння. У жодному разі не можна пити бензен. Це дуже небезпечно, тому, працюючи з бензеном (та його гомологами), слід бути дуже обережним.
175

добування аренів
1. Дегідроциклізація — добування з аліфатичних вуглеводнів. Для добування бензену та його гомологів у промисловості використовують ароматизацію насичених вуглеводнів, що входять до складу нафти. При пропусканні алканів з нерозгалуженим ланцюгом, що мають не менше 6 атомів Карбону в молекулі, над нагрітою платиною або хром оксидом відбувається дегідрування з одночасним замиканням циклу:
CH3
HC |
CH2CH |
Cr2O3 |
|
CH3 |
|||||||
|
|||||||||||
|
|
||||||||||
|
|||||||||||
2 |
|
|
|
3 |
|
|
|
|
|
|
+ 4H2 |
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
C |
CH2 |
|
|
|
|
|
|
|
||
|
|
H2 |
|
|
|
|
|
|
|
|
|
Із гексану при цьому виходить бензен, а з гептану — толуен.
2. Дегідрування циклоалканів також призводить до ароматичних вуглеводнів. Реакція відбувається при пропусканні парів циклогексану або його гомологів над нагрітою платиною:
Pt |
+3H2 |
|
3. Бензен можна добувати при тримеризації ацетилену. Реакція відбувається при пропусканні ацетилену над активованим вугіллям при температурі +600 °С:
3CH ≡ CH → C6H6 .
4. Гомологи бензену добувають із бензену при його взаємодії з алкілгалогенідами в присутності галогенідів Алюмінію (реакція ФріделяКрафтса):
C2H5
+ C2H5Cl |
AlCl3 |
HCl |
+ |
5. При сплавлянні солей ароматичних кислот з лугом виділяються арени в газоподібному вигляді:
C6H5COONa +NaOH → C6H6 +Na2CO3.
хімічні властивості аренів
У зв’язку з тим, що утворення ароматичного зв’язку (трьох зв’язаних подвійних зв’язків у шестичленному циклі) є надзвичайно енергетично вигідним, для аренів майже не характерні реакції приєднання, попри те, що вони є ненасиченими сполуками. Для аренів найбільш характерні реакції заміщення. Хоча поруч з реакціями заміщення
ароматичні вуглеводні все-таки можуть вступати в реакції приєднання. Зважаючи на те, що ці реакції призводять до порушення ароматичної системи, вони вимагають більших витрат енергії й протікають тільки в жорстких умовах.
1. Галогенування. Бензен та його гомологи взаємодіють із хлором або бромом у присутності каталізаторів — безводних AlCl3, FeBr3 або
AlBr3:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
||
|
|
|
|
|
|
+ Cl2 |
|
AlCl3 |
|
|
|
|
|
+ |
HCl |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
Із толуену за цією реакцією виходить суміш |
||||||||||||||||||||
орто- і пара-ізомерів. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
CH3 |
|
|
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|||||||
|
|
|
|
|
|
Cl2 |
AlCl3 |
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
або |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl
2. Нітрування. Бензен дуже повільно реагує з концентрованою нітратною кислотою навіть при сильному нагріванні. Однак при дії так званої нітрувальної суміші (суміш концентрованих нітратної та сульфатної кислот) реакція нітрування проходить досить легко:
C6H6 +HNO3 H2SO4→C6H5 −NO2 +H2O.
3. Сульфування. Реакція легко проходить під дією «димної» сульфатної кислоти (олеуму):
C6H6 +H2SO4 → C6H5 −SO3H +H2O.
4.Алкілування за ФріделемКрафтсом (див.
вище способи добування гомологів бензену).
5.Алкілування алкенами. Ці реакції широ-
ко використовують у промисловості для добування етилбензену та ізопропілбензену (кумолу). Алкілування проводять у присутності каталізатора
AlCl3:
C6H6 +CH2 = CH −CH3 → C6H5 −CH(CH3 )2 .
6. Гідрування бензену йде при нагріванні й високому тиску в присутності металічних каталізаторів (Ni, Pt, Pd). Бензен перетворюється в циклогексан:
Ni
+ 3H2
Гомологи бензену при гідруванні дають похідні циклогексану:
C6H5CH3 +3H2 → C7H14 .
7. Радикальне галогенування бензену відбу-
вається при взаємодії його парів із хлором тільки під впливом жорсткого ультрафіолетового випромінювання. При цьому бензен приєднує три молекули хлору й утворюється твердий продукт — гексахлорциклогексан (гексахлоран):
176
Cl
Cl Cl
+ 3Cl2 hν 

 Cl
Cl
 Cl
Cl
Cl
(атоми Гідрогену в молекулі C6H6Cl6 не зазначені).
8. Реакції в бічному ланцюзі. За хімічними властивостями алкільні радикали в ароматичних сполуках подібні до алканів. Атоми Гідрогену в них можуть заміщатися на галоген, тому за відсутності каталізатора при нагріванні або ультрафіолетовому опроміненні йде радикальна реакція заміщення в бічному ланцюзі. Вплив бензенового кільця на алкільні замісники призводить до того, що заміщається завжди атом Гідрогену в атома Карбону, безпосередньо пов’язаного з бензеновим кільцем ( α — атома Карбону).
CH |
|
CH3 |
|
|
|
|
|
|
CH |
|
CH |
|
2 |
hν |
|
3 |
|||||||||
|
|
+ Cl2 |
|
|
|
Cl |
+HCl |
|||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
||||||||
9. Окиснення. При дії на гомологи бензену калій перманганату та інших сильних окисників бічні ланцюги окиснюються. Яким би складним не був ланцюг замісника, він руйнується, за винятком α -атома Карбону, що окиснюється в карбоксильну групу. Гомологи бензену з одним бічним ланцюгом дають бензойну кислоту:
CH3 |
COOH |
|
CH CH |
|
|
[O] |
[O] |
2 |
3 |
|
|
|
||
Гомологи, які мають два бічні ланцюги, дають |
||||
двохосновні кислоти: |
|
|
|
|
CH3 |
COOH |
|
CH2 CH3 |
|
|
[O] |
[O] |
|
|
CH3 |
COOH |
|
CH3 |
|
правила орієнтації (заміщення) у бензеновому кільці
Найважливішим фактором, який визначає хімічні властивості ароматичної речовини, є розподіл у ній електронної густини, що залежить від типу замісників у бензеновому кільці.
Замісники поділяють на два типи:
— замісники першого роду (ортопара орієнтанти) — алкільні замісники, гідроксигрупа OH, аміногрупа NH2, атоми галогенів;
— замісники другого роду (мета- орієнтанти)—нітрогрупа−NO2 ,сульфогрупа−SO3H , альдегідна −CHO та карбоксильна групи
−COOH .
Наприклад, толуен, який містить замісник першого роду, нітрується й алкілується в пара- або орто-положення:
CH3 |
|
CH3 |
|
|
|
Br |
|
NO2 |
CH3 |
|
|
|
|
||
|
|
|
|
HNO3 |
Br2 |
|
|
H2SO4 |
FeBr3 |
CH |
|
CH3 |
|
3 |
|
NO2 |
|
Br |
|
Нітробензен, який містить замісник другого роду, нітрується й галогенується в мета-положен- ня:
NO2 |
NO2 |
|
NO2 |
HNO3 |
|
Br2 |
|
H2SO4 |
|
FeBr3 |
|
NO2 |
|
|
Br |
природні джерела і застосування вуглеводнів
перегонка нафти
Багато органічних речовин, з якими ви маєте справу в повсякденному житті,— пластмаси, фарби, мийні засоби, ліки, лаки, розчинники — синтезовані з вуглеводнів. У природі є три основних джерела вуглеводнів — нафта, природний газ і кам’яне вугілля.
Нафта — одне з найважливіших корисних копалин. Сучасне суспільство неможливо уявити собі без нафти і продуктів її переробки. Недарма країни, багаті нафтою, відіграють важливу роль у світовій економіці.
Нафта — темна масляниста рідина, що залягає в земній корі на різній глибині. Вона являє собою однорідну суміш складного виду, в якій міститься кілька сотень речовин — переважно насичених вуглеводнів з числом атомів Карбону від 1 до 40. При переробці цієї суміші використовують як фізичні, так і хімічні методи.
Спочатку нафтурозділяютьна простіші суміші (фракції) шляхом перегонки, заснованої на тому, що різні речовини у складі нафти киплять при різних температурах.
177

Фракції перегонки нафти
Фракція |
Число атомів карбону |
температура кипіння, |
застосування |
||
в молекулах |
°с |
||||
|
|
|
|||
|
|
|
|
||
Газова фракція |
1—4 |
< 20 °С |
Паливо |
||
Бензин |
|
5—10 |
20—180 °С |
Автомобільне паливо |
|
Лігроїн |
|
6—12 |
160—200 °С |
Паливо, сировина для синтезу |
|
Гас |
|
10—16 |
180—250 °С |
Авіаційний бензин |
|
Газойль |
|
13—25 |
220—350 °С |
Дизельне паливо |
|
Важкий |
газойль |
26—30 |
350—430 °С |
Паливо для теплоелектростанцій |
|
(мазут) |
|
||||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
При нагріванні роз- |
|
|
Важкий мазут |
> 30 |
кладається, пере- |
Виробництво асфальту, мастильних |
||
ганяють під вакуу- |
матеріалів, паливо для котелень |
||||
|
|
|
|||
|
|
|
мом |
|
|
|
|
|
|
|
|
Перегонка відбувається в ректифікаційній колоні при сильному нагріванні. Найважчі фракції, що за високої температури розкладаються, переганяють за зниженого тиску.
хімічна переробка нафтопродуктів
Багато продуктів перегонки нафти можна застосовувати відразу, без подальшої переробки. Однак найбільшу цінність для промисловості представляють легкі фракції — бензин і гас, але вихід їх при перегонці невеликий. До того ж після перегонки виходить бензин низької якості (з невеликим октановим числом), тому що нафта в основному містить вуглеводні з нерозгалуженим карбоновим кістяком, які при стискуванні детонують. Двигун, що працює на такому паливі, видає характерний стукіт і швидко виходить із ладу. Для підвищення якості бензину і збільшення його виходу нафту піддають хімічній переробці.
Один з найважливіших способів хімічної переробки нафти — крекінг. При нагріванні до 500 °С без доступу повітря у присутності спеціальних каталізаторів довгі молекули алканів розщеплюються на дрібніші. Під час крекінгу з насичених вуглеводнів утворюється суміш легших насичених і ненасичених вуглеводнів, наприклад:
C16H34 500 °C, kat →C8H16 +C8H18.
Цей процес приводить до збільшення виходу бензину і гасу. Якщо крекінг проводити в присутності алюмосилікатних каталізаторів (каталітичний крекінг), то утворюються алкани переважно розгалуженої будови, що підвищує якість палива (крекінг-бензин).
178
За сильнішого нагрівання нафти (до 700—900 °С) розщеплюються навіть молекули середніх розмірів, наприклад:
C8H18 800 °C, kat→C2H6 +3C2H4.
У суміші залишаються тільки найпростіші вуглеводні, переважно ненасичені. Цей процес, що називають піролізом, проводять для добування етилену — вихідної речовини для синтезу етанолу і пластмас. При піролізі утворюються також ароматичні вуглеводні.
Основоположником сучасних методів переробки нафти є видатний хімік В.М. Іпатьєв.
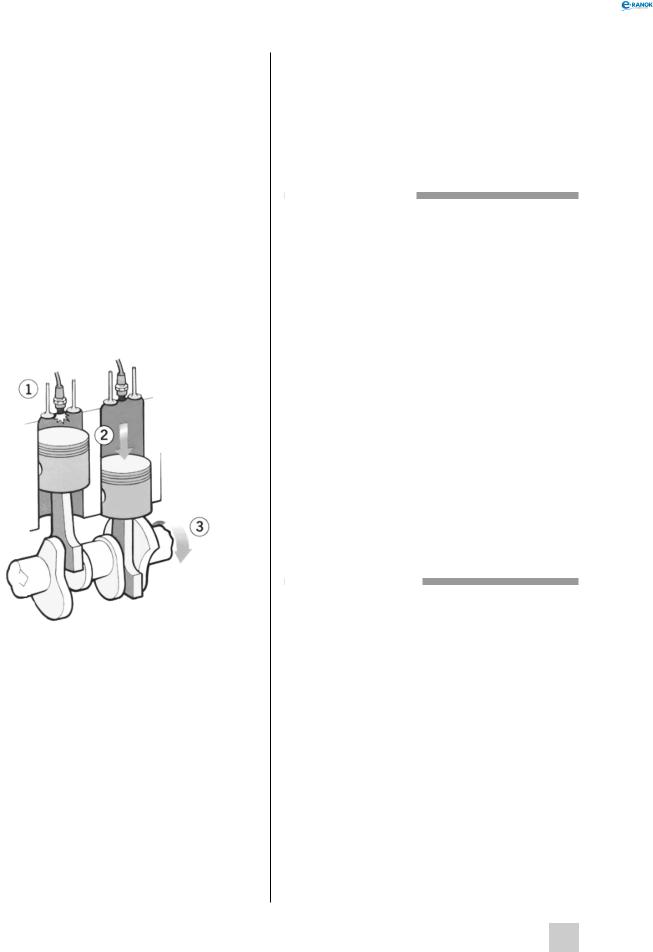
Однією з характеристик, якою позначають якість бензину, є так зване октанове число, що показує можливість детонації паливно-повітряної суміші в двигуні. Розглянемо, як впливає детонація на роботу двигуна. В циліндр двигуна внутрішнього згоряння подається суміш парів бензину з повітрям. При нормальній роботі двигуна в циліндрі ця суміш стискується поршнем і підпалюється свічкою:
Схема роботи двигуна внутрішнього згоряння:
1 — паливно-повітряна суміш стискується поршнем і підпалюється; 2 — продукти згоряння займають більший об’єм, тому витискують поршень; 3 — поршень прокручує вал двигуна.
Оскільки продукти згоряння мають більший об’єм, ніж вихідна суміш, вони штовхають назад поршень, який прокручає колінвал. Але бензин низької якості не встигає підпалитися свічкою, а при стисканні поршнем вибухає (детонує), і сила, що вивільнюється, не використовується на роботу двигуна. Це призводить до руйнування двигуна і погіршення його роботи. Чим вище значення октанового числа, тим менше вірогідність детонації бензину, а отже вище його якість.
Нормальний гептан — абсолютно непридатний як моторне паливо, він детонує майже завжди. В той же час 2,2,4-триметилпентан (ізооктан)
має унікальні властивості: він майже не детонує у двигуні. Ці дві речовини лежать в основі шкали вимірювання якості бензину — шкала октанових чисел. В цій шкалі гептану присвоєно значення нуль, а ізооктанові — сто. Згідно з цією шкалою бензин з октановим числом 90 має такі самі детонаційні властивості, як і суміш 90% ізооктану і 10% гептану.
природний газ
Друге за важливістю джерело вуглеводневої сировини — природний газ, головною складовою частиною якого є метан. Природний газ використовують у першу чергу як ефективне паливо. При його згорянні не утворюється ані зола, ані отрутний чадний газ, тому природний газ вважають екологічно чистим паливом. Велику кількість природного газу використовує хімічна промисловість.
Його переробка зводиться головним чином до одержання ненасичених вуглеводнів і синтезугазу. Етилен і ацетилен утворюються при відщепленні водню від нижчих алканів, а синтез-газ — суміш карбон(ІІ) оксиду і водню — одержують нагріванням метану з водяною парою:
CH4 +H2O t, kat→CO +3H2 .
Із цієї суміші, застосовуючи різні каталізатори, синтезують оксигеновмісні сполуки — метиловий спирт, оцтову кислоту тощо.
Просуваючись над кобальтовим каталізатором, синтез-газ перетворюється в суміш алканів, що являє собою синтетичний бензин:
nCO +(2n +1) H2 →CnH2n+2 +nH2O.
кам’яне вугілля
Ще одне джерело вуглеводнів — кам’яне вугілля. У хімічній промисловості його переробляють шляхом коксування — нагрівання до 1000 °С без доступу повітря. При цьому утворюються кокс і кам’яновугільна смола, маса якої становить усього кілька відсотків від маси вугілля. Кокс використовують як відновник в металургії (наприклад, для добування заліза з його оксидів).
Кам’яновугільна смола містить кілька сотень органічних сполук, в першу чергу — ароматичних вуглеводнів, які виділяють з неї перегонкою.
Кам’яне вугілля також використовують як паливо, однак при цьому виникають серйозні екологічні проблеми. По-перше, вугілля містить негорючі домішки, які при окисненні палива перетворюються в шлаки; по-друге, у складі вугілля є невеликі кількості сполук Сульфуру і Нітрогену, при згорянні вони утворюють оксиди, що забруднюють атмосферу.
179
