
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
добування сахарози із цукрового буряка
Промислове добування цукру істотно відрізняється від інших виробництв, які ви вже вивчали. Раніше розглядалися такі виробництва, коли цільовий продукт отримують із вихідних речовин шляхом їхніх хімічних перетворень. Сахарозу (цукор) не треба добувати хімічно, вона є в буряці, її лише необхідно виділити. Хімічні процеси тут спрямовані на те, щоб викристалізувати сахарозу в якомога більш чистому вигляді. Ці процеси полягають ось у чому.
Насамперед, потрібно найбільш повно добути цукор з буряка за допомогою води. Задля цього буряк у механічних бурякорізках перетворюють на тонку стружку й обробляють її водою в дифузорах, добуваючи цукор. З отриманого розчину ще не можна безпосередньо виділити цукор, тому що домішки, які надходять із буряка,— органічні кислоти, білки, барвники тощо,— сильно забруднюють цукор і заважають його кристалізації.
Отже, далі постає найбільш складне завдання — очистити розчин сахарози від домішок. Для цього його насамперед обробляють вапняним молоком. Під дією кальцій гідроксиду органічні кислоти та інші домішки осаджуються з розчину. Тим часом сахароза залишається в розчині, тому що дає з кальцій гідроксидом розчинний сахарат.
Із сахарату знову потрібно виділити сахарозу. Цього досягають шляхом обробки розчину карбон(IV) оксидом, який осаджує кальцій карбонат. Звільнений від осаду розчин цукру випарюють і піддають кристалізації. Так виходить цукровий пісок. Частина його після додаткового очищення йде на виробництво рафінаду.
Донедавна для добування цукру з буряка застосовували дифузори періодичної дії. Це ряд послідовно з’єднаних апаратів, в які завантажують подрібнений буряк. Через апарати пропускають воду, яка, проходячи через них, збагачується цукром. Після добування цукру водою дифузори завантажують новою порцією бурякової стружки. Зараз використовують дифузори безперервної дії, що істотно підвищує продуктивність праці.
крохмаль і целюлоза
Фізичні властивості крохмалю і целюлози
Крохмаль — це аморфний порошок з характерним хрускотом (картопляного крохмалю), нерозчинний у воді у звичайних умовах. При потраплянні в гарячу воду зерна крохмалю сильно
набухають, їхні оболонки розриваються, утворюється колоїдний розчин.
Целюлоза являє собою волокнисту речовину білого кольору, не розчинну у воді. На відміну від крохмалю, целюлоза зовсім не взаємодіє з водою навіть при кип’ятінні. Чиста целюлоза в нашому житті зустрічається у вигляді вати.
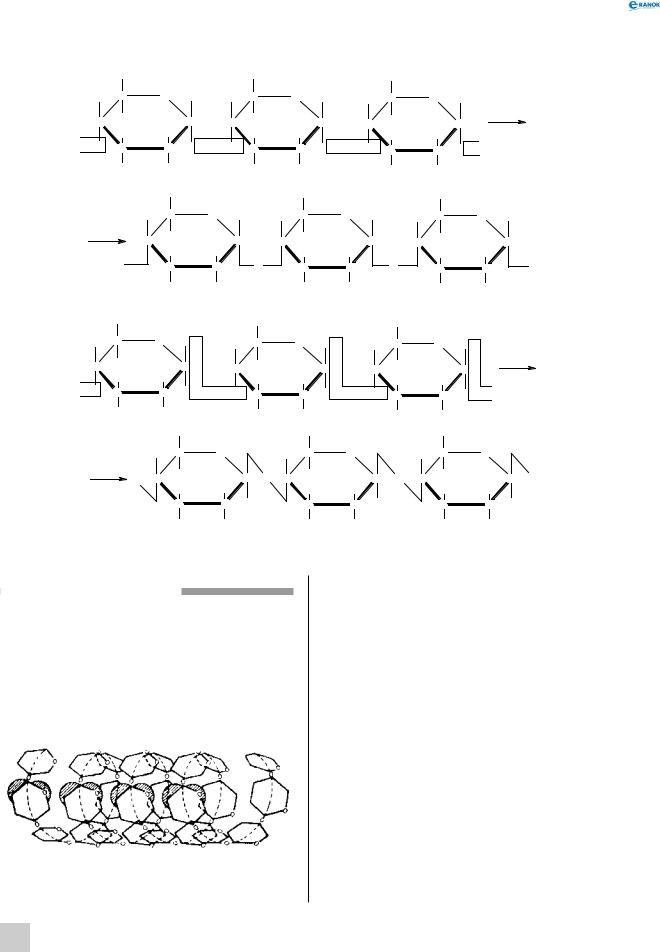
Будова молекул крохмалю й целюлози
Найпростіша формула крохмалю (і целюло-
зи) — (C6H10O5 )n . У цій формулі значення n — від кількох сотень до кількох тисяч. Отже, крох-
маль — це природний полімер, що складається з багаторазово повторюваних структурних ланок C6H10O5. Він складається з молекул двох типів. Із цієї причини крохмаль навіть вважають сумішшю двох речовин — амілози та амілопектину. Амілоза (її в крохмалі 20%) має лінійні молекули й більш розчинна. Молекули амілопектину (його 80 %) розгалужені,
івін менш розчинний у воді. Ці молекули відрізняються й за відносною молекулярною масою: для лінійних молекул (амілози) вона сягає близько сотень тисяч, для розгалужених молекул (амілопектину) — кількох мільйонів.
Найпростіша й молекулярна формули целюлози аналогічні до формул крохмалю. Очевидно, що при однаковому складі ці речовини істотно відрізняються за властивостями. Порівняно із крохмалем у целюлози більш висока відносна молекулярна маса. Причина міцності й нерозчинності целюлози полягає в тому, що вона має просторову тривимірну структуру. Однак целюлоза не має не тільки тривимірної, але й розгалуженої структури. Але в цьому й полягає причина міцності молекул целюлози, тому що вони мають лінійну структуру,
іокремі макромолекули розташовані упорядковано щільно одна до одної. Унаслідок цього значно зростає сила міжмолекулярної взаємодії між окремими макромолекулами. Між упорядковано розташованими макромолекулами целюлози встановлюються численні водневі зв’язки: атоми Оксигену гідроксильних груп однієї молекули електростатично взаємодіють із атомами Гідрогену гідроксильних груп іншої молекули. Із цієї ж причини целюлоза утворює міцні волокна, що не характерно для крохмалю. Тим часом у крохмалі більшість молекул має розгалужену будову, тому можливостей для встановлення водневих зв’язків менше.
Молекули крохмалю складаються із залишків
α-глюкози, а целюлози — із залишків молекул
β-глюкози. У цьому також полягає причина відмінностей хімічних властивостей крохмалю та целюлози:
199
Крохмаль
|
CH2OH |
|
|
|
CH2OH |
|
|
|
|
CH OH |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
H C |
O H |
H C |
|
O H |
|
H C |
|
O H |
|
||||||
C H |
H |
C |
+C H |
|
|
C |
+ |
C H |
|
|
C |
|
|||
HO |
OH |
|
|
OH |
|
H |
|
|
|
OH |
|
H |
–H2O |
||
C |
C |
OH |
OH |
|
|
|
OH |
|
OH |
|
|
|
|||
C |
|
C |
|
C |
|
C |
OH |
|
|||||||
|
H |
OH |
|
H |
|
OH |
|
|
|
H |
|
OH |
|
|
|
|
|
CH2OH |
|
|
|
CH OH |
|
|
|
|
CH OH |
|
|||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
H C |
|
O H |
H C |
|
O H |
|
H C |
O H |
||||||
|
C |
H |
|
C |
|
C |
H |
|
|
C |
|
C |
H |
|
C |
|
|
OH |
H |
|
|
OH |
|
H |
|
|
|
OH |
H |
|
|
|
|
C |
|
C |
O |
|
C |
|
C |
|
O |
|
C |
C |
O |
|
|
H |
|
OH |
|
|
H |
|
OH |
|
|
|
H |
OH |
|
Целюлоза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
|
|
|
CH OH |
|
|
|
|
CH OH |
|
|
|
||
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
H C |
O OH |
H C |
|
O OH |
|
H C |
|
O OH |
|
||||||
C |
H |
|
C |
+ C |
H |
|
|
C |
+ |
C |
H |
|
|
C |
|
OH |
H |
OH |
|
H |
OH |
|
H |
–H2O |
|||||||
HO |
C |
C H |
OH C |
|
C H |
|
OH C |
|
C H |
|
|||||
|
H |
OH |
|
|
H |
|
OH |
|
|
|
H |
|
OH |
|
|
|
|
|
CH2OH |
|
|
CH2OH |
|
|
|
|
CH2OH |
|
|||
|
|
H |
C |
O |
|
H |
C |
|
O |
|
|
H |
C |
O |
|
|
|
C H |
H |
C O C H |
|
H |
C O C H |
H |
C O |
||||||
|
|
|
OH |
|
|
OH |
|
|
|
OH |
|
||||
|
|
|
C |
C |
H |
|
C |
|
C |
H |
|
|
C |
C |
H |
|
|
|
H |
OH |
|
|
H |
|
OH |
|
|
H |
OH |
|
|
хімічні властивості крохмалю й целюлози
1. Комплексоутворення крохмалю з йодом.
Властивість крохмалю утворювати синє забарвлення з йодом використовують як якісну реакцію для виявлення крохмалю. З йодом реагує здебільшого амілоза, утворюючи забарвлену сполуку. Молекула амілози у вигляді спіралі оточує молекули йоду, при цьому навколо кожної молекули йоду виявляється шість глюкозних залишків. Нагрівання руйнує такий комплекс, і забарвлення зникає.
2. Гідроліз.
Для сахарози була характерною реакція гідролізу. Така сама властивість притаманна
й крохмалю. При тривалому кип’ятінні крохмалю в присутності кислоти (найчастіше сульфатної) молекули піддаються гідролізу. Причому кінцевим продуктом гідролізу є тільки α -глюкоза. Однак процес гідролізу відбувається ступінчасто з утворенням проміжних продуктів гідролізу. Ступінчастий процес гідролізу може бути виражений наступною схемою:
(C6H10O5 )n →(C6H10O5 )x |
→C12H22O11 →C6H12O6. |
||
крохмаль |
декстрини |
мальтоза |
глюкоза |
Аналогічну властивість має й целюлоза. Однак гідроліз целюлози проходить у більш жорстких умовах, і кінцевим продуктом гідролізу є β -глюкоза.
Проміжні продукти гідролізу целюлози не становлять особливого інтересу, тому їх можна не зазначати й рівняння реакції складати в сумарному вигляді:
(C6H10O5 )n +nH2O →nC6H12O6 . 3. Термічне розкладання.
При нагріванні деревини до високої температури без доступу повітря виділяється досить
200
велика кількість продуктів. Окрім вуглецю й води, утворюються рідкі продукти, зокрема й метиловий спирт (який саме тому й називають деревним спиртом), ацетон, оцтова кислота.
4. Естерифікація.
Оскільки залишки глюкози, що входять до складу целюлози, зберігають гідроксильні групи, то вона здатна вступати в реакцію естерифікації
зкислотами.
Укожній ланці целюлози містяться три гідроксильні групи. Усі вони можуть вступати в реакції утворення естерів. У звичайній формулі целюлози ці гідроксильні групи виділяють так:
C6H7O2 (OH)3 n .
Найбільше значення мають естери целюлози з нітратною кислотою (нітроцелюлоза) та оцтовою кислотою (ацетилцелюлоза).
C6H7O2 (OH)3 n + nHNO3 →
→ C6H7O2 (OH)2 NO2 n + nH2OC6H7O2 (OH)3 n + nCH3COOH →
→ C6H7O2 (OH)2 CH3COO n + nH2O.
застосування крохмалю
Крохмаль — це основний вуглевод нашої їжі; безпосередньо він, подібно до жирів, організмом не засвоюється. Гідроліз крохмалю під дією ферментів починається в роті при пережовуванні їжі, продовжується в шлунку та кишечнику. Утворена в результаті гідролізу глюкоза всмоктується в кров і надходить у печінку, а звідти — в усі тканини організму. Надлишок глюкози відкладається в печінці у вигляді високомолекулярного вуглеводу глікогену, який знову гідролізується до глюкози в міру витрачання її в клітинах організму.
Для добування глюкози крохмаль нагрівають із розведеною сульфатною кислотою впродовж кількох годин. Коли процес гідролізу закінчиться, кислоту нейтралізують крейдою, утворений осад кальційсульфатувідфільтровуютьірозчинупарюють. При охолодженні з розчину кристалізується глюкоза.
Якщо процес гідролізу не доводити до кінця, то в результаті утворюється густа солодка маса — суміш декстринів та глюкози — патока.
Декстрини, добуті з крохмалю, використовують як клей. Крохмаль застосовують для накрохмалювання білизни: під дією нагрівання гарячою праскою він перетворюється в декстрини, які склеюють волокна тканини й утворюють щільну плівку, що охороняє тканину від швидкого забруднення. Крім того, це полегшує наступне прання, оскільки часточки бруду, зв’язані з декстринами, значно легше змиваються водою.
Крохмаль використовують для виробництва етилового спирту. Під час цього процесу його спо-
чатку гідролізують під дією ферменту, який міститься в солоді, а потім продукт гідролізу зброджують у присутності дріжджів у спирт.
Етиловий спирт, який використовують для промислових потреб (синтез каучуку), добувають синтетичним шляхом з етилену та гідролізом целюлози.
застосування целюлози
Завдяки своїй механічній міцності целюлоза в складі деревини використовується в будівництві, з неї виготовляють усілякі столярні вироби. У вигляді волокнистих матеріалів (бавовни, льону, коноплі) її використовують для виготовлення ниток, тканин, канатів. Виділена з деревини (звільнена від супутніх речовин), целюлоза йде на виготовлення паперу.
Естери целюлози використовують для виготовлення нітролаків, кіноплівки, медичного колодію, штучного волокна та вибухових речовин.
Штучні волокна
З давніх часів люди широко використовують природні волокнисті матеріали для виготовлення одягу та різних виробів домашнього вжитку. Одні із цих матеріалів мають рослинне походження й складаються із целюлози, наприклад льон, бавовна; інші — тваринне походження й складаються з білків, наприклад вовна, шовк.
Волокна
Природні Хімічні
Рослинного |
Тваринного |
Штучні |
Синтетичні |
||||
походження |
походження |
|
|
|
|
||
|
|
|
|
||||
|
|
|
|
|
|
|
|
Бавовна, |
Вовна, |
Віскоза, |
Хларин, |
||||
льон тощо |
шовк |
мідно- |
нітрон, лав- |
||||
|
|
тощо |
аміачне, |
сан, кап- |
|||
|
|
|
|
ацетатне рон, енант, |
|||
|
|
|
|
волокна |
анід тощо |
||
У зв’язку із тим, що останнім часом потреби населення в тканинах і техніці посутньо зросли, волокнистих матеріалів не вистачає. Саме тому волокна стали добувати хімічним способом.
Існує два хімічні способи отримання волокон. Оскільки волокна характеризуються впорядкованим, орієнтованим вздовж осі волокна, розташуванням лінійних макромолекул, то можна взяти природний полімер неупорядкованої структури й шляхом тієї чи іншої обробки переробити в ньому розташування макромолекул, укласти їх в одному напрямку.
Можливий також інший спосіб — добути полімер синтетичним шляхом і потім здійснити в ньому потрібне укладання молекул.
201
