
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
класифікація органічних сполук
Органічні сполуки класифікують за складом. Таким чином виділяють вуглеводні (молекули яких складаються тільки з Карбону й Гідрогену), оксигеновмісні сполуки (містять один або кілька атомів Оксигену) та нітрогеновмісні сполуки (з них у шкільному курсі розглядають тільки природні сполуки — амінокислоти та нуклеотиди).
Вуглеводні класифікують за кількістю подвійних зв’язків — ненасиченості. Таким чином, якщо молекула вуглеводню не містить кратних (подвійних і потрійних) зв’язків, то її відносять до класу алканів, або насичених вуглеводнів. Якщо сполуки мають подвійний або потрійний зв’язок, то їх називають алкенами й алкінами, відповідно. Молекули можуть також мати два й більше кратних зв’язків, тоді в їхній назві з’являються суфікси — ді, три і так далі. Наприклад, сполуку, яка має два подвійні зв’язки, називають алкадієном.
Оксигеновмісні й нітрогеновмісні сполуки та їхня класифікація будуть розглянуті у відповідних розділах.
Органічні сполуки
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вуглеводні |
|
|
|
Оксигеновміс- |
|
|
|
|
Нітрогено- |
||||||
|
|
|
|
|
|
|
|
ні сполуки |
|
|
вмісні сполуки |
|||||
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алкани (або |
|
|
|
|
Спирти |
|
|
|
|
Амінокис- |
|||||
|
|
|
|
|
|
|
|
|
||||||||
|
парафіни) |
|
|
|
|
|
|
|
|
|
|
лоти |
||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алкени (або |
|
|
|
|
Альдегіди |
|
|
|
|
Нуклеотиди |
|||||
|
|
|
|
|
|
|
|
|
||||||||
|
олефіни) |
|
|
|
|
й кетони |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алкіни (або |
|
|
|
|
Карбонові |
|
|
|
|
|
|
|
|||
|
ацетилени) |
|
|
|
|
кислоти |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ароматичні |
|
|
|
|
Вуглеводи |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
(або арени) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
насиЧені вуглевОдні. алкани
гомологічний ряд алканів
Усі насичені вуглеводні можна вишикувати в ряд, в якому порядковий номер вуглеводню буде дорівнювати кількості атомів Карбону в молекулі. Такий гіпотетичний ряд називають гомологічним рядом, а сполуки, з яких складається цей ряд, називають гомологами.
Структурні формули й брутто-формули нижчих (з невеликим числом атомів Карбону) гомологів мають наступний вигляд:
HH H
H C H H C C H
HH H
CH4 C2H6
|
|
H |
|
H |
H |
|
|
|
H |
|
H |
|
H |
|
H |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
C |
|
C |
|
C |
|
H H |
|
C |
|
C |
|
C |
|
C |
|
H |
|||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
H |
H |
|
|
|
H |
|
H |
|
H |
|
H |
||||||||||
|
|
|
|
C3H8 |
|
|
|
|
|
|
|
|
C4H10 |
|
|
|
|
|
|||||||
Неважко помітити, що кількість атомів у наведених сполуках відрізняється на сталий фрагмент CH2 . І справді, усі формули, подані вище, можна зобразити за допомогою однієї:
HH
H C C H
H H n
CH4(CH2)n
CnH2n+2
Тут коефіцієнт n може набувати невід’ємних цілих значень: 0, 1, 2, 3 тощо.
Різницю у формулах найближчих гомологів (CH2 ) заведено називати гомологічною різницею.
Кожна сполука, зокрема й вуглеводні, мають власні назви. Назви сполук, що належать до гомологічного ряду алканів, є основою для складання назв інших органічних сполук. Перші чотири члени гомологічного ряду алканів мають традиційні назви, інші назви походять від назв грецьких числівників з додаванням суфікса — ан.
CH4 |
Метан |
C9H20 |
Нонан |
C2H6 |
Етан |
C10H22 |
Декан |
C3H8 |
Пропан |
C11H24 |
Ундекан |
C4H10 |
Бутан |
C12H26 |
Додекан |
C5H12 |
Пентан |
C13H28 |
Тридекан |
C6H14 |
Гексан |
C14H30 |
Тетрадекан |
C7H16 |
Гептан |
C20H42 |
Ейкозан |
C8H18 |
Октан |
|
|
ізомерія алканів
Вище було з’ясовано, що здатність атомів Карбону до утворення чотирьох ковалентних зв’язків,
164

зокрема й з іншими атомами Карбону, передбачає можливість існування кількох сполук одного елементного складу — ізомерів. Усі ізомери поділяють на два великих класи — структурні ізомери й просторові ізомери.
Структурними називають ізомери, що відповідають різним структурним формулам органічних сполук (з різним порядком з’єднання атомів).
Просторові ізомери мають однакові замісники в одного атома Карбону й відрізняються лише їхнім взаємним розташуванням у просторі.
Для алканів здебільшого характерні структурні ізомери. Перші три члени гомологічного ряду алканів мають тільки по одному ізомеру. Тим часом бутан має вже два ізомерні вуглеводні:
CH |
|
CH |
|
CH |
|
CH |
|
CH3 |
|
CH |
|
CH3 |
||||||||||||
|
|
|
|
|||||||||||||||||||||
|
|
|
||||||||||||||||||||||
3 |
|
2 |
|
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||||
Пентан має вже три ізомери: |
||||||||||||||||||||||||
|
|
CH3 |
CH3 |
CH2 |
CH2 |
CH2 |
CH3 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
CH3 |
|
CH |
|
CH2 |
CH3 |
||||||||||
CH3 |
C |
|
|
|
|
CH3 |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
CH3 |
|
|
|
|
|
|
|
|
|
CH3 |
|||||||||||||
номенклатура вуглеводнів
Сучасна номенклатура має бути систематичною й міжнародною, щоб фахівці всього світу могли відобразити в назві структуру сполуки й, навпаки, за назвою однозначно представити структуру. На сьогодні визнана систематична номенклатура ІЮПАК (IUPAC — Міжнародний союз теоретичної та прикладної хімії).
Систематична номенклатура. Серед варіан-
тів систематичних номенклатур, що їх рекомендує ІЮПАК, найпоширенішою є замінна номенклатура. Сама назва номенклатури говорить про те, що в сполуці виділяється певна основа, в якій зроблене заміщення атомів Гідрогену на інші атоми або групи. Водночас правила ІЮПАК дозволяють уживати назви органічних сполук, побудовані на основі застарілих тривіальної та раціональної номенклатур.
За правилами ІЮПАК, назву органічної сполуки вибудовують із назви головного ланцюга, який утворює корінь слова, та назви функцій, використовуваних як префікси або суфікси.
Для правильної побудови назви необхідно провести вибір головного ланцюга та нумерації атомів Карбону в ньому.
У замісній номенклатурі назва сполуки являє собою складене слово, корінь якого включає назву родоначальної структури. Назви за-
місників позначають префіксами (приставками) і суфіксами.
Замісник — це будь-який атом або група атомів, що заміщають атом Гідрогену в родоначальній структурі.
Функціональна група — це атом або група ато-
мів невуглеводневого характеру, які визначають приналежність сполуки до певного класу.
Характеристична група — це функціональ-
на група, пов’язана з родоначальною структурою. Для побудови назви в першу чергу визначають тип характеристичної групи (якщо вона присутня). Коли характеристичних груп у сполуці кілька, то виділяють старшу характеристичну групу. Потім визначають родоначальну структуру, до якої має обов’язково входити старша характеристична група.
При складанні назв насичених вуглеводнів слід дотримуватися правил, які ми подаємо нижче.
Нумерацію атомів Карбону в головному ланцюзі починають із того кінця ланцюга, до якого ближче розташована старша група. Якщо таких можливостей виявляється кілька, то нумерацію проводять таким чином, щоб або кратний зв’язок, або інший замісник, наявний у молекулі, одержали найменший номер.
Основу назви сполуки становить корінь слова, який позначає насичений вуглеводень із тим же числом атомів, що й головний ланцюг (напри-
клад, мет, ет, проп, бут, пент, гекс тощо).
Потім іде суфікс, який характеризує ступінь насиченості, ан, якщо в молекулі немає кратних зв’язків, ен (єн) — при наявності подвійних зв’язків та ин (ін) — для потрійних зв’язків, наприклад пентан, пентен, пентин. Якщо кратних зв’язків у молекулі кілька, то в суфіксі вказують число таких зв’язків, наприклад: -дієн, -триєн, а після суфікса обов’язково арабськими цифрами вказують положення кратного зв’язку.
Далі в суфікс виносять назву найстаршої характеристичної групи в молекулі із зазначенням її положення цифрою. Інші замісники позначають за допомогою префіксів. При цьому їх наводять не за порядком старшинства, а за абеткою. Положення замісника позначають цифрою перед префіксом, наприклад: 3-метил; 2-хлор тощо. Якщо в молекулі є кілька однакових замісників, то перед назвою відповідної групи словом указують їхню кількість (наприклад, диметил, трихлор тощо). Усі цифри в назвах молекул відокремлюють від слів дефісом, а один від одного комами. Вуглеводневі радикали мають свої назви. Назва вуглеводневого радикала походить від назви відповідного йому алкану заміною суфікса — ан на -ил. Наприклад, СН4 — метан, а радикал СН3 — називається метил, С2Н5 — етил тощо.
165
CH3 |
|
CH |
|
|
|
CH |
|
|
CH3 |
|
|
CH3 |
|
|
CH |
|
|
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Cl |
|
Cl |
|
|
|
|
|
|
CH3 |
|
|
|||||||||||||
2,3дихлорбутан |
|
|
2метилпропан |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
або ізобутан |
||||||||||
|
|
|
|
|
CH3 |
CH2 |
CH2 |
|
CH |
|
CH3 |
|
|
||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
||||||||||
|
|
|
|
|
|
|
2хлорпентан |
|
|
||||||||||||||||
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
CH3 |
C |
|
|
CH2 |
CH3 |
|
|
CH3 |
C |
|
|
|
CH3 |
||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|||||||||
2метил2хлорбутан |
|
2,2диметилпропан |
|||||||||||||||||||||||
У назвах нерозгалужених алканів без замінників для підкреслення їхньої нерозгалуженої будови додають слово «нормальний» або скорочено букву «н»:
CH3 −CH2 −CH2 −CH2 −CH3
нормальний пентан
CH3 −CH2 −CH2 −CH3
нбутан
Будова алканів
КоженатомКарбонувалканахперебуваєвстані sp3-гібридизації й утворює чотири σ -зв’язки C −C або C −H , кути між якими дорівнюють 109,5°. Завдяки такій орієнтації зв’язки від одного атома Карбону в алканах спрямовані до вершин тетраедра. Довжина зв’язку C −C в алканах дорівнює 0,154 нм, енергія зв’язку — 354 кДж/моль.
H
C
H
HH
Атом Карбону утворює σ -зв’язок за рахунок перекривання гібридних орбіталей (sp3-, sp2- або sp-атомних орбіталей) з гібридними орбіталями іншого атома Карбону або будь-якими орбіталями атомів інших елементів. Перекривання здійснюється таким чином, що область максимальної електронної густини зосереджується в просторі між ядрами на прямій, що з’єднує центри атомів. Таке перекривання виявляється найбільш ефективним, а σ -зв’язки, які при цьому виникають, — найбільш міцними.
Фізичні властивості алканів
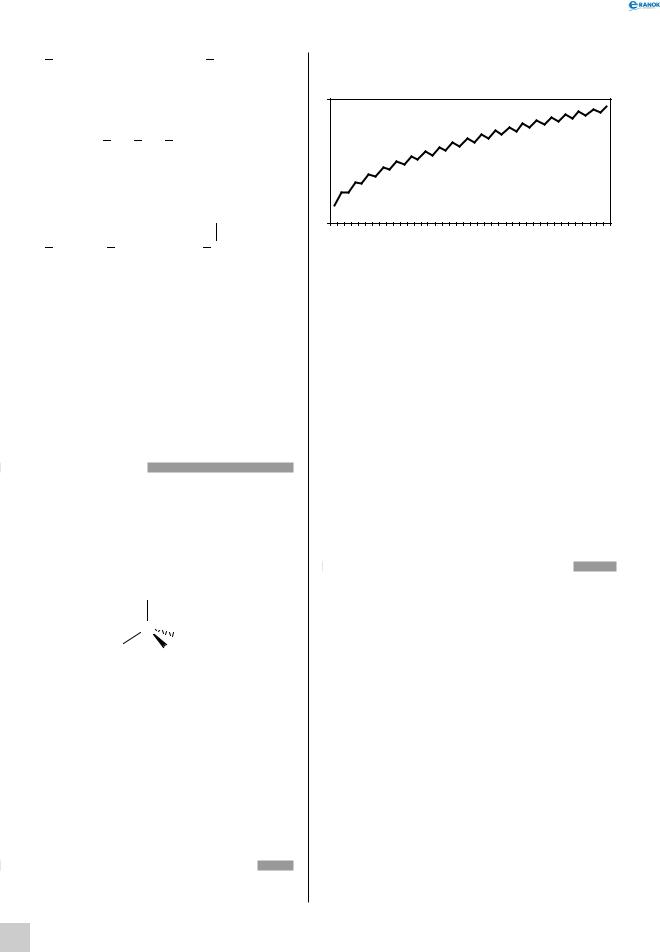
Багато фізичних властивостей (температура плавлення й кипіння) гомологів змінюються не
лінійно, а «пилкоподібною» залежністю від кіль- |
|||||||
кості атомів Карбону, яку ми подаємо у вигляді |
|||||||
графіка: |
|
|
|
|
|
||
1 |
3 |
5 |
7 |
9 |
11 13 15 17 19 |
21 23 25 27 29 |
31 33 35 37 39 |
При нормальних умовах (0 °С, 1 атм) перші чотири гомологи являють собою гази; сполуки, що містять від 5 до 15 атомів Карбону — рідини; вищі вуглеводні — тверді речовини. При однаковому числі атомів Карбону молекули алканів з розгалуженою будовою мають більш низькі температури кипіння, ніж нормальні алкани.
Усі алкани являють собою безбарвні або білі речовини. Леткі вуглеводні мають характерний «бензиновий» запах. Вищі вуглеводні являють собою жирні на дотик м’які речовини, їхній типовий представник — парафін, з якого виготовляють свічі.
Алкани практично не розчинні у воді, тому що їхні молекули малополярні й не взаємодіють із молекулами води, вони добре розчиняються в неполярних органічних розчинниках, таких як тетрахлорметан тощо. Рідкі алкани легко змішуються один з одним.
хімічні властивості алканів
Зазвичайнихумовалканихімічноінертні.Вони стійкі до дії багатьох реагентів: не взаємодіють із концентрованими сульфатною та нітратною кислотами, з концентрованими й розплавленими лугами, не окиснюються сильними окисниками — калій перманганатом KMnO4 тощо.
Хімічна стійкість алканів пояснюється високою міцністю зв’язків C −C та C −H, а також їхньою неполярністю. Неполярні зв’язки C −C в алканах не схильні до йонного розриву, але здатні до розщеплення гомолітично під дією активних вільних радикалів. Для алканів характерні радикальні реакції, унаслідок яких виходять сполуки, де атоми Гідрогену заміщені на інші атоми або групи атомів. Отже, алкани вступають у реакції, які протікають за механізмом радикального заміщення. За таким механізмом найлегше заміщаються атоми Гідрогену в третинних, потім у вторинних
іпервинних атомів Карбону.
1.Галогенування. При взаємодії алканів з галогенами (хлором і бромом) під дією ультрафіолетового випромінювання або високої температури
166
