
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
ці особливості можуть бути зумовлені високою хімічною чистотою (через зазначений малий коефіцієнт захоплення домішок у процесі кристалізації льоду), відмінностями у вмісті розчинених газів і йонів, а також запам’ятовуванням структури льоду в багатомолекулярних кластерах рідкої фази. Проте достовірної інформації про це, отриманої сучасними фізичними методами, немає.
Не менш складним видається аналіз механізмів впливу зовнішніх фізичних полів, зокрема магнітного, на процеси та властивості води, льоду і фазових переходів. Усе наше життя проходить в умовах постійної дії магнітного поля Землі і його слабких флуктуацій. Протягом багатьох століть розвиваються магнітобіологія і магнітні методи лікування в медицині. Нарешті, серійно виробляються і широко застосовуються установки для намагнічування води, яку використовують для поливу в сільському господарстві (в цілях підвищення врожайності), живлення парових котлів (для зменшення швидкості утворення накипу в них) тощо. Проте хоч якогось задовільного фізичного опису механізмів дії магнітного поля в цих та інших подібних випадках досі немає.
хімічні властивості води
Вода — дуже активна в хімічному відношенні речовина.
1) Вода реагує з багатьма металами з виділенням водню:
2Na + 2H2O = H2 + 2NaOH (бурхливо),
2K + 2H2O = H2 + 2KOH (бурхливо),
3Fe + 4H2O = 4H2 + Fe3O4. (тільки під час нагрівання)
Не всі, а тільки достатньо активні метали можуть брати участь в окисно-відновних реакціях цього типу. Найлегше реагують лужні та лужноземельні метали I і II груп.
З неметалів з водою реагують, наприклад, вуглець і його воднева сполука (метан). Ці речовини набагато менш активні, ніж метали, але всетаки здатні реагувати з водою за високої температури:
C + H2O = H2 + CO
(під час сильного нагрівання)
CH4 + 2H2O = 4H2 + CO2
(під час сильного нагрівання)
2)Вода розкладається на водень і кисень у результаті дії електричного струму. Це також окис- но-відновна реакція, де вода є одночасно і окисником, і відновником:
2H2O ел. струм →2H2 +O2
3)Вода реагує з багатьма оксидами неметалів. На відміну від попередніх, ці реакції не окисно-відновні, а реакції сполучення:
SO2+ H2O → H2SO3 SO3+ H2O → H2SO4 СO2+ H2O → H2СO3
4) Деякі оксиди металів також можуть вступати в реакції сполучення з водою:
CaО + Н2О → Ca (ОН) 2.
Не всі оксиди металів здатні реагувати з водою. Частина з них практично не розчинна у воді і тому з водою не реагує. Це ZnO, TiO2, Cr2O3, з яких готують, наприклад, стійкі до води фарби. Оксиди Феруму також не розчинні у воді і не реагують з нею.
5)Вода утворює численні сполуки, у яких
їїмолекула повністю зберігається. Це так звані гідрати. Якщо гідрат кристалічний, то він називається кристалогідратом. Наприклад:
CuSO4 + 5H2O → CuSO4 · 5H2O
Не тільки солі здатні утворювати гідрати:
H2SO4 + H2O = H2SO4 · H2O (гідрат сульфатної кислоти)
NaOH + H2O = NaOH · H2O (гідрат їдкого натру)
Сполуки, що зв’язують воду в гідрати та кристалогідрати, використовують як осушувачі. За їх допомогою, наприклад, видаляють водяні пари з вологого атмосферного повітря.
6) Особлива реакція води — синтез рослинами крохмалю (C6H10O5 )n та інших подібних сполук (вуглеводів), що відбувається з виділенням кисню:
6nCO2 +5nH2O →(C6H10O5 )n +6nO2 .
галОгени
місце елементів неметалів у періодичній системі
Усі елементи в Періодичній системі Д. І. Менделєєва умовно можна розділити на два типи: металічні і неметалічні. До неметалічних відносять елементи, які схильні приймати електрони, а до металічних — елементи, які схильні їх віддавати. Як відомо, здатність приймати електрони в періоді зростає в міру наближення до інертного газу, а в групі — у міру зменшення радіуса атома, тобто знизу вгору. Таким чином, у періоді зі збільшенням порядкового номера металічні властивості слабшають, а неметалічні — підсилюються, а в групах зі збільшенням порядкового номера металічні властивості підсилюються, а неметалічні — слабшають. Саме тому неметали розташовані переважно у правому верхньому кутку Періодичної системи.
Усі d і f елементи є металами. Серед sелементів неметалічні властивості мають тільки водень та гелій. Усі інші неметали є pелементами.
108

характеристика хімічних елементів
властивості хімічних елементів
властивість |
Флуор |
хлор |
Бром |
йод |
|
|
|
|
|
|
|
Хімічний символ |
F |
Cl |
Br |
I |
|
|
|
|
|
|
|
Порядковий номер |
9 |
17 |
35 |
85 |
|
|
|
|
|
|
|
Атомна маса |
18,99840 |
35,453 |
79,904 |
126,9045 |
|
|
|
|
|
|
|
Місце в ПС |
2 період; |
3 період; |
4 період; |
5 період; |
|
VII група |
VII група |
VII група |
VII група |
||
|
|||||
|
|
|
|
|
|
Число електронів на енер- |
2; 7 |
2; 8; 7 |
2; 8; 18; 7 |
2; 8; 18; 18; 7 |
|
гетичних рівнях |
|||||
|
|
|
|
||
|
|
|
|
|
|
Радіус атома, нм |
0,064 |
0,099 |
0,114 |
0,133 |
|
|
|
|
|
|
|
Потенціал йонізації, еВ |
17,42 |
12,97 |
11,81 |
10,45 |
|
|
|
|
|
|
|
Спорідненість з електро- |
3,5 |
3,6 |
3,5 |
3,3 |
|
ном, еВ |
|||||
|
|
|
|
||
|
|
|
|
|
|
Відносна електронегатив- |
3,96 |
3,19 |
2,74 |
2,21 |
|
ність |
|||||
|
|
|
|
||
|
|
|
|
|
|
Електронна конфігурація |
2s22p5 |
3s23p5 |
4s24p5 |
5s25p5 |
|
валентного рівня |
|
|
|
|
|
Можливі валентності |
I |
I, III, V, VII |
I, III, V, VII |
I, III, V, VII |
|
|
|
|
|
|
|
Можливі ступені окиснен- |
–1, 0 |
–1, 0, +1, +3, |
–1, 0, +1, +3, |
–1, 0, +1, +3, |
|
ня |
+4, +5, +7 |
+5, +7 |
+5, +7 |
||
|
|||||
|
|
|
|
|
|
Ізотопний склад |
19F — 100% |
37Cl — 75,53% |
81Br — 50,64% |
127I — 100% |
|
|
|
35 |
79 |
|
|
|
|
Cl — 24,47% |
Br — 49,36% |
|
|
|
|
|
|
|
|
Вміст у земній корі, |
2,8 10−2 |
2,6 10−2 |
8,5 10−2 |
4 10−6 4·10—6 |
|
мол.% |
|||||
|
|
|
|
||
|
|
|
|
|
Зазначені вище елементи VII групи головної підгрупи називають іще галогенами (до цієї групи входить також астат At). Таку назву ця група елементів одержала внаслідок того, що більшість природних солей містять у своєму складі один із цих атомів, а їхня назва, галогени, у перекладі з грец. означає «ті, що народжують сіль» (від га лос — сіль і генос — походження).
Здатність проявляти ту чи іншу валентність визначається числом електронних орбіталей, спроможних утворювати хімічний зв’язок. Таким чином, атом Флуору проявляє тільки одну валентність, тимчасом як решта елементів проявляють змінну валентність.
Електронна будова атомів Флуору й Хлору зображена на поданій далі схемі. В атомів Брому та йоду валентні рівні подібні до конфігурації атома Хлору.
sp
F 2
s
1 


s |
p |
d |
Cl 3 |
|
s |
p |
2 |
|
s
1 
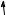


Для утворення хімічного зв’язку Флуор має лише один неспарений електрон, тому Флуор проявляє тільки одну валентність, яка дорівнює одиниці.
109
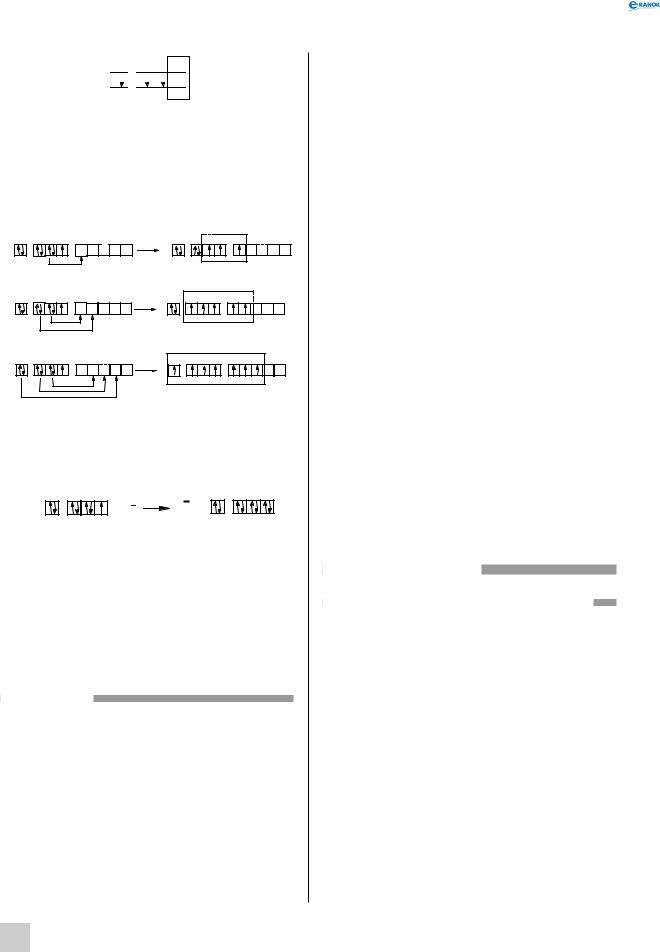
sp
2 
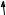



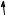


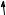




F
У третьому періоді й вище, де розташовані атоми Хлору, Брому та Йоду, можливий електронний перехід з p-підрівня на d-підрівень, за рахунок цього проявляється більше число валентностей. Наочно такий процес зображений на схемах, які показують утворення різних валентних станів атома Хлору.
Тривалентний стан атома Хлору:
s |
p |
d |
s |
p |
d |
3 |
|
|
3 |
|
|
П’ятивалентний стан атома Хлору:
s |
p |
d |
s |
p |
d |
3 |
|
|
3 |
|
|
Семивалентний стан атома Хлору:
s |
p |
d |
s |
p |
d |
3 |
|
|
3 |
|
|
Серед усіх елементів Періодичної системи атом Флуору має найвищу електронегативність, тому при утворенні зв’язку в будь-яких сполуках атом Флуору здатний тільки приймати електрон і проявляти ступінь окиснення, який дорівнює –1:
s |
p |
|
s |
p |
F0 2 |
|
+1e |
F 2 |
|
За аналогічним механізмом проявляють ступінь окиснення –1 атоми Хлору, Брому та Йоду. Однак за рахунок великих розмірів атомів та меншої електронегативності, ніж в атома Флуору, інші галогени можуть проявляти відновні властивості. Атоми Хлору, Брому та Йоду здатні віддавати 1, 3, 5 або 7 електронів атомам-окисникам.
Атоми Флуору не можуть віддавати електрони, тому що вони мають найвищу електронегативність серед усіх існуючих атомів.
поширеність елементів галогенів на землі
Флуор є досить поширеним елементом на Зем-
лі. Масова частка Флуору дорівнює 6,6 10−2 %. На Флуор багаті такі рослини, як цибуля та сочевиця. В організмах тварин Флуор міститься головним чином у кістках, зубах та черепашках. Флуор — необхідний елемент для життя людини. Вміст Флуору в зубах людини підтримується на певному рівні, який дорівнює 0,02%. У природі Флуор міститься в різних мінералах, таких як флюорит (плавиковий шпат) CaF2, фторапатит
Ca5 (PO4 )3 F , кріоліт Na3AlF6.
У земній корі міститься 0,05% Хлору за масою. Хлор входить до складу великої кількості
мінералів, однак найбільше хлору в морській воді, де він входить до складу таких розчинених солей, як NaCl, MgCl2 та деяких інших. Однією з найпоширеніших сполук хлору є мінерал галіт, або, як його ще називають, кам’яна сіль NaCl. Величезні підземні поклади натрій хлориду є поблизу міста Артемовська (Донецька область), а також у деяких інших районах. Елемент хлор утворює проста речовина хлор, яка зустрічається в деяких вулканічних газах. Цей елемент входить також до складу таких мінералів, як сильвін KCl,
сильвініт NaCl KCl, карналіт KCl MgCl2 6H2O,
каїніт KCl MgSO4 3H2O, рогове срібло AgCl. Бром, порівняно з іншими галогенами, ще
менш поширений на Землі. Вміст Брому в земній корі дорівнює приблизно 1,6 10−4 %, однак атоми Брому входять до складу одного-єдиного дуже рідкісного мінералу бромаргіриту AgBr. Він не утворює поширених мінералів і досить рівномірно розподілений по всій планеті у вигляді незначної домішки до багатьох мінералів. З огляду на це, отримати цей елемент та застосувати його в промисловості досить важко. Деякі рослини, такі як квасоля, горох та сочевиця, здатні накопичувати бром. Багато брому міститься в золі морських водоростей та в морській воді.
Йод — доволі рідкісний та розсіяний елемент на Землі. Його вміст у земній корі за масою становить приблизно 4 10−5 %. Так само, як і Бром, атоми Йоду не утворюють власних мінералів, а містяться тільки у вигляді домішок в інших мінералах. Найбільше йоду міститься у водах деяких солоних озер та Світового океану.
прості речовини
хімічні властивості простих речовин
Прості речовини галогенів являють собою двохатомні молекули. У молекулі атоми з’єднані одинарним ковалентним неполярним зв’язком.
хімічні властивості Фтору
Фтор — найсильніший окисник у природі. Безпосередньо він не реагує тільки з гелієм, неоном та аргоном.
Під час реакції з металами утворюються фториди, сполуки йонного типу:
Mg +F2 → MgF2 , 2Au +3F2 →2AuF3,
2Na +F2 →2NaF.
Фтор енергійно реагує з багатьма неметалами, навіть із деякими інертними газами:
2P +5F2 →2PF5, S +3F2 → SF6, O2 +2F2 →2OF2, H2 +F2 →2HF, Xe +3F2 → XeF6.
110

Фізичні властивості простих речовин
властивості |
Фтор |
хлор |
Бром |
йод |
|
|
|
|
|
|
|
Формула сполуки |
F2 |
Cl2 |
Br2 |
I2 |
|
Зовнішній ви- |
|
|
|
|
|
гляд у звичайних |
Газ |
Газ |
Рідина |
Тверда речовина |
|
умовах |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Твердий йод — сіра |
|
|
Яскраво-жовтий |
|
Колір брому між |
кристалічна речо- |
|
Колір |
з жовтогарячим |
Жовто-зелений |
темно-червоним |
вина з металічним |
|
|
відтінком |
|
та бурим |
блиском, а його |
|
|
|
|
|
пари — фіолетові |
|
|
|
|
|
|
|
|
|
Характерний за- |
|
|
|
Запах та смак |
Різкий задушливий |
душливий запах |
Дуже неприємний |
Характерний запах |
|
запах |
(надає запаху хлор- |
запах |
«настоянки йоду» |
||
|
|||||
|
|
ному вапну) |
|
|
|
|
|
|
|
|
|
Температура |
–220 °С |
–102 °С |
–7 °С |
+114 °С |
|
плавлення |
(сублімується) |
||||
|
|
|
|||
|
|
|
|
|
|
Температура ки- |
–188 °С |
–34 °С |
+59 °С |
+185 °С |
|
піння |
|||||
|
|
|
|
||
|
|
|
|
|
|
Густина при н. у. |
1,7 г/л |
3,214 г/л |
3,18 г/см3 |
4,94 г/см3 |
|
Розчинність |
В атмосфері фтору |
2,3 об’єму хлору |
36 г в 1 літрі води |
0,3 г в 1 літрі води |
|
у воді |
вода займається |
розчиняється |
|||
в 1 об’ємі води |
|
|
|||
|
|
|
|
||
|
|
|
|
|
Фтор реагує навіть із багатьма хімічно стійкими сполуками, наприклад зі склом (у вигляді скловати):
SiO2 +2F2 → SiF4 +O2 .
Дуже багато органічних сполук в атмосфері фтору займаються, тобто починають горіти. Наприклад, деревина згорає, не залишаючи після себе навіть вугілля:
C6H12O6 +18F2 →6CF4 +12HF +3O2 .
Вода теж горить у фторі:
2H2O +2F2 →4HF +O2.
хімічні властивості хлору. взаємодія з ме талами та неметалами
У більшості сполук, утворених атомом Хлору, він проявляє ступінь окиснення –1. Позитивний ступінь окиснення проявляється тільки в сполуках з такими атомами, як Флуор та Оксиген.
Проста речовина хлор взаємодіє з усіма металами. Під час цієї взаємодії метали окиснюються до вищих ступенів. При цьому утворюються хлориди, сполуки Хлору з елементами, в яких атом Хлору проявляє ступінь окиснення –1:
2Fe +3Cl2 →2FeCl3 , Sn +2Cl2 → SnCl4 , 2Al +3Cl2 →2AlCl3 , 2K +Cl2 →2KCl.
Хлор також активно реагує з усіма неметалами, за винятком азоту, кисню та інертних газів. У цьому разі так само утворюються хлориди:
S +2Cl2 → SCl4 , 2P +5Cl2 →2PCl5 ,
C +2Cl2 → CCl4 ,
H2 +Cl2 →2HCl.
хімічні властивості хлору. взаємодія зі складними речовинами
Хлор є більш сильним окисником, аніж бром чи йод, тому хлор витісняє важкі галогени з їхніх солей:
2NaBr +Cl2 →2NaCl +Br2,
2KI +Cl2 →2KCl +I2.
Розчиняючись у воді, хлор частково реагує з нею, унаслідок чого утворюються дві кислоти: хлоридна й гіпохлоритна. При цьому один атом Хлору підвищує ступінь окиснення, а інший атом — знижує. Такі реакції називають реакціями диспропорціонування. Реакції диспропорціонування — це реакції самовідновлення-самоокис- нення, тобто реакції, під час яких один елемент проявляє властивості і окисника, і відновника. При диспропорціонуванні одночасно утворюються сполуки, в яких елемент перебуває в більш окисненому й більш відновленому стані порівняно з первісним. Ступінь окиснення атома Хлору в молекулі гіпохлоритної кислоти дорівнює +1:
H2O +Cl2 → HCl +HClO.
111
Аналогічно протікає взаємодія хлору з розчинами лугів. При цьому утворюються дві солі: хлорид і гіпохлорит.
2NaOH +Cl2 → NaCl +NaOCl +Н2О.
Хлор вступає у взаємодію з різними оксидами: SO2 +Cl2 → SO2Cl2 ,
TiO2 +2Cl2 +C → TiCl4 +CO2.
Хлор окиснює деякі солі, в яких метал перебуває не в максимальному ступені окиснення:
2FeCl2 +Cl2 →2FeCl3 .
Молекулярний хлор реагує з багатьма органічними сполуками. У присутності ферум(ІІІ) хлориду як каталізатора хлор реагує з бензолом з утворенням хлорбензолу, а при опроміненні світлом у результаті цієї ж таки реакції утворюється гексахлорциклогексан:
C6H6 +Cl2 → C6H5Cl +HCl,
C6H6 +3Cl2 hv→C6H6Cl6 .
хімічні властивості брому та йоду
Обидві речовини реагують із воднем, фтором та лугами:
H2 +Br2 →2HBr,
H2 +I2 →2HI,
5F2 +I2 →2IF5 ,
3F2 +Br2 →2BrF3,
2NaOH +Br2 → NaBr +NaBrO+ Н2О,
2NaOH +I2 → NaI +NaIO+ Н2О.
Йод окиснюють різні сильні окисники: 3I2 +10HNO3 =6HIO3 +10NO2 ↑ +2H2O.
методи добування простих речовин
добування фтору
Оскільки фтор є найсильнішим хімічним окисником, то виділити його за допомогою хімічних реакцій зі сполук у вільному вигляді неможливо, а тому фтор добувають фізико-хімічним методом — електролізом.
Для добування фтору використовують розплав калій фториду та нікелеві електроди. Нікель використовують завдяки тому, що поверхня металу пасивується фтором унаслідок утворення нерозчинного NiF2, отже, самі електроди не руйнуються під дією речовини, яка на них виділяється:
2KF електроліз→F2 ↑ +2K .
добування хлору
Хлор у промислових масштабах добувають електролізом розчину натрій хлориду. У результаті цього процесу добувають також натрій гідроксид:
2NaCl+2H2O електроліз→Cl2 ↑ +2NaOH + H2 ↑.
У невеликих кількостях хлор добувають окисненням розчину хлороводню різними методами:
MnO2 +4HCl →2Cl2 ↑ +MnCl2 +2H2O, 2KMnO4 +16HCl →5Cl2 ↑ +2MnCl2 +2KCl +8H2O,
2Na2Cr2O7 +28HCl →
→6Cl2 ↑ +4NaCl +4CrCl3 +14H2O.
Хлор — дуже важливий продукт хімічної промисловості.
Його світове виробництво складає мільйони тонн.
добування брому та йоду
Для промислового використання бром і йод добувають при окисненні бромідів та йодидів, відповідно. Для окиснення найчастіше використовують молекулярний хлор, концентровану сульфатну кислоту або манган діоксид:
2KBr +Cl2 →Br2 +2KCl, 2NaI +Cl2 →I2 ↓ +2NaCl,
2NaBr +2H2SO4 →Br2 +SO2 ↑ +2H2O +Na2SO4,
6Kl +4H2SO4 →3I2 ↓ + S ↓ + 4H2O +3K2SO4, 2KBr +MnO2 +2H2SO4 →
→ Br2 +MnSO4 +K2SO4 +2H2O.
застосування галогенів
Фтор та деякі його сполуки використовують як окисник ракетного палива. Великі кількості фтору використовують для добування різних холодоагентів (фреонів) та деяких полімерів, яким властива хімічна й термічна стійкість (тефлон та деякі інші). Фтор застосовують в ядерній техніці для поділу ізотопів урану.
Велику частину хлору використовують для добування хлоридної кислоти, а також як окисник для добування інших галогенів. У промисловості його використовують для вибілювання тканин та паперу. У більших кількостях, аніж фтор, його застосовують для виробництва полімерів (ПВХ та інших) і холодоагентів. За допомогою хлору дезінфікують питну воду. Він також потрібен для добування деяких розчинників, таких як хлороформ, хлористий метилен, тетрахлорметан. А ще його використовують для виробництва багатьох речовин, наприклад калій хлорату (бертолетової солі), хлорного вапна та багатьох інших сполук, що містять атоми Хлору.
Бром та йод застосовують у промисловості не в таких масштабах, як хлор чи фтор, однак з кожним роком використання цих речовин збільшується.Бромвикористовуютьувиробництві різних медичних препаратів заспокійливої дії. Йод використовують при виготовленні антисептичних препаратів. Сполуки Брому та Йоду широко застосовують при кількісному аналізі речовин. За допомогою йоду очищають деякі метали (цей процес називають йодним рафінуванням), наприклад титан, ванадій та інші.
112
