
- •Федеральное агентство по образованию
- •Е.А.Коломийцева концепции современного естествознания Краткий курс лекций
- •Содержание
- •Вступление
- •Лекция 1. Предмет и методы естествознания
- •1. Предмет естествознания. Естественнонаучная и гуманитарная культуры.
- •2. Наука и научный метод.
- •3. Исторические аспекты развития естествознания.
- •4. Основные разделы современного естествознания.
- •5. Структурные уровни организации материи.
- •Лекция 2. Практические методы физических исследований. Физические величины и измерения.
- •Измерения и измерительные приборы.
- •Для измерения времени также нужен эталон. В настоящее время считается, что 1 секунда – это время, за которое происходит 9192631830 периодов колебаний излучения, испускаемого изотопом цезия .
- •Физические размерности. Международная система си.
- •4. Погрешности измерений.
- •Перечислим основные факторы неточности эксперимента. Помимо грубых промахов самого экспериментатора, их можно разделить на две группы:
- •1) Систематические, которые определяются классом точности прибора (1/2 цены деления) и, возможно, какой-то постоянной ошибкой прибора;
- •Эксперимент.
- •Использование результатов эксперимента. Теория. Критерии научности и истинности теории.
- •Классическая механика и границы ее применимости. Материальная точка. Система отсчета.
- •Траектория, путь и перемещение. Радиус-вектор. Кинематические уравнения.
- •Средняя и мгновенная скорости. Ускорение.
- •Движение материальной точки по окружности. Угол поворота, угловая скорость и угловое ускорение.
- •Связь между линейными и угловыми кинематическими характеристиками движения.
- •Лекция 4. Силы в природе. Фундаментальные взаимодействия.
- •Понятие силы.
- •Динамика макромира. Законы классической механики.
- •Силы в природе.
- •Фундаментальные взаимодействия.
- •Лекция 5. Меры движения – импульс и энергия. Законы сохранения и симметрия пространства - времени.
- •Импульс.
- •Работа в механике. Консервативные и неконсервативные силы.
- •Виды энергии.
- •Момент импульса.
- •Законы сохранения и симметрия пространства-времени.
- •Концепции близкодействия и дальнодействия.
- •Лекция 7. Мегамир. Элементы частной теории относительности. Релятивистская концепция.
- •Движение с большими скоростями.
- •Постулаты Эйнштейна и принцип относительности Эйнштейна.
- •Преобразования Лоренца и следствия из них.
- •Правило сложения скоростей.
- •Масса. Взаимосвязь массы и энергии.
- •Представление об общей теории относительности.
- •Интервал и принцип причинности.
- •Лекция 8. Проблемы пространства и времени.
- •Что мы понимаем под пространством?
- •Основные свойства пространства.
- •Проблемы в представлениях о пространстве.
- •Способы измерения времени.
- •Основные свойства времени.
- •Проблемы в представлениях о времени.
- •Лекция 9. Волновые процессы.
- •Колебания.
- •Скорость и ускорение при колебаниях. Фазовое пространство.
- •Свободные гармонические затухающие колебания и вынужденные колебания.
- •Волновые процессы.
- •Свойства волн.
- •Электромагнитные волны в природе и технике.
- •Автоволны.
- •Лекция 10. Законы микромира. Корпускулярно-волновой дуализм материи. Принцип дополнительности и проблемы причинности.
- •Гипотеза квантов энергии м.Планка.
- •Гипотеза де Бройля. Волновые свойства частиц.
- •Динамика микрочастиц. Принцип неопределенностей Гейзенберга
- •- Принцип неопределенностей Гейзенберга.
- •Представление о квантовой механике.
- •Проблемы причинности.
- •Лекция 11. Элементарные частицы. Кварки.
- •Классификация элементарных частиц.
- •Взаимные превращения элементарных частиц.
- •Гипотеза кварков.
- •Элементарные частицы и фундаментальные взаимодействия.
- •Лекция 12. Радиоактивность
- •Радиоактивные распады.
- •Виды радиоактивных распадов.
- •Законы радиоактивных распадов.
- •Воздействие излучения на человека.
- •Дозиметрия.
- •Лекция 13. Динамические и статистические закономерности.
- •Термодинамический и статистический методы изучения многочастичных систем.
- •Термодинамическое равновесие и квазистатические процессы.
- •Понятие температуры.
- •Теплота, внутренняя энергия и работа.
- •Лекция 14. Энергия в термодинамических процессах.
- •Первое начало термодинамики как закон сохранения энергии.
- •Тепловые машины. Цикл Карно.
- •Деградация энергии. Тепловое загрязнение окружающей среды.
- •Традиционные и нетрадиционные источники энергии.
- •Лекция 15. Порядок и беспорядок в природе. Фазовые переходы. Энтропия. Второе начало термодинамики и «стрела времени».
- •Энтропия.
- •Статистическое толкование энтропии.
- •Второе начало термодинамики.
- •Энтропия и информация.
- •Фазовые переходы. Нарушения симметрии при фазовых переходах и параметр порядка.
- •Лекция 16. Синергетика. Соотношение порядка и хаоса в открытых неравновесных системах.
- •Открытые неравновесные системы.
- •Функция диссипации. Диссипативные структуры.
- •Сценарий образования упорядоченных структур.
- •Примеры самоорганизации в неживой природе: Возникновение структуры как фазовый переход.
- •Бифуркации. Вероятностный характер эволюции системы. Динамический хаос.
- •Аттракторы. Фракталы.
- •Лекция 17. Происхождение и эволюция Вселенной.
- •Строение Вселенной.
- •Гипотезы о возникновении Вселенной.
- •«Инфляционная модель».
- •Физический вакуум.
- •Виды галактик. Млечный Путь.
- •Звезды и их эволюция. Главная последовательность.
- •Черные дыры.
- •Солнце и Солнечная система.
- •Лекция 18. Планета Земля.
- •Формирование и строение Земли.
- •Строение Земли.
- •История геологического развития Земли.
- •Литосфера и ее экологические функции.
- •Магнитосфера.
- •Гидросфера.
- •Атмосфера.
- •Географическая оболочка Земли.
- •Климат.
- •Географическая широта местности
- •10. Глобальные изменения климата.
- •Лекция 19. Элементы химии.
- •Химические элементы. Периодическая система элементов д.И.Менделеева.
- •Понятие вещества. Агрегатные состояния вещества. Виды химических связей.
- •Реакционная способность веществ. Виды химических реакций.
- •Тепловой эффект химических реакций и энтропия.
- •Химическое равновесие. Катализ и его виды.
- •Лекция 20. Вода и гипотезы о происхождении жизни на Земле. Самоорганизация в живой природе.
- •Особенности биологического уровня организации материи.
- •Вода как колыбель жизни.
- •Исторический обзор основных концепций возникновения жизни на Земле.
- •Самоорганизация в живой природе.
- •Лекция 21. Биосфера и проблемы экологии. Понятие о ноосфере.
- •Уровни организации живой материи.
- •Биосфера.
- •Биоценоз. Биогеоценоз.
- •Проблемы взаимодействия человека и природы.
- •Возможные сценарии развития биосферы.
- •Учение в.И.Вернадского о ноосфере.
- •Лекция 22. Молекулярные основы жизни. Днк и информация.
- •Молекулярные механизмы жизни.
- •Элементарные представления о строении клетки и ее жизнедеятельности.
- •Днк и информация.
- •Мутации как ошибки при репликации днк.
- •Проблемы биологической этики.
- •Поведенческая информация. Информация и жизнь.
- •Лекция 23. Феномен человека.
- •Антропология.
- •Человек как высшая ступень эволюции. Основные этапы антропогенеза.
- •Концепция географически детерминированного этногенеза л.Н.Гумилева..
- •Космические и биологические циклы. Русский космизм (идеи а.Л.Чижевского, к.Э.Циолковского).
- •Антропный принцип.
- •Человек: индивидуум, личность, индивидуальность.
- •Самоорганизация в социально-экономических системах.
- •Лекция 24. Теория эволюции в биологии. Принципы универсального эволюционизма. Путь к единой культуре.
- •Додарвиновский эволюционизм. Идеи Ламарка и Кювье.
- •Классическая теория эволюции ч.Дарвина.
- •Современная теория эволюции.
- •Квантовый характер видообразования.
- •Принцип универсального эволюционизма.
- •Вопросы для подготовки к экзамену
- •Задачи для самостоятельного решения
- •Рекомендуемая литература
Теплота, внутренняя энергия и работа.
Кинетическая энергия движения молекул и потенциальная энергия их взаимодействия составляют внутреннюю энергию системы. Изменить энергию термодинамической системы можно двумя способами:
Путем теплопередачи – при непосредственном контакте или на расстоянии, радиационными методами (с помощью излучения). Таким образом, система получает или отдает некоторое количество теплоты Q.
Путем совершения работы. Работу газа в термодинамике легко вычислить: при малом изменении объема
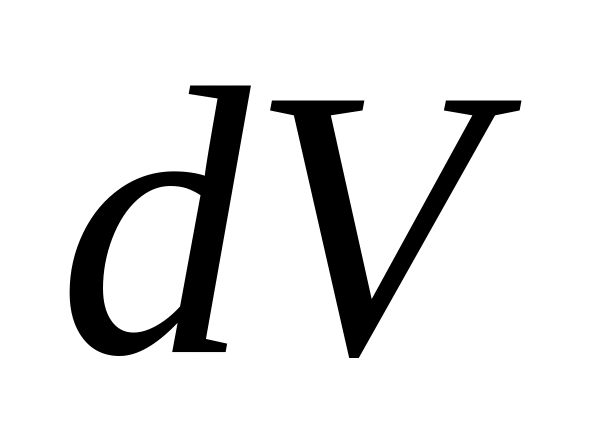 она равна
она равна
![]() .
.
Получить полезную работу от термодинамической системы – главная практическая цель термодинамических исследований. Выражение для А показывает, что при V = const работа не производится. Наглядно изобразить работу термодинамической системы можно, если графически представить процесс на осях (p,V) – это площадь фигуры под графиком процесса.
Лекция 14. Энергия в термодинамических процессах.
Первое начало термодинамики как закон сохранения энергии.
Закон сохранения механической энергии не является столь же универсальным, как законы сохранения импульса и момента импульса. Требование, чтобы в системе присутствовали только консервативные силы, в реальных системах невыполнимо. Как учесть потери механической энергии и что с ней происходит?
Опыт показывает, что в результате трения тела нагреваются, т.е. изменяется внутреннее состояние вещества. Еще М.В.Ломоносовым установлено, что при нагревании увеличивается интенсивность движения молекул, составляющих тело, а мерой кинетической энергии молекул является температура.
Таким образом, трение в механической системе приводит к тому, что механическая энергия частично или полностью переходит во внутреннюю тепловую энергию U (по сути, также механическую – кинетическую энергию движения молекул, составляющих тело).
Понятие внутренней энергии справедливо только для равновесных систем, для которых определено понятие «состояние». Функция U зависит только от состояния системы в данный момент и не зависит от предшествующих состояний. Говорят, что внутренняя энергия U является функцией состояния системы.
![]() .
.
Если система путем теплопередачи получила некоторое количество теплоты Q, ее внутренняя энергия увеличится. А если она совершит положительную работу А = pdV, то внутренняя энергия уменьшится:
![]() ,
или
,
или
![]() .
(*)
.
(*)
Выражение (*) называется 1 началом термодинамики и представляет собой закон сохранения энергии в термодинамическом процессе: теплота, полученная системой, расходуется на изменение ее внутренней энергии и совершение ею работы. Все величины в (*) могут быть и положительны, и отрицательны, и равны 0.
Еще одна формулировка 1 начала звучит так: невозможен вечный двигатель 1 рода, который совершал бы работу за счет полученной извне теплоты. Действительно, в конце цикла U=0, А=Q, т.е. в точности равна затратам энергии, а не превышает их.
Заметим, что 1 начало термодинамики не указывает на направление процесса. Например, ему не противоречит такая ситуация: система получила 10 Дж теплоты, при этом она совершила работу 15 Дж, а ее внутренняя энергия уменьшилась на 5 Дж:
10 = -5 + 15 (Дж).
Система совершила работу большую, чем подведенная к ней энергия, за счет своего охлаждения. Опыт показывает, что такие ситуации не реализуются.
