
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
1.4.3 Элементы III периода (Na – Ar)
Электронная конфигурация внешнего энергетического уровня невозбуждённых атомов элементов III периода такая же, как и у элементов соответствующих групп II периода. Различие состоит лишь в том, что у элементов III периода заполняются орбитали третьего энергетического уровня (n = 3). В этом случае орбитальное квантовое число l может принимать три значения: 0; 1; 2. Следовательно, третий энергетический уровень образован орбиталями трёх типов: одной s-орбиталью, тремя p-орбиталями, пятью d-орбиталями.
Элемент второго периода: Элемент третьего периода:
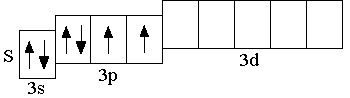
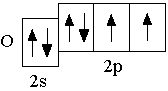
Таким образом, номер периода, в котором находится элемент, равен главному квантовому числу, которое характеризует электроны внешнего энергетического уровня.
У атомов всех элементов III периода, находящихся в невозбуждённом состоянии, 3d-орбитали являются вакантными (т.е. незаполненными электронами). При возбуждении атома, которое происходит в результате передачи атому извне дополнительной энергии, спаренные электроны, находящиеся на 3p-подуровне (а также на 3s-подуровне), могут расспариваться и переходить на более высокий по энергии 3d-подуровень.
н евозбуждённое
состояние
возбуждённое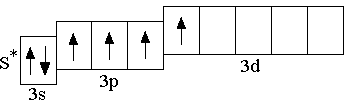
состояние
возбуждённое
состояние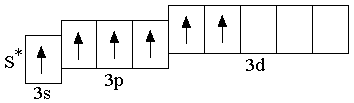
Как известно, ковалентная химическая связь может образоваться при взаимодействии неспаренных электронов двух атомов; в результате такого взаимодействия образуется общая электронная пара, принадлежащая обоим атомам. Поэтому число неспаренных электронов в атоме равно числу химических связей, которые может образовать данный атом. У s- и p-элементов валентными электронами являются электроны внешнего энергетического уровня; таким образом, валентность s- или p-элемента определяется числом внешних неспаренных электронов. Так, атом серы в невозбуждённом состоянии двухвалентен; возбуждение атома серы позволяет реализовать четырёхвалентное и шестивалентное состояния.
1.4.4 Элементы IV периода (k – Kr)
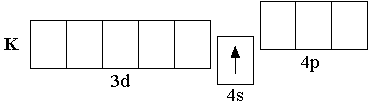
У последнего элемента III периода – аргона – полностью заполнены 3s- и 3p-подуровни, но свободны все 3d-орбитали. Однако, у следующих за аргоном элементов – калия и кальция – заполнение третьего электронного слоя временно прекращается и начинает формироваться s-подуровень внешнего четвёртого энергетического уровня:
K 1s22s22p63s23p63d04s1 Ca 1s22s22p63s23p63d04s2 .
В обеих электронных формулах жирным шрифтом выделены внешние электроны. Причина такой непоследовательности заполнения энергетических уровней связана с тем, что в многоэлектронном атоме энергия электрона определяется не только значением главного квантового числа n, но и значением орбитального квантового числа l, вследствие чего 4s-орбиталь имеет более низкую энергию, чем вакантные 3d-орбитали.
Последовательность заполнения атомных орбиталей в зависимости от значений главного и орбитального квантовых чисел определяется правилами Клечковского:
1) при увеличении заряда ядра атома последовательное заполнение электронами атомных орбиталей происходит от орбиталей с меньшей величиной суммы главного и орбитального квантовых чисел (n + l) к орбиталям с большим значением этой суммы;
2) при одинаковых величинах суммы (n + l) заполнение орбиталей происходит в направлении возрастания значения главного квантового числа n (таблица 1.2).
Таблица 1.2 – Последовательность заполнения атомных
орбиталей электронами
Энергия орбитали |
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d< |
|||||||||
Сумма n + l |
1 |
2 |
3 |
3 |
4 |
4 |
5 |
5 |
5 |
6 |
Энергия орбитали |
<5p < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈ 6d < 7p |
||||||||
Сумма n + l |
6 |
6 |
7 |
7 |
7 |
7 |
8 |
8 |
8 |
Таким образом, хотя 3d-орбитали появляются уже у элементов третьего периода, заполнение 3d-орбиталей происходит только после заполнения 4s-орбиталей, т.е. у элементов четвёртого периода. Точно так же, свободные f-орбитали есть уже у элементов четвёртого периода (n = 4, l = 0; 1; 2; 3), но заполнение этих 4f-орбиталей происходит только после заполнения 6s-орбиталей, т.е. у элементов шестого периода. Из сказанного следует, что после кальция появляется ряд из десяти d-элементов (Sc – Zn), у которых заполняются 3d-орбитали.
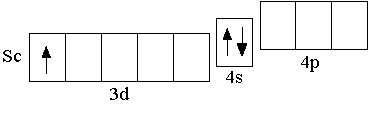
Sc 3d14s2
T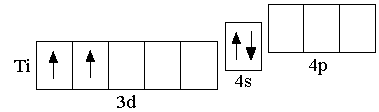 i
3d24s2
i
3d24s2
V
3d34s2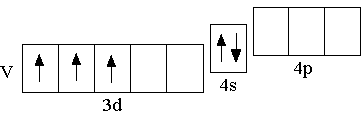
Cr
3d54s1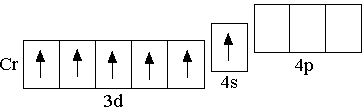
Особенность электронной конфигурации атома хрома в том, что ему соответствует формула 3d54s1, а не 3d44s2, что связано с «проскоком» одного электрона с 4s-орбитали на 3d-орбиталь. Это объясняется тем, что в результате «проскока» электрона образуется наполовину заполненный электронами 3d-подуровень, обладающий повышенной устойчивостью. Повышенной устойчивостью обладают также полностью заполненные электронами подуровни, вследствие чего «проскок» электрона происходит также у атома меди. Следует отметить, что отсутствие химической активности у инертных газов также объясняется устойчивостью полностью заполненных электронных уровней.
Mn
3d54s2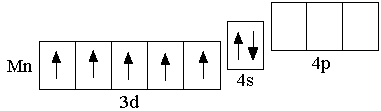
Fe
3d64s2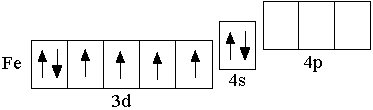
Co 3d74s2
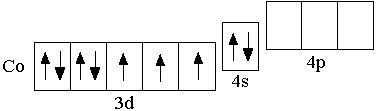
Ni
3d84s2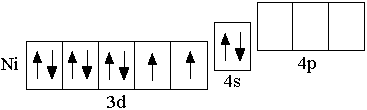
C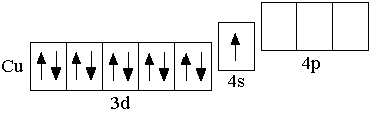 u
3d104s1,
u
3d104s1,
а не 3d94s2;
(«проскок
электрона»)
Zn 3d104s2
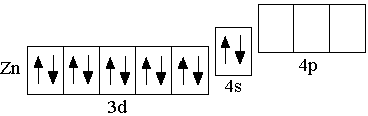
После ряда d-элементов в четвёртом периоде идёт заполнение p-орбиталей у элементов Ga – Kr, электронная конфигурация которых аналогична электронной конфигурации p-элементов B – Ne или Al – Ar. Следует отметить, что все d-элементы являются металлами.
