
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
3.8 Применение галогенов
Фтор и его соединения применяются для получения термоустойчивых пластмасс (тефлон), жидкостей для холодильных машин (фреоны).
Хлор используется в больших количествах для производства соляной кислоты синтетическим методом, хлорорганических инсектицидов, пластмасс, синтетических волокон, хлорной извести, отбеливания тканей и бумаги, хлорирования воды в целях обеззараживания.
Соединения брома и йода используются для производства лекарственных препаратов, фотоматериалов.
Л Е К Ц И Я 4
P-ЭЛЕМЕНТЫ VI ГРУППЫ
4.1 Введение
К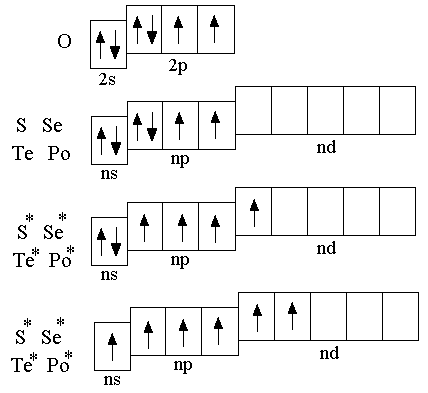 p-элементам
VI группы относятся кислород, сера,
селен, теллур, полоний.
p-элементам
VI группы относятся кислород, сера,
селен, теллур, полоний.
На внешнем электронном слое атомов рассматриваемых элементов находится шесть электронов; электронная конфигурация внешнего уровня описывается формулой ns2np4. Атом кислорода отличается от атомов других p-элементов VI группы отсутствием d-подуровня на внешнем энергетическом уровне, поэтому валентность кислорода, как правило, равна двум. Остальные элементы подгруппы могут проявлять валентность равную 2; 4; 6.
Все элементы данной подгруппы, кроме полония, – неметаллы. Полоний – радиоактивный металл. Кислород, сера, селен, теллур в соединениях с металлами и водородом чаще всего проявляют степень окисления минус 2, в соединениях с более электроотрицательными неметаллами степень окисления серы, селена и теллура может быть равна +4 или +6. Кислород по электроотрицательности уступает только фтору, поэтому положительную степень окисления (+2) он имеет только в соединении OF2. Кислород в пероксидах (H2O2, BaO2), а сера в полисульфидах (H2Sx, FeS2) имеют степень окисления минус 1.
Как и в подгруппе галогенов, увеличение радиусов атомов элементов в ряду O – S – Se – Te приводит к уменьшению электроотрицательности, окислительной активности простых веществ и усилению восстановительных свойств атомов в степени окисления минус 2. Поэтому неметаллические свойства, ярко выраженные у кислорода, оказываются очень ослабленными у теллура.
4.2 Кислород
Кислород самый распространённый элемент земной коры. Молекула кислорода двухатомна (O2). Простое вещество – молекулярный кислород – представляет собой газ без цвета и запаха, плохо растворимый в воде. В атмосфере Земли содержится 21 % (по объёму) кислорода. В природных соединениях кислород встречается в виде оксидов (H2O, SiO2) и солей оксокислот. Одно из важнейших природных соединений кислорода – вода, или оксид водорода H2O.
Помимо оксидов, кислород способен образовывать пероксиды – вещества, содержащие следующую группировку атомов: –O–O– . Один из важнейших пероксидов – пероксид водорода H2O2 (H–O–O–H). В пероксидах атомы кислорода имеют промежуточную степень окисления минус 1, поэтому эти соединения могут быть как окислителями, так и восстановителями:
H2O2
+ 2 H+
+ 2 e–
2 H2O
![]() = + 1,776 В;
= + 1,776 В;
H2O2
+ 2 e–
2 OH–
![]() = + 0,88 В;
= + 0,88 В;
H2O2
2 H+
+ O2
+ 2 e–
![]() = + 0,682 В;
= + 0,682 В;
H2O2
+ 2 OH–
O2
+ 2 H2O
+ 2 e–
![]() = – 0,076 В.
= – 0,076 В.
Из величин стандартных электродных потенциалов следует, что окислительные свойства H2O2 наиболее сильно проявляются в кислой среде, а восстановительные – в щелочной. Например, пероксид водорода в кислой среде способен окислять те вещества, стандартный потенциал электрохимической системы которых не превышает +1,776 В, и восстанавливать только те, у которых потенциал больше +0,682 В.
Пероксид водорода обладает свойствами очень слабой кислоты, но с некоторыми основаниями он способен образовывать соли:
H2O2 + Ba(OH)2 2 H2O + BaO2 (пероксид бария).
Лабораторный способ получения пероксида водорода заключается в действии серной кислоты на пероксид бария:
BaO2 (тв.) + H2SO4 H2O2 + BaSO4 .
В промышленности пероксид водорода получают гидролизом пероксодисерной кислоты (см. раздел 4.3.6 «Мононадсерная и пероксодисерная кислоты» данной лекции).
Аллотропной модификацией кислорода является озон (O3) – газ со специфическим запахом. Озон получают действием «тихих» электрических разрядов на кислород в специальных приборах – озонаторах. Реакция превращения кислорода в озон требует затраты энергии:
3O2 ⇆ 2O3 – 285 кДж .
Обратный процесс – распад озона – протекает самопроизвольно.
Озон – один из сильнейших окислителей; по окислительной активности он уступает только фтору:
O3
+ 2 H+
+
2 e–
O2
+ H2O
![]() = + 2,07 В;
= + 2,07 В;
O3
+ H2O+
2 e–
O2
+ 2 OH–
![]() = + 1,24 В.
= + 1,24 В.
Он окисляет все металлы, кроме золота и платиновых металлов, а также большинство неметаллов. Он переводит низшие оксиды в высшие, а сульфиды металлов в сульфаты. Во всех окислительно-восстановительных реакциях озон, восстанавливаясь, превращается в молекулу O2:
2 KI + O3 + H2O I2 + 2 KOH + O2 .
Промышленный способ получения кислорода – ректификация жидкого воздуха. В лаборатории кислород получают термическим разложением перманганата калия: 2 KMnO4 K2MnO4 + MnO2 + O2
или хлората калия (см. раздел 3.7 «Кислородсодержащие соединения галогенов» лекции 3). Кислород можно также получить термическим разложением нитратов щелочных металлов (см. раздел 5.2.5 «Азотная кислота и её соли» лекции 5), электролизом воды и каталитическим разложением пероксида водорода:
MnO2
2 H2O2 2 H2O + O2 .
