
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
Галогены
3.1 Введение
В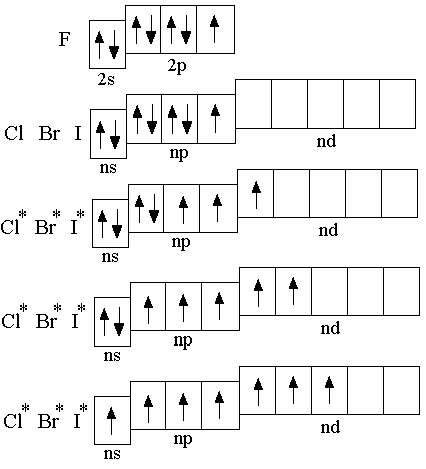 ходящие
в главную подгруппу VII группы элементы
фтор, хлор, бром, йод и астат называются
галогенами. У атомов галогенов во
внешнем электронном слое по семь
электронов: 2 на s-орбиталях и 5 на
p-орбиталях (ns2np5).
Галогены – типичные неметаллы: их
атомы, обладая значительным сродством
к электрону, легко присоединяют электрон,
образуя однозарядные отрицательные
ионы F–,
Cl–,
Br–,
I–.
С повышением порядкового номера
элементов в ряду F – Cl
– Br
– I
– At увеличиваются радиусы атомов, и
уменьшаются электроотрицательность,
неметаллические свойства и окислительная
способность элементов.
ходящие
в главную подгруппу VII группы элементы
фтор, хлор, бром, йод и астат называются
галогенами. У атомов галогенов во
внешнем электронном слое по семь
электронов: 2 на s-орбиталях и 5 на
p-орбиталях (ns2np5).
Галогены – типичные неметаллы: их
атомы, обладая значительным сродством
к электрону, легко присоединяют электрон,
образуя однозарядные отрицательные
ионы F–,
Cl–,
Br–,
I–.
С повышением порядкового номера
элементов в ряду F – Cl
– Br
– I
– At увеличиваются радиусы атомов, и
уменьшаются электроотрицательность,
неметаллические свойства и окислительная
способность элементов.
В отличие от других галогенов, фтор в соединениях всегда имеет степень окисления минус 1, так как он – самый электроотрицательный элемент.
Остальные галогены могут иметь различные степени окисления от минус 1 до +7. За исключением некоторых оксидов, все степени окисления галогенов – нечётные; это связано с тем, что и в основном, и возбуждённом состояниях атомы галогенов имеют нечётное число неспаренных электронов.
3.2 Физические свойства галогенов
При нормальных условиях фтор – газ бледно-жёлтого цвета, хлор – газ жёлто-зелёного цвета, бром – красно-бурая жидкость, йод – кристаллическое вещество серого цвета. При нагревании при атмосферном давлении йод сублимируется (возгоняется), превращаясь в пар фиолетового цвета; при охлаждении пары йода кристаллизуются, минуя жидкое состояние. Молекулы простых веществ, образуемых атомами галогенов, двухатомны. С увеличением радиусов атомов (и размеров молекул) обычно усиливается межмолекулярное взаимодействие, поэтому в ряду F2 – Cl2 – Br2 – I2 – At2 наблюдается увеличение температур плавления и кипения. В то же время, в ряду Cl2 – Br2 – I2 – At2 с увеличением радиусов атомов прочность химической связи в молекулах галогенов уменьшается.
Все галогены обладают резким запахом. Вдыхание их даже в небольших количествах приводит к раздражению дыхательных путей. Значительные количества галогенов могут вызвать тяжёлое отравление.
Галогены слабо растворимы в воде. Фтор не может быть растворён в воде, так как окисляет её. В органических растворителях галогены растворимы значительно лучше, чем в воде.
3.3 Химические свойства галогенов
Свободные галогены проявляют высокую химическую активность. Они вступают во взаимодействие со многими простыми веществами, проявляя в этих реакциях свойства окислителей. Например, фтор непосредственно не взаимодействует только с кислородом, азотом, гелием, неоном и аргоном; хлор непосредственно не взаимодействует с кислородом, азотом и инертными газами. Химическая активность брома и йода меньше, чем у хлора, но всё же достаточно велика. При этом бром по активности мало уступает хлору, а йод отличается от хлора значительно. Многие металлы сгорают в атмосфере хлора, образуя хлориды. Особенно бурно эта реакция протекает со щелочными и щелочноземельными металлами. 2 Na + Cl2 2 NaCl (яркая вспышка);
Cu + Cl2 CuCl2; 2 Fe + 3 Cl2 2 FeCl3 .
Окислительные свойства галогены проявляют также и в реакциях взаимодействия со сложными веществами. Например, под действием хлора и брома соединения двухвалентного железа окисляются до соединений железа (III):
2 FeCl2 + Cl2 2 FeCl3 .
Сера в степени окисления минус 2 обычно окисляется до свободной серы:
H2S + I2 S + 2 HI.
Сульфиты окисляются галогенами до сульфатов, нитриты – до нитратов:
Na2SO3 + I2 + H2O Na2SO4 + 2 HI; KNO2 + Cl2 + H2O KNO3 + 2 HCl.
Исключительно высока химическая активность фтора. Со многими неметаллами он реагирует со взрывом и воспламенением.
H2 + F2 2 HF; Si + 2 F2 SiF4; S + 3 F2 SF6.
При нагревании со фтором соединяются даже некоторые инертные газы, например, ксенон: Xe + F2 XeF2; Xe + 2 F2 XeF4.
Очень энергично реагирует фтор со сложными веществами. В его атмосфере горят такие устойчивые вещества, как стекло в виде ваты и вода:
SiO2 + 2 F2 SiF4 + O2; 2 H2O + 2 F2 4 HF + O2 .
При этом происходит окисление связанного кислорода до простого вещества. Для фтора известно соединение с кислородом, в котором кислород имеет степень окисления +2 (фторид кислорода). OF2 можно получить осторожным взаимодействием фтора с водным раствором щёлочи:
2 F2 + 2 NaOH 2 NaF + OF2 + H2O .
Окислительная
активность галогенов уменьшается от
фтора к астату, а восстановительная
активность галогенид-ионов в этом
направлении увеличивается:
![]() =
+2,77 В;
=
+2,77 В;
![]() =
+1,36 В;
=
+1,36 В;
![]() =
+1,09 В;
=
+1,09 В;
![]() =
+0,55 В.
Эта закономерность проявляется в
способности более лёгких галогенов
окислять галогенид-ионы более тяжёлых
галогенов:
=
+0,55 В.
Эта закономерность проявляется в
способности более лёгких галогенов
окислять галогенид-ионы более тяжёлых
галогенов:
Cl2 + 2 NaI I2 + 2 NaCl;
Br2 + 2 NaI I2 + 2 NaBr;
Cl2 + 2 NaBr Br2 + 2 NaCl .
Галогены также могут реагировать друг с другом с образованием бинарных соединений типа ClF, ClF3, ClF5, BrF3, BrF5, IF3, IF5, IF7, ICl, ICl3 .
