
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
9.5 Марганец
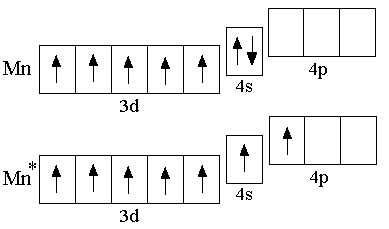 Электронная
конфигурация невозбуждённого атома
марганца – 3d54s2;
возбуждённое состояние выражается
электронной формулой 3d54s14p1.
Электронная
конфигурация невозбуждённого атома
марганца – 3d54s2;
возбуждённое состояние выражается
электронной формулой 3d54s14p1.
Для марганца в соединениях наиболее характерны степени окисления +2, +4, +6, +7.
Марганец – серебристо-белый, хрупкий, достаточно активный металл: в ряду напряжений он находится между алюминием и цинком. На воздухе марганец покрыт оксидной плёнкой, предохраняющей его от дальнейшего окисления. В мелкораздробленном состоянии марганец окисляется легко.
Оксид марганца (II) MnO и соответствующий ему гидроксид Mn(OH)2 обладают основными свойствами – при их взаимодействии с кислотами образуются соли двухвалентного марганца: Mn(OH)2 + 2 H+ Mn2+ + 2 H2O.
Катионы Mn2+ образуются также при растворении металлического марганца в кислотах. Соединения марганца (II) проявляют восстановительные свойства, например, белый осадок Mn(OH)2 на воздухе быстро темнеет, постепенно окисляясь до MnO2: 2 Mn(OH)2 + O2 2 MnO2 + 2 H2O.
Оксид марганца (IV) MnO2 является наиболее устойчивым соединением марганца; он легко образуется как при окислении соединений марганца в более низкой степени окисления (+2), так и при восстановлении соединений марганца в более высоких степенях окисления (+6, +7):
Mn(OH)2 + H2O2 MnO2 + 2 H2O;
2 KMnO4 + 3 Na2SO3 + H2O 2 MnO2 + 3 Na2SO4 + 2 KOH .
MnO2
– амфотерный оксид, однако и кислотные,
и основные свойства у него выражены
слабо. Одной из причин того, что MnO2
не проявляет отчётливо выраженных
основных свойств, является его сильная
окислительная активность в кислой
среде (![]() =
+1,23 В): MnO2
восстанавливается до ионов Mn2+,
а не образует устойчивых солей
четырёхвалентного марганца. Соответствующую
оксиду марганца (IV)
гидратную форму следует рассматривать
как гидратированный диоксид марганца
MnO2xH2O.
Оксиду марганца (IV)
как амфотерному оксиду формально
соответствуют орто- и мета-формы не
выделенной в свободном состоянии
марганцоватистой кислоты: H4MnO4
– орто-форма и H2MnO3
– мета-форма. Известен оксид марганца
Mn3O4,
который можно рассматривать как соль
двухвалентного марганца орто-формы
марганцоватистой кислоты Mn2MnO4
– ортоманганит марганца (II). В литературе
имеются сообщения о существовании
оксида Mn2O3.
Существование этого оксида можно
объяснить, рассмотрев его как соль
двухвалентного марганца мета-формы
марганцоватистой кислоты: MnMnO3
– метаманганит марганца (II).
=
+1,23 В): MnO2
восстанавливается до ионов Mn2+,
а не образует устойчивых солей
четырёхвалентного марганца. Соответствующую
оксиду марганца (IV)
гидратную форму следует рассматривать
как гидратированный диоксид марганца
MnO2xH2O.
Оксиду марганца (IV)
как амфотерному оксиду формально
соответствуют орто- и мета-формы не
выделенной в свободном состоянии
марганцоватистой кислоты: H4MnO4
– орто-форма и H2MnO3
– мета-форма. Известен оксид марганца
Mn3O4,
который можно рассматривать как соль
двухвалентного марганца орто-формы
марганцоватистой кислоты Mn2MnO4
– ортоманганит марганца (II). В литературе
имеются сообщения о существовании
оксида Mn2O3.
Существование этого оксида можно
объяснить, рассмотрев его как соль
двухвалентного марганца мета-формы
марганцоватистой кислоты: MnMnO3
– метаманганит марганца (II).
При сплавлении в щелочной среде диоксида марганца с такими окислителями как хлорат или нитрат калия происходит окисление четырёхвалентного марганца до шестивалентного состояния, и образуется манганат калия – соль очень неустойчивой даже в растворе марганцовистой кислоты H2MnO4, ангидрид которой (MnO3) неизвестен:
MnO2 + KNO3 + 2 KOH K2MnO4 + KNO2 + H2O .
Манганаты неустойчивы и склонны к диспропорционированию по обратимой реакции: 3 K2MnO4 + 2 H2O ⇆ 2 KMnO4 + MnO2 + 4 KOH ,
вследствие чего зелёная окраска раствора, обусловленная манганат-ионами MnO42–, изменяется на фиолетовую окраску, характерную для перманганат-ионов MnO4–.
Наиболее широко применяемое соединение семивалентного марганца – перманганат калия KMnO4 – соль известной только в растворе марганцовой кислоты HMnO4. Перманганат калия можно получить окислением манганатов сильными окислителями, например, хлором:
2 K2MnO4 + Cl2 2 KMnO4 + 2 KCl .
Оксид марганца (VII), или марганцовый ангидрид, Mn2O7 – взрывчатая зелёно-бурая жидкость. Mn2O7 может быть получен по реакции:
2 KMnO4 + 2 H2SO4 (конц.) Mn2O7 + 2 KHSO4 + H2O .
Соединения марганца в высшей степени окисления +7, в частности перманганаты, являются сильными окислителями. Глубина восстановления перманганат-ионов и их окислительная активность зависит от pH среды.
В сильнокислой среде продуктом восстановления перманганатов является ион Mn2+, при этом получаются соли двухвалентного марганца:
MnO4–
+ 8 H+
+ 5 e–
Mn2+
+ 4 H2O
(![]() =
+1,51 В).
=
+1,51 В).
В нейтральной, слабощелочной или слабокислой среде в результате восстановления перманганат-ионов образуется MnO2:
MnO4–
+ 2 H2O
+ 3 e–
MnO2
+ 4 OH–
(![]() =
+0,60 В).
=
+0,60 В).
MnO4–
+ 4 H+
+ 3 e–
MnO2
+ 2 H2O
(![]() =
+1,69 В).
=
+1,69 В).
В сильнощелочной среде перманганат-ионы восстанавливаются до манганат-ионов MnO42– , при этом образуются соли типа K2MnO4 , Na2MnO4:
MnO4–
+ e–
MnO42–
(![]() =
+0,56 В).
=
+0,56 В).
