
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
4.3.3 Диоксид серы. Сернистая кислота
Оксид серы (IV) образуется при горении серы на воздухе:
S + O2 SO2 .
В промышленности SO2 получают при обжиге сульфидов и полисульфидов металлов, а также термическим разложением сульфатов (в частности CaSO4):
4 FeS2 + 11 O2 2 Fe2O3 + 8 SO2 2 CaSO4 2 CaO + 2 SO2 + O2.
Диоксид серы – бесцветный газ с запахом жжёной серы. SO2 хорошо растворяется в воде, образуя сернистую кислоту:
SO2 + H2O ⇆ H2SO3 .
На обратимости этой реакции основан лабораторный способ получения сернистого газа: Na2SO3 + H2SO4 Na2SO4 + SO2 + H2O .
Сернистая кислота – слабая двухосновная кислота (К1=1,610–2, К2=610–8). H2SO3 и её соли являются хорошими восстановителями и окисляются до серной кислоты или сульфатов: 2 H2SO3 + O2 2 H2SO4 ;
Na2SO3 + Cl2 + H2O Na2SO4 + 2 HCl .
Однако, атом серы в молекуле H2SO3 находится в промежуточной степени окисления (+4), поэтому при взаимодействии с сильными восстановителями сернистая кислота может выступать и в роли окислителя:
H2SO3 + 2 H2S 3 S + 3 H2O.
Сульфиты наиболее активных металлов при прокаливании диспропорционируют:
4 Na2SO3 Na2S + 3 Na2SO4 .
4.3.4 Триоксид серы. Серная кислота
При высокой температуре в присутствии катализатора (V2O5, сплавы на основе платины) диоксид серы окисляется кислородом до триоксида:
2 SO2 + O2 2 SO3 .
Оксид серы (VI) – это ангидрид серной кислоты: SO3 + H2O H2SO4 .
Схему промышленного получения серной кислоты контактным способом можно представить в виде следующей последовательности химических превращений: FeS2 (CuS, другие сульфиды) SO2 SO3 H2SO4 .
Существует также нитрозный способ получения серной кислоты:
SO2 + NO2 + H2O H2SO4 + NO.
Образующийся NO далее взаимодействует с кислородом воздуха, окисляясь до NO2: 2 NO + O2 2 NO2 .
Диоксид азота вновь идёт на окисление SO2 . Таким образом, диоксид азота не расходуется в реакции и является гомогенным катализатором.
В газообразном состоянии оксид серы (VI) состоит из молекул SO3, построенных в форме правильного треугольника. При конденсации паров SO3 образуется летучая жидкость (t кипения = +44,8 C), состоящая преимущественно из тримерных циклических молекул. При охлаждении до +16,8 C она затвердевает, и образуется так называемая льдовидная модификация SO3 . При хранении она постепенно превращается в асбестовидную модификацию SO3, состоящую из полимерных молекул.
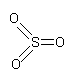
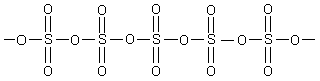
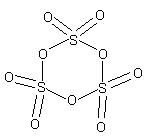
газ
твёрдое вещество
К
газ
жидкость
твёрдое вещество
жидкость
Cu + 2 H2SO4 (конц.) CuSO4 + SO2 + 2 H2O;
Zn + 2 H2SO4 (конц.) ZnSO4 + SO2 + 2 H2O;
3 Zn + 4 H2SO4 (конц.) 3 ZnSO4 + S + 4 H2O;
4 Zn + 5 H2SO4 (конц.) 4 ZnSO4 + H2S + 4 H2O.
H2SO4 – сильная двухосновная кислота, диссоциированная по первой стадии практически нацело; диссоциация по второй стадии протекает в меньшей степени, однако в разбавленных водных растворах серная кислота диссоциирована практически нацело по схеме: H2SO4 2 H+ + SO42–.
Большинство солей серной кислоты хорошо растворимо в воде. К практически нерастворимым относятся BaSO4 , SrSO4 , PbSO4; малорастворим CaSO4. Качественная реакция на ионы SO42– обусловлена образованием малорастворимых сульфатов. Например, при введении ионов бария в раствор, содержащий сульфат-ионы, выпадает белый осадок сульфата бария, практически нерастворимый в воде и разбавленных кислотах: Ba2+ + SO42– BaSO4 .
