
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
6.1 Введение
Главную подгруппу IV группы образуют пять элементов: углерод, кремний, германий, олово и свинец.
Атомы рассматриваемых элементов во внешнем электронном слое содержат четыре электрона, что описывается электронной формулой ns2np2.
П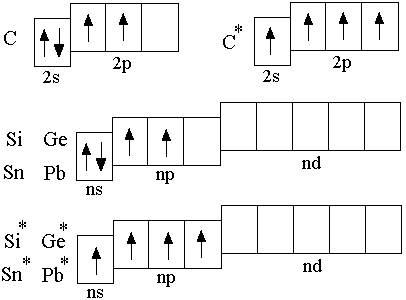 ри
переходе от углерода к свинцу с
увеличением радиусов атомов
усиливаются
металлические свойства, которые
проявляются уже у германия,
и если углерод и кремний являются
неметаллами, то олово и свинец – металлы.
ри
переходе от углерода к свинцу с
увеличением радиусов атомов
усиливаются
металлические свойства, которые
проявляются уже у германия,
и если углерод и кремний являются
неметаллами, то олово и свинец – металлы.
Элементы рассматриваемой подгруппы могут иметь степени окисления +2 и +4, неметаллы в соединениях с менее электроотрицательными элементами – степень окисления минус 4. Степень окисления +2 для кремния и германия менее характерна, чем +4.
6.2 Углерод и его соединения
6.2.1 Свойства углерода – простого вещества
У
Рисунок 6.1 – Аллотропные
модификации углерода: а)
структура алмаза; б) структура графита.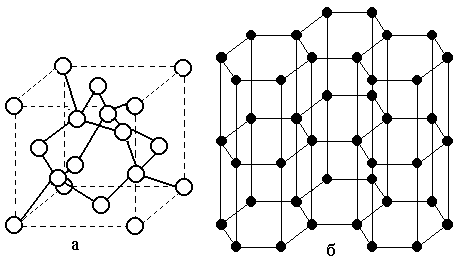
(–CC–CC–CC–C),
поликумулен:
(=C=C=C=C=C=C=);
фуллерен (полые шарообразные молекулы C60, C70 и др.). Углерод проявляет высокую активность лишь при высоких температурах и служит хорошим восстановителем, что позволяет использовать его в металлургии для восстановления металлов из руд:
Cu2O + C 2 Cu + CO; Fe2O3 + 3 C 2 Fe + 3 CO.
Углерод образует два оксида: CO (угарный газ) и CO2 (углекислый газ).
6.2.2 Оксид углерода (IV). Угольная кислота и её соли
Оксид углерода (IV) – легко сжижающийся под давлением бесцветный газ. Твёрдая углекислота при атмосферном давлении и температуре минус 78,5 C без плавления переходит в газообразное состояние.
CO2 – ангидрид слабой (K1 = 4,510–7 , K2 = 4,710–11) неустойчивой угольной кислоты H2CO3 (соли – карбонаты). Все карбонаты, кроме карбонатов щелочных металлов, при нагревании разлагаются с выделением диоксида углерода. Это свойство используется для промышленного получения углекислого газа:
CaCO3 CaO + CO2 (t > 1000 C).
Углекислый газ также получается в качестве побочного продукта при горении угля и органических веществ: C + O2 CO2 .
В лаборатории CO2 получают, действуя на мрамор соляной кислотой:
СaCO3 + 2 HCl CaCl2 + CO2 + H2O .
Карбонаты, за исключением карбонатов щелочных металлов и аммония, малорастворимы в воде, однако способны переходить в растворимые гидрокарбонаты при поглощении углекислого газа:
СaCO3 + H2O + CO2 Сa(HCO3)2 .
Гидрокарбонаты – термически неустойчивые вещества: при нагревании они переходят в карбонаты: Сa(HCO3)2 СaCO3 + H2O + CO2 .
Одним из главных продуктов химической промышленности является сода (карбонат натрия). В настоящее время её получают аммиачно-хлоридным способом: концентрированный раствор NaCl насыщают аммиаком, после чего пропускают под давлением CO2. При взаимодействии аммиака, углекислого газа и воды образуется гидрокарбонат аммония:
NH3 + CO2 + H2O NH4HCO3 .
Образовавшийся гидрокарбонат аммония вступает в обменную реакцию с хлоридом натрия: NH4HCO3 + NaCl NH4Cl + NaHCO3 .
Гидрокарбонат натрия малорастворим в холодной воде и выделяется в виде осадка; он широко используется в пищевой промышленности под названием питьевой (пищевой) соды. При прокаливании гидрокарбоната натрия получают Na2CO3 – кальцинированную соду: 2 NaHCO3 Na2CO3 + H2O + CO2 .
Выделяющийся CO2 снова возвращается в производство, как и аммиак, который выделяют из хлорида аммония: 2 NH4Cl + Ca(OH)2 СaCl2 + 2 NH3 + 2 H2O .
Кристаллическая сода представляет собой кристаллогидрат Na2CO310H2O; при прокаливании она обезвоживается.
