
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
4.3.5 Олеум. Дисерная кислота
Олеум – это раствор SO3 в концентрированной серной кислоте. В олеуме часть молекул SO3 соединяется с серной кислотой. При этом получается смесь полисерных кислот, представителем которых является дисерная кислота H2S2O7 :
SO3 + H2SO4 H2S2O7.
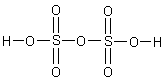
Другое название этой кислоты – пиросерная кислота. Её соли – дисульфаты (или пиросульфаты) – можно получить прокаливанием гидросульфатов:
2 KHSO4 K2S2O7 + H2O .
При нагревании выше температуры плавления дисульфаты разлагаются с выделением SO3, переходя в сульфаты:
K2S2O7 SO3 + K2SO4 .
4.3.6 Мононадсерная и пероксодисерная кислоты
Кислоты, в молекулах которых существует пероксидная группировка –O–O– получили общее название пероксокислот (надкислот).
Строение мононадсерной (H2SO5) и пероксодисерной (H2S2O8) кислот можно представить следующими графическими формулами:
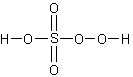
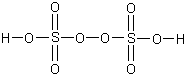
Таким образом, надкислоты можно рассматривать как производные пероксида водорода.
Пероксодисерную кислоту H2S2O8 получают окислением на аноде гидросульфат-ионов при электролизе 50 % раствора серной кислоты или растворов гидросульфатов: 2 HSO4– 2 H+ + S2O82– + 2 e– .
Пероксодисерная кислота, образующаяся в результате электролиза раствора серной кислоты, быстро гидролизуется по реакции:
H2S2O8 + H2O H2SO4 + H2SO5 .
Затем медленно разлагается и мононадсерная кислота:
H2SO5 + H2O ⇆ H2SO4 + H2O2 .
Таким образом, конечными продуктами гидролиза H2S2O8 являются серная кислота и пероксид водорода: H2S2O8 + 2 H2O 2 H2SO4 + H2O2 .
Эта реакция является промышленным способом получения H2O2 . Пероксид водорода отгоняют из реакционной смеси под уменьшенным давлением.
Мононадсерную кислоту можно получить взаимодействием H2S2O8 с концентрированным раствором H2O2: H2S2O8 + H2O2 2 H2SO5 .
Соли
пероксодисерной кислоты – персульфаты
(пероксодисульфаты), как и сама кислота,
являются сильными окислителями и
восстанавливаются до сульфат-ионов:
S2O82–
+ 2 e–
2 SO42–
![]() =
+ 2,0 В.
=
+ 2,0 В.
Мононадсерная кислота является ещё более сильным окислителем, чем пероксодисерная; со многими органическими веществами она реагирует со взрывом.
4.3.7 Тиосерная кислота и тиосульфаты
Тиосерная
кислота H2S2O3
в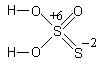 свободном состоянии не получена, но её
соли – тиосульфаты – устойчивы.
Например, тиосульфат натрия применяется
в фотографии в качестве фиксажа.
свободном состоянии не получена, но её
соли – тиосульфаты – устойчивы.
Например, тиосульфат натрия применяется
в фотографии в качестве фиксажа.
Тиосульфат натрия получается при взаимодействии мелкодисперсной серы с кипящим раствором сульфита натрия:
Na2SO3 + S Na2S2O3 .
Так как один атом серы в тиосульфат-ионе находится в высшей степени окисления +6, а другой – в низшей – минус 2, тиосульфаты в кислой среде претерпевают реакцию внутримолекулярного окисления-восстановления:
Na2S2O3 + 2 HCl SO2 + S + 2 NaCl + H2O .
Хлор,
бром и другие сильные окислители
окисляют тиосульфат-ионы до сульфатов.
Под действием менее сильных окислителей,
например, йода, образуются тетратионаты
– соли тетратионовой кислоты H2S4O6,
которая является предс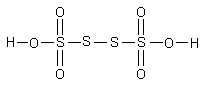 тавителем
политионовых кислот H2SxO6
:
тавителем
политионовых кислот H2SxO6
:
I2 + 2Na2S2O3 2NaI + Na2S4O6 (тетратионат натрия).
