
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
1.3.2 Главное квантовое число
Энергия электрона в атоме – величина квантованная; главное квантовое число (n) характеризует возможные значения энергии электрона в атоме. Главное квантовое число может принимать любые положительные целочисленные значения: n = 1, 2, 3, 4, ... и т.д. Наименьшей энергией электрон обладает при n = 1. Более высокие значения n соответствуют более высоким значениям энергии электрона.
Главное квантовое число определяет также и размеры электронного облака. Чем больше энергия электрона, тем более удалён он от ядра. Поэтому большему значению главного квантового числа соответствует больший размер электронного облака. Электроны, характеризующиеся одним и тем же значением главного квантового числа n, образуют электронные облака приблизительно одинаковых размеров. Это позволяет говорить о существовании в атоме электронных слоёв (или электронных оболочек). Вместо понятия «электронный слой» часто употребляют понятие «энергетический уровень». Если несколько электронов характеризуются одним и тем же значением главного квантового числа, то в этом случае говорят, что электроны находятся на одном и том же энергетическом уровне. Если n = 1, то электроны находятся на первом энергетическом уровне (самом близком к ядру); если n = 2, то электроны находятся на втором энергетическом уровне (более удалённом от ядра) и т.д.
1.3.3 Орбитальное квантовое число
Не только энергия электрона в атоме (и связанный с ней размер электронного облака) принимает определённые значения; произвольной не может быть также и форма электронного облака. Она определяется орбитальным квантовым числом l (прежде его часто называли побочным квантовым числом).
Орбитальное квантовое число l принимает целочисленные значения от 0 до (n-1). Например, если главное квантовое число n = 3, то орбитальное квантовое число l может принимать следующие значения: l = 0; 1; 2. Часто численные значения l заменяют буквенными обозначениями. Если l = 0, то говорят об s-электронных облаках, при l = 1 – о p-электронных облаках, при l = 2 – о d-электронных облаках (см. таблицу 1.1).
1.3.4 Магнитное квантовое число
Ориентация электронного облака в пространстве также не может быть произвольной: она определяется значением магнитного квантового числа (ml), которое может принимать любые целочисленные значения в интервале от -l до +l:
для s-электронов l = 0, ml = 0;
для p-электронов l = 1, ml = -1; 0; +1;
для d-электронов l = 2, ml = -2; -1; 0; +1; +2;
для f-электронов l = 3, ml = -3; -2; -1; 0; +1;+2;+3.
Таблица 1.1 – Форма электронных облаков
-
Главное
квантовое
число (n)
Возможные
значения
орбитального
квантового
числа (l)
Форма
электронного
облака
Буквенное
обозначение
1
0

s
2
0
s
1

p
3
0
s
1
p
2


d
Таким образом, магнитное квантовое число ml может принимать (2l + 1) значений; столько же существует вариантов ориентации электронного облака относительно ядра атома. Например, три p-электронных облака с ml = -1; 0; +1 располагаются в пространстве перпендикулярно друг другу, как показано на рисунке 1.2.
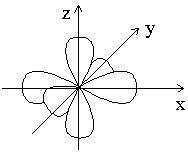
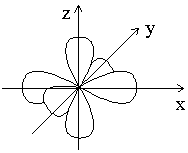
Рисунок
1.2 –
Расположение p-электронных
облаков в пространстве
