- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
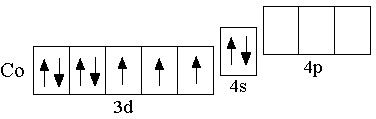
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
9.6 Элементы триады железа
9.6.1 Железо
Э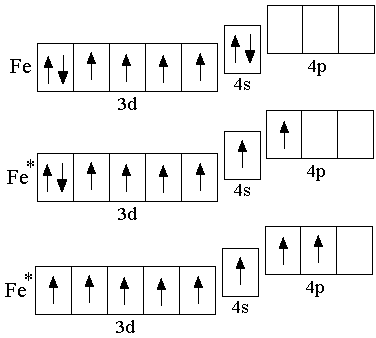 лектронная
конфигурация невозбуждённого атома
железа – 3d64s2;
возбуждённым состояниям атома железа
соответствуют электронные формулы
3d64s14p1,
3d54s14p2.
лектронная
конфигурация невозбуждённого атома
железа – 3d64s2;
возбуждённым состояниям атома железа
соответствуют электронные формулы
3d64s14p1,
3d54s14p2.
Для железа характерны два ряда соединений: соединения железа (II) и соединения железа (III). Кроме того, известны соли не выделенной в свободном состоянии железной кислоты H2FeO4 – ферраты, – в которых степень окисления железа равна +6. Соединения железа в теоретически возможной высшей степени окисления +8 не получены.
Железо – активный металл, находящийся в ряду напряжений до водорода.
Оксид железа (II) FeO и соответствующий ему гидроксид Fe(OH)2 обладают основными свойствами; оксид железа (III) Fe2O3 проявляет слабые амфотерные свойства: при растворении в кислотах образуются соли Fe3+, а при сплавлении со щелочами образуются соли железистой кислоты – метаферриты:
Fe2O3 + 6 HCl 2 FeCl3 + 3 H2O; Fe2O3 + 2 NaOH 2 NaFeO2 + H2O .
Таким образом, соответствующую Fe2O3 гидратную форму можно рассматривать и как основание Fe(OH)3, и как железистую кислоту (H3FeO3 – орто-форма, HFeO2 – мета-форма). Fe3O4 (или FeOFe2O3) – смешанный оксид железа (II, III); его следует рассматривать как соль железистой кислоты – метаферрит железа (II) Fe(FeO2)2 .
Оксид железа (VI), соответствующий железной кислоте H2FeO4, не получен, как и сама кислота. Соли железной кислоты – ферраты – получаются сплавлением оксида железа (III) с окислителем (нитрат калия) в присутствии щёлочи:
Fe2O3 + 4 KOH + 3 KNO3 2 K2FeO4 + 3 KNO2 + 2 H2O.
Соединения железа (II) проявляют восстановительные свойства и окисляются до соединений железа (III). Например, белый гидроксид железа (II) уже в момент осаждения из растворов принимает зеленоватую окраску вследствие частичного окисления кислородом воздуха; затем зелёный цвет изменяется на бурый в результате полного окисления Fe(OH)2 до Fe(OH)3:
4 Fe(OH)2 + O2 + 2 H2O 4 Fe(OH)3 .
Соли железа (II) при действии окислителей также легко превращаются в соли железа (III): 6 FeSO4 + 2 HNO3 + 3 H2SO4 3 Fe2(SO4)3 + 2 NO + 4 H2O .
Поэтому соли железа (II) получаются при растворении металлического железа в кислотах, не проявляющих сильных окислительных свойств: соляной и разбавленной серной. При растворении железа в азотной или концентрированной серной кислотах при обычных условиях или при нагревании образуются соли железа (III): 2 Fe + 6 H2SO4 Fe2(SO4)3 + 3 SO2 + 6 H2O;
Fe + 6 HNO3 Fe(NO3)3 + 3 NO2 + 3 H2O .
Ионы
Fe3+
проявляют заметные окислительные
свойства:
![]() =
+0,77 В.
=
+0,77 В.
Раствор
FeCl3
окисляет, например, иодид-ионы (![]() = + 0,55 В ):
= + 0,55 В ):
2 FeCl3 + 2 KI 2 FeCl2 + I2 + 2 KCl
и
металлическую медь (![]() = + 0,34 В ):
= + 0,34 В ):
2 FeCl3 + Cu 2 FeCl2 + CuCl2 .
Соединения
железа (VI) – ферраты – очень сильные
окислители (![]() >
+ 1,9 В); они восстанавливаются до
соединений железа (III): 2 K2FeO4
+ 16 HCl
2 FeCl3
+ 3 Cl2
+ 4 KCl
+ 8 H2O.
>
+ 1,9 В); они восстанавливаются до
соединений железа (III): 2 K2FeO4
+ 16 HCl
2 FeCl3
+ 3 Cl2
+ 4 KCl
+ 8 H2O.
И
+2
который легко растворяется в избытке раствора цианида калия вследствие образования комплексной соли – гексацианоферрата (II) калия («жёлтая кровяная соль»): Fe(CN)2 + 4 KCN K4[Fe(CN)6]
Fe(CN)2 + 4 CN– [Fe(CN)6]4– .
Гексацианоферрат (III) калия K3[Fe(CN)6] («красная кровяная соль») получается окислением гексацианоферрата (II) калия:
2 K4[Fe(CN)6] + Cl2 2 K3[Fe(CN)6] + 2 KCl .
Гексацианоферрат (III) калия не удаётся получить непосредственным взаимодействием соли железа (III) с цианидами из-за восстановления ионов Fe3+ цианид-ионами: 2 FeCl3 + 6 KCN 2 Fe(CN)2 + (CN)2 + 6 KCl.
Гексацианоферрат (II) калия K4[Fe(CN)6] является чувствительным реактивом на ионы Fe3+:
FeCl3 + K4[Fe(CN)6] KFe[Fe(CN)6] + 3 KCl;
+3
+2
Fe3+ + K+ + [Fe(CN)6]4– KFe[Fe(CN)6].
При этом образуется малорастворимый гексацианоферрат(II) калия-железа(III) интенсивно синего цвета. Это соединение часто называют «берлинской лазурью».
Гексацианоферрат (III) калия K3[Fe(CN)6] является реактивом на ионы Fe2+:
FeCl2 + K3[Fe(CN)6] KFe[Fe(CN)6] + 2 KCl;
Fe2+ + K+ + [Fe(CN)6]3– KFe[Fe(CN)6].
О
+3
+2
Результаты рентгеноструктурных исследований показывают, что турнбулева синь и берлинская лазурь имеют одну и ту же кристаллическую решётку, т.е. полностью идентичны и представляют собой одно и то же соединение.
При взаимодействии роданида калия (KSCN) или аммония (NH4SCN) с солями железа (III) образуется ряд комплексных частиц [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]–, [Fe(SCN)5]2–, [Fe(SCN)6]3–, придающих раствору кроваво-красную окраску: Fe3+ + 3 SCN– Fe(SCN)3;
FeCl3 + 3 KSCN Fe(SCN)3 + 3 KCl.
Эта реакция также является качественной реакцией на ионы Fe3+ и применяется в аналитической химии.