
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
5.2.6 «Царская водка»
Смесь, состоящая из одного объёма концентрированной азотной кислоты и трёх объёмов концентрированной соляной кислоты, называется «царской водкой». Она способна растворять металлы, не взаимодействующие с азотной кислотой, в том числе золото и платину.
Металлическое
золото не взаимодействует с азотной
кислотой, поскольку стандартный
электродный потенциал восстановительной
системы
![]() =
+1,51 В значительно превышает
потенциал окислительной
системы:
=
+1,51 В значительно превышает
потенциал окислительной
системы:
![]() =
+ 0,96 В (или
=
+ 0,96 В (или
![]() =
+ 0,80 В).
=
+ 0,80 В).
Однако, золото растворимо в «царской водке»
Au + HNO3 + 4 HCl H[AuCl4] + NO + 2 H2O
благодаря тому, что в качестве конечного продукта реакции образуется высокостабильный комплексный ион [AuCl4]–, и величина стандартного электродного потенциала восстановительной системы уменьшается:
система
восстановительная:
Au
+ 4 Cl–
[AuCl4]–
+ 3e–
![]() =
+0,99 В,
=
+0,99 В,
система
окислительная:
NO3–
+ 4H+
+3e–NO
+ 2H2O
![]() =
+0,96 В.
=
+0,96 В.
Величины электродных потенциалов, приведённые выше, относятся к стандартным условиям, в частности, к концентрациям 1 моль/л всех участвующих в реакции веществ. Расчёт по уравнению Нернста показывает, что в реальных условиях (смесь концентрированных HNO3 и HCl) потенциал окислительной системы превышает потенциал восстановительной, так что возможность протекания этой реакции согласуется с выводами теории электродных потенциалов.
Аналогично рассматривается вопрос о возможности растворения платины в азотной кислоте и «царской водке»:
![]() =
+ 1,19 В
= + 0,96 В,
=
+ 1,19 В
= + 0,96 В,
поэтому платина не реагирует с азотной кислотой. Образование же устойчивого комплекса [PtCl6]2– уменьшает величину потенциала восстановительной системы:
система
восстановительная:
Pt
+ 6 Cl–
[PtCl6]2–
+ 4e–
![]() =
+ 0,73 В;
=
+ 0,73 В;
система окислительная: NO3– +4H+ +3e–NO + 2H2O = +0,96 В.
Сравнение величин электродных потенциалов окислительной и восстановительной систем позволяет сделать вывод о возможности растворения платины в «царской водке»: 3 Pt + 4 HNO3 + 18 HCl 3 H2[PtCl6] + 4 NO + 8 H2O.
Таким образом, образование комплексов может привести к существенному изменению окислительно-восстановительных свойств ионов, что выражается в изменении величины окислительно-восстановительного потенциала. По этой причине золото, например, может также растворяться в растворах цианидов, окисляясь кислородом воздуха (см. раздел 9.2 «D-металлы I группы» лекции 9).
5.3 Фосфор
5.3.1 Свойства фосфора – простого вещества
При обычных условиях фосфор представляет собой твёрдое вещество. Вследствие лёгкой окисляемости фосфор не встречается в природе в свободном состоянии. Наиболее важным природным соединением фосфора является минерал фосфорит Ca3(PO4)2. Фосфор в свободном состоянии получают прокаливанием фосфорита с песком и углём в электрических печах без доступа воздуха с последующей конденсацией паров фосфора:
Ca3(PO4)2 + 3 SiO2 3 CaSiO3 + P2O5 P2O5 + 5 C 2 P + 5 CO.
Суммарное уравнение реакции: Ca3(PO4)2 + 3SiO2 + 5C 3CaSiO3 + 2P + 5CO .
Свободный фосфор непосредственно взаимодействует со многими веществами: с кислородом, галогенами, активными металлами; в последнем случае образуются фосфиды металлов, аналогичные нитридам:
3 Ca + 2 P Ca3P2 (фосфид кальция).
Для фосфора известны несколько аллотропных модификаций: белый, красный, черный фосфор и другие.
Б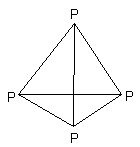 елый
фосфор получают быстрым охлаждением
паров фосфора; он представляет собой
белое воскообразное вещество, светящееся
в темноте вследствие окисления. Фосфор
малорастворим в воде; хорошо растворим
в сероуглероде. Белый фосфор чрезвычайно
химически активен, самовоспламеняется
на воздухе, вследствие чего его хранят
под слоем воды. Белый фосфор имеет
молекулярную кристаллическую
решётку, в узлах которой находятся
непрочные тетраэдрические молекулы
P4;
этим и объясняется его высокая химическая
активность. Белый фосфор – очень сильный
яд, даже малые дозы которого смертельны.
елый
фосфор получают быстрым охлаждением
паров фосфора; он представляет собой
белое воскообразное вещество, светящееся
в темноте вследствие окисления. Фосфор
малорастворим в воде; хорошо растворим
в сероуглероде. Белый фосфор чрезвычайно
химически активен, самовоспламеняется
на воздухе, вследствие чего его хранят
под слоем воды. Белый фосфор имеет
молекулярную кристаллическую
решётку, в узлах которой находятся
непрочные тетраэдрические молекулы
P4;
этим и объясняется его высокая химическая
активность. Белый фосфор – очень сильный
яд, даже малые дозы которого смертельны.
Красный фосфор образуется при нагревании белого фосфора без доступа воздуха. Красный фосфор не ядовит, не светится в темноте, воспламеняется только при температурах выше 260°C. Красный фосфор имеет полимерную структуру. При нагревании красный фосфор сублимируется, при охлаждении паров получается белый фосфор.
Чёрный фосфор образуется при нагревании белого фосфора без доступа воздуха при очень высоком давлении. Внешне чёрный фосфор похож на графит и обладает полупроводниковыми свойствами.
Биологическая роль фосфора: фосфор, как и азот, необходим для живых существ, поскольку он входит в состав белков крови, мозговой и нервной тканей.
5.3.2 Фосфорный ангидрид. Фосфорная и пирофосфорная кислоты
П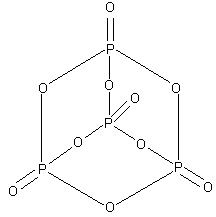 ри
сгорании фосфора в кислороде или на
воздухе образуется оксид фосфора (V) –
белое твёрдое вещество. Cостав молекул
оксида фосфора (V) отвечает формуле
P4O10,
а не простейшей брутто-формуле P2O5.
Оксид фосфора (V)
очень гигроскопичен и поэтому является
хорошим водоотнимающим средством.
Гидратация оксида фосфора (V) представляет
собой сложный процесс, промежуточными
продуктами которого являются полимерные
фосфорные кислоты. Конечный продукт
гидратации P2O5
– ортофосфорная кислота H3PO4
. Поэтому P2O5
(P4O10)
считают ангидридом фосфорной кислоты.
H3PO4
– слабая трёхосновная кислота:
ри
сгорании фосфора в кислороде или на
воздухе образуется оксид фосфора (V) –
белое твёрдое вещество. Cостав молекул
оксида фосфора (V) отвечает формуле
P4O10,
а не простейшей брутто-формуле P2O5.
Оксид фосфора (V)
очень гигроскопичен и поэтому является
хорошим водоотнимающим средством.
Гидратация оксида фосфора (V) представляет
собой сложный процесс, промежуточными
продуктами которого являются полимерные
фосфорные кислоты. Конечный продукт
гидратации P2O5
– ортофосфорная кислота H3PO4
. Поэтому P2O5
(P4O10)
считают ангидридом фосфорной кислоты.
H3PO4
– слабая трёхосновная кислота:
K1 = 7,510–3 ; K2 = 6,210–8 ; K3 = 1,210–13 .
К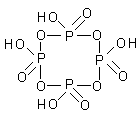 роме
орто-формы для фосфорной кислоты
характерна также и мета-форма (HPO3)x.
Метафосфорные кислоты (HPO3)x
, например, (HPO3)4,
имеют циклическое строение. Часто при
обсуждении состава метафосфорных
кислот записывают простейшую формулу
HPO3.
роме
орто-формы для фосфорной кислоты
характерна также и мета-форма (HPO3)x.
Метафосфорные кислоты (HPO3)x
, например, (HPO3)4,
имеют циклическое строение. Часто при
обсуждении состава метафосфорных
кислот записывают простейшую формулу
HPO3.
H3PO4 и (HPO3)x – кристаллические вещества.
И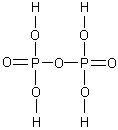 з
полифосфорных кислот в кристаллическом
состоянии выделена только простейшая
дифосфорная (пирофосфорная) кислота –
H4P2O7;
её соли называются дифосфатами или
пирофосфатами.
з
полифосфорных кислот в кристаллическом
состоянии выделена только простейшая
дифосфорная (пирофосфорная) кислота –
H4P2O7;
её соли называются дифосфатами или
пирофосфатами.
Несмотря на высшую степень окисления фосфора, ни сама фосфорная кислота, ни её соли – фосфаты – в растворах не проявляют окислительных свойств, что связано с высокой устойчивостью соединений фосфора в степени окисления +5.
В лабораторных условиях ортофосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой.
Существуют два промышленных способа получения H3PO4: экстракционный и термический. Экстракционный метод заключается в обработке природных фосфатов серной кислотой с последующим отделением сульфата кальция и концентрированием фосфорной кислоты:
Ca3(PO4)3 + 3 H2SO4 3 CaSO4 + 2 H3PO4 .
При получении фосфорной кислоты термическим методом проводится восстановление фосфатов до чистого фосфора (см. раздел 5.3.1 «Свойства фосфора – простого вещества» данной лекции), сжигание фосфора и последующая гидратация фосфорного ангидрида.
Соли фосфорной кислоты применяются в сельском хозяйстве в качестве минеральных удобрений.
5.3.3 Фосфористый ангидрид. Фосфористая и фосфорноватистая кислоты
П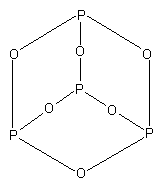
 ри
неполном окислении фосфора кислородом
(например, при недостатке кислорода)
образуется смесь оксидов фосфора (III)
и фосфора (V).
Оксид фосфора (III)
состоит из молекул P4O6.
Формула P2O3
является простейшей. P2O3
(P4O6)
– это ангидрид фосфористой кислоты
H3PO3.
ри
неполном окислении фосфора кислородом
(например, при недостатке кислорода)
образуется смесь оксидов фосфора (III)
и фосфора (V).
Оксид фосфора (III)
состоит из молекул P4O6.
Формула P2O3
является простейшей. P2O3
(P4O6)
– это ангидрид фосфористой кислоты
H3PO3.
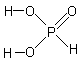
Фосфористая кислота двухосновна; по силе H3PO3 сравнима с фосфорной кислотой: K1 = 110–2 , K2 = 310–7 .
Фосфористая
кислота и её соли фосфиты проявляют
сильные восстановительные свойства
(![]() =
– 0,28 В) и
окисляются до соединений фосфора в
степени окисления +5:
=
– 0,28 В) и
окисляются до соединений фосфора в
степени окисления +5:
H3PO3 + H2O2 H3PO4 + H2O; H3PO3 + I2 + H2O H3PO4 + 2 HI .
Фосфорноватистая
кислота H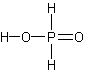 3PO2
– одноосновная кислота, гораздо более
сильная, чем H3PO4
(KH3PO2
= 910–2).
Фосфорноватистая кислота и её соли
гипофосфиты, также как и соединения
фосфора +3, – сильные восстановители:
3PO2
– одноосновная кислота, гораздо более
сильная, чем H3PO4
(KH3PO2
= 910–2).
Фосфорноватистая кислота и её соли
гипофосфиты, также как и соединения
фосфора +3, – сильные восстановители:
![]() = – 0,39 В.
Они способны восстанавливать ионы
металлов, например, Ni2+,
Hg2+,
до свободных металлов, окисляясь при
этом до фосфорной кислоты или фосфатов.
= – 0,39 В.
Они способны восстанавливать ионы
металлов, например, Ni2+,
Hg2+,
до свободных металлов, окисляясь при
этом до фосфорной кислоты или фосфатов.
2 NiSO4 + H3PO2 + 2 H2O 2 Ni + H3PO4 + 2 H2SO4 ;
2 HgCl2 + H3PO2 + 2 H2O 2 Hg + H3PO4 + 4 HCl .
Соединения фосфора +1 и +3 при нагревании диспропорционируют:
3 H3PO2 2 H3PO3 + PH3; 4 H3PO3 3 H3PO4 + PH3 .
