
- •Термогравиметрия
- •1. Введение
- •2. Краткая история термического анализа
- •3. Получение и запись кривых нагревания
- •3. 1. Температурные кривые нагревания (т)
- •3. 2. Дифференциальные кривые нагревания (дта)
- •3. 3. Геометрические элементы дта кривой
- •4. Получение термогравиметрических кривых (тг)
- •4. 1. Термогравиметрическая кривая (тг)
- •4. 2. Геометрические элементы тг кривой
- •4.3. Дифференциальная термогравиметрическая (дтг) кривая
- •5. Основы количественного метода дта
- •5. 1. Количественные расчеты тепловых эффектов в методе дта, основанные на модели гомогенного распределения температур в образце (метод Шпейля)
- •5. 2. Количественные расчеты тепловых эффектов в методе дта, основанные на уравнениях теплопроводности и температурного градиента в образце
- •5. 3. Количественные расчеты тепловых эффектов в методе дта, основанные на определении постоянной времени и термического сопротивления
- •Измерение величины тепловых эффектов по кривым дта
- •6. 1. Методы измерения площадей
- •6. 2. Определение калибровочного коэффициента k
- •6. 2. 1. Определение k по энтальпиям плавления веществ
- •6. 2. 2. Электрическая калибровка приборов по эффекту Джоуля
- •6. 2. 3. Определение рабочей чувствительности приборов дта
- •6. 2. 4. Определение величины термических эффектов методом дта
- •7. Обзор методов термического анализа
- •7. 1. Термогравиметрия (тг)
- •7. 1. 1. Применения тг
- •7. 2. Дифференциальный термический анализ (дта) и дифференциальная сканирующая калориметрия (дск)
- •7. 2. 1. Дифференциальный термический анализ (дта)
- •7. 2. 2. Дифференциальная сканирующая калориметрия (дск)
- •7. 2. 3. Градуировка и интерпретация кривых дта и дск
- •7. 2. 4. Применения дта и дск
- •Определение степени чистоты вещества
- •Другие применения
- •7. 3. Комбинированные методы
- •7. 3. 1. Комбинация методов, осуществляемых одновременно
- •7. 3. 2. Пример использования комбинированного анализа
- •7. 3. 3. Дериватография
- •Обработка дериватограммы
- •Определение кристаллизационной воды в кристаллогидрате ВаСl2∙2н2о Вычисление процентного состава кристаллогидрата
- •Определение реакционной способности вещества (энергии активации)
- •Метод Пилояна
- •7. 4. Другие термоаналитические методы
- •7. 4. 1. Термомеханические методы
- •Термодилатометрия
- •Термомеханический анализ (тма) и динамический механический анализ (дма)
- •Высокотемпературная рентгеновская дифракция (рд)
- •Контрольные вопросы
- •Заключение
- •Список рекомендуемой литературы
- •Термогравиметрия
- •614990, Пермь, ул. Букирева, 15
- •614990, Пермь, ул. Букирева, 15
5. Основы количественного метода дта
На основании температурных и ДТА кривых можно определить две величины: температуру (t) теплового эффекта и его величину (в Дж). Т. о. образом метод ДТА позволяет получить термометрические и калориметрические характеристики вещества. Термометрическое направление связано с определением температур превращений (плавления (затвердевания), фазовых переходов, разложения и др.) вещества, а калориметрическое – с количественным определением величин тепловых эффектов.
Калориметрические расчеты в методе ДТА сначала применялись для определения энтальпии плавления металлов, солей и органических соединений. В настоящее время существует ряд теорий количественной оценки величин тепловых эффектов по площади пиков на ДТА кривых.
5. 1. Количественные расчеты тепловых эффектов в методе дта, основанные на модели гомогенного распределения температур в образце (метод Шпейля)
Для печей с идеальным гомогенным распределением температур в тепловом (обогреваемом) пространстве разными авторами были разработаны математические модели, находящиеся в основе рабочих формул для количественных расчетов в методе ДТА.
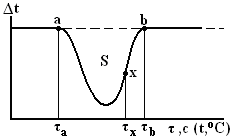
Рис. 5. 1. Вычисление площади кривой ДТА по Шпейлю
Как видно на рис. 5. 1, в отсутствие термического эффекта в образце линия идеальной кривой ДТА совпадает с нулевой линией, т.е. точки а и b находятся на одном уровне. Отклонение ДТА кривой от нулевой линии вызвано только эндотермическим тепловым эффектом в результате реакции, протекающей в образце при его нагревании, а величина площади под кривой ДТА зависит главным образом от разности температур между образцом и инертным веществом (эталоном), которая возникает в результате термической реакции. Хотя площадь пика ДТА кривой и обусловлена главным образом разностью температур между образцом и эталоном, на внешнюю форму ДТА кривой большое влияние оказывают различные экспериментальные факторы, искажающие теплопередачу от нагревателя печи к образцу и эталону.
Впервые Шпейль с соавторами (1945г.) показали, что площадь пика (S) ДТА кривой связана с определенными параметрами согласно уравнению
![]() ,
,
где m – масса образца (г); ΔН – теплота реакции (Дж); λ – коэффициент теплопроводности (Дж/град∙с); g – коэффициент, учитывающий геометрическую форму тигля (см). Во время нагрева и протекания эндотермической реакции в образце в точке x уравнение теплового баланса, начиная с точки а, будет иметь следующий вид:
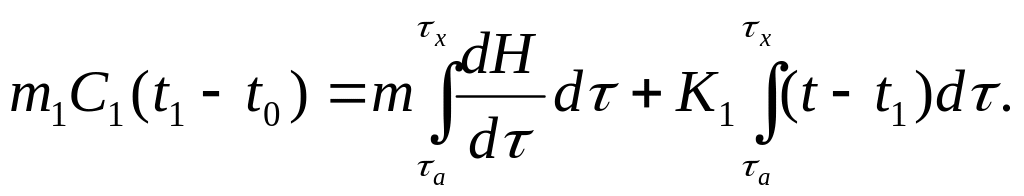 (5.1)
(5.1)
Это означает, что изменение энтальпии образца равно количеству тепла, поглощенного (выделенного) за время dτ, плюс количество тепла, полученного образцом от стенок печи за тоже время (dτ).
Для инертного вещества (эталона) уравнение теплового баланса имеет вид
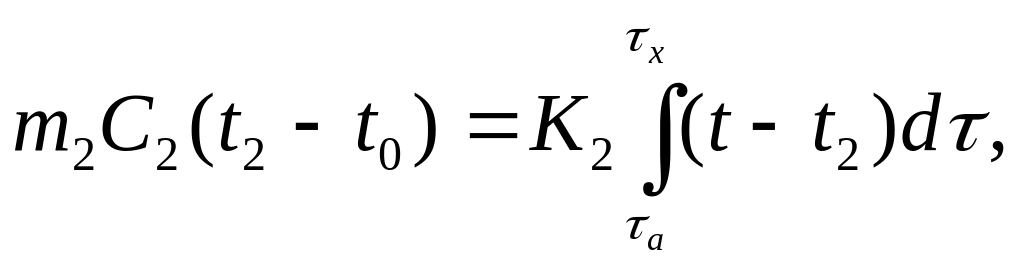 (5.2)
(5.2)
где m – масса реагирующего вещества в образце; m1 – общая масса образца; m2 - общая масса эталона; K1 и K2 – коэффициенты теплообмена для образца и инертного вещества (эталона); t – температура печи для времени τ = τx; t1 и t2 - температуры образца и эталона для времени τ = τx; t0 - температура образца и для времени τ = τа; С1 и С2 - средние теплоемкости образца и эталона между τа и τx.
Кривая ДТА снимается таким образом, чтобы образец и эталон имели одну и ту же массу и одинаковые теплоемкости. Тогда можно записать m1C1 = m2C2. Образец и эталон в порошкообразном состоянии должны помещаться в тигли одинаковой геометрической формы и размера. При этом допускается, что K1 = K2.
В практике термического анализа используют тигли, у которых соотношение между радиусом и высотой H ≥ 4R, т. е. высота тигля должна быть достаточно большой по сравнению с радиусом.
Вычитание уравнения (5.1) из (5.2) дает
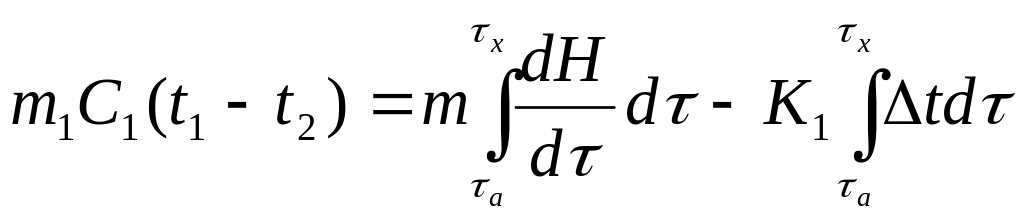 ,
,
где Δt = t1 – t2.
Интегрируя от а до b полученное уравнение при t1 – t2 = 0, получаем
 ,
(5.3)
,
(5.3)
где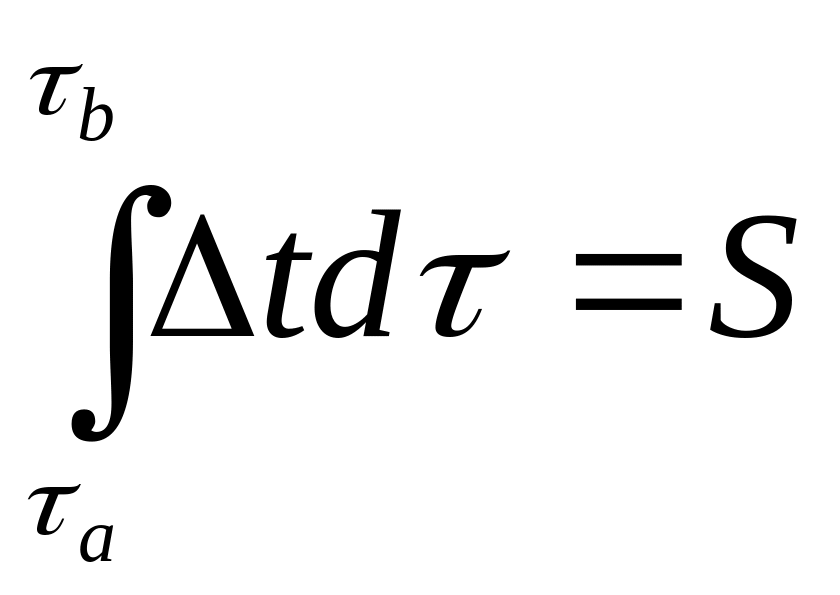 –
площадь пика (град∙с) ДТА кривой,
соответствующая термическому эффекту.
Величина K
– коэффициент теплообмена, который
можно представить как K
= λg,
где λ
– коэффициент теплопроводности образца
(Дж/град∙с); g
– коэффициент геометрической формы
тигля (см).
–
площадь пика (град∙с) ДТА кривой,
соответствующая термическому эффекту.
Величина K
– коэффициент теплообмена, который
можно представить как K
= λg,
где λ
– коэффициент теплопроводности образца
(Дж/град∙с); g
– коэффициент геометрической формы
тигля (см).
Уравнение (5.3) используется для расчета величины теплового эффекта в различных методах ДТА. Оно показывает, что площадь пика на кривой ДТА (S) пропорциональна массе термоактивного вещества (m) с определенным значением поглощенной (выделенной) теплоты (ΔН) при определенной форме и размере тигля. Эта пропорциональность будет нарушаться, если теплопроводность (λ) будет меняться при нагревании вещества или от опыта к опыту, т. е. если K не будет постоянной величиной. На практике коэффициент K определяется экспериментальным путем для конкретной термической установки путем построения калибровочного графика зависимости K от t.
При выводе уравнения (5.3) были приняты следующие допущения:
– одинаковая температура пространства вокруг образца и эталона (что реализуется не во всех установках);
– равенство коэффициентов теплообмена образца и эталона (K1 = K2). Этого удается достичь использованием одинаковых тиглей и подбором эталона с теплоемкостью близкой к теплоемкости образца (С1 ≈ С2).
Как видно из рис. 5. 1, а и b – точки начала и конца термического эффекта, находятся на нулевой линии, т. е. на одной линии, что в практике анализа встречается редко. В данном случае совпадение базовой линии с нулевой объясняется именно тем, что Шпейль, для проверки своего уравнения, подобрал для образца и эталона вещества с одинаковыми теплоемкостями (С1 = С2). Кроме того Шпейль не принимал во внимание скорость нагревания печи.
М. Волд (1949 г.) показала, что скорость нагревания влияет на отклонение базовой линии кривой ДТА от нулевой. Т. е., чтобы добиться параллельного воспроизводимого отклонения базовой линии от нулевой, от опыта к опыту необходимо задавать одну и ту же скорость нагревания печи. На основании своих расчетов М. Волд вывела уравнение
mΔH = K∙S,
т. е. уравнение Шпейля.
В своих расчетах Волд считала температуру одинаковой во всей массе образца и не учитывала возникновения там перепадов температуры во время термического эффекта. Также она делала допущение, что теплоемкости образца и эталона не меняются во время нагревания и остаются постоянными до и после термического эффекта.
В действительности теплоемкость вещества меняется с температурой, и базовая линия кривой ДТА после химической реакции или фазового превращения может находиться совсем на другом, отличном от исходного уровне.
Волд впервые обнаружила, что процесс плавления оканчивается в вершине ДТА кривой, поэтому всему тепловому эффекту плавления будет пропорциональна только площадь, заключенная между нисходящей кривой ДТА и перпендикуляром из точки экстремума пика на нулевую линию. При этом эксперимент должен быть поставлен таким образом, чтобы восходящая ветвь кривой ДТА выходила точно на базовую линию. Это обстоятельство в последствии было подтверждено.
