
- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Характеристики амінів

Нижче розглядатимуться первинні аміни, в яких міститься функціональна аміногрупа –NH2.
Фізичні властивості. Серед амінів є гази, рідини, тверді речовини. Нижчі аміни мають запах амоніаку, розчинні у воді.
Хімічні властивості. Аміни згоряють, утворюючи вуглекислий газ, воду та азот. Аміни, як і амоніак, виявляють основні властивості. Проте вони сильніші основи, ніж амоніак, оскільки під впливом вуглеводневих радикалів на атомі Нітрогену зростає електронна густина і він міцніше утримує протони:
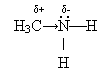
Як і амоніак, аміни діють на індикатори, виявляючи лужні властивості. Реагують з кислотами з утворенням солей.

Анілін.
У разі, коли аміногрупа сполучена з бензеновим ядром, утворюється ароматичний амін – анілін:

|
Анілін – безбарвна оліїста речовина, мало розчинна у воді. |
За хімічними властивостями анілін дещо відмінний від насичених амінів. Він не змінює забарвлення індикаторів, реагує лише з сильними кислотами:
C6H5-NH2 + HCl → [C6H5NH3]+Cl-
Феніламонійхлорид
Отже, анілін – слабшаосновапорівнянозамоніаком. Це зумовлено впливом бензенового ядра на аміногрупу. Остання, у свою чергу, впливає на бензенове ядро. Зокрема, на бензен не діє бромна вода, а анілін реагує з бромом, утворюючи трибромопохідну сполуку:

Анілін має велике промислове значення, він є сировиною для виробництва барвників, лікарських засобів, пластмас, вибухових речовин тощо.
Основний спосіб добування аніліну – відновлення нітробензену воднем за температури 250—350оС та наявності каталізатора:

Відновлення нітробензену до аніліну відоме в історії хімії як реакція М.М.Зініна (1842 р.).
Амінокислоти
Склад і будова молекул.
Молекули амінокислот містятьдві функціональнігрупи: карбоксильну тааміногрупу. Існуютьамінокислоти, щомістятьдвікарбоксильніабодвіаміногрупи, гідроксильнігрупи, сульфуровміснігрупи. Приклади амінокислот

Фізичні властивості. Амінокислоти – кристалічні речовини, мають високі температури плавлення, розчиняються у воді. Цим властивостям відповідає структура біполярного йона:

Хімічні властивості.
Реакції амінокислот

|
|
Амінокислоти – амфотерні сполуки, оскільки взаємодіють з кислотами й основами.
Найважливіша особливість амінокислот – здатність молекул взаємодіяти між собою з утворенням поліпептидів:

Зв'язок між залишками амінокислот називають пептидним, а групу
|
Поліпептидний ланцюг є основою будови молекул білків.
Застосування.
-у тваринництві(підгодівля тварин)
-в медицині(як зміцнювальний та лікувальний засіб)
-виробництвосинтетичних волокон
Білки
Будова білків. Кожен білок має набір амінокислот, сполучених у певній, властивій тільки йому послідовності. Кількість сполучених у різній послідовності амінокислотних залишків сягає 1018.
Будова білків дуже складна і зумовлюється не лише послідовністю амінокислотних залишків. Довгі ланцюги білкових молекул скручуються у спіралі, спіралі – у клубки, що певним чином розміщуються у просторі. Розрізняють первинну, вторинну, третинну й четвертинну (для деяких білків) структуру.
|

Структура білка:
а,б,в - відповідно первинна, вторинна, третинна структури міоглобіну
(цифри - число амінокислотних залишків у молекулі);
г - четвертинна структура гемоглобіну
Властивості білків. Білки дуже різняться між собою за властивостями, оскільки містять залишки амінокислот з різними функціональними групами,здатними вступати в характерні для них реакції.
1. Денатурація. У результаті нагрівання білка відбувається його денатурація (втрата природних якостей). При цьому руйнується складна структура білка, що призводить до втрати ним біологічної активності. Це необоротний процес, він відбувається, наприклад, під час кулінарної обробки м'яса, риби, яєць.
2. Гідроліз. Під дією кислот, лугів, ферментів відбувається розщеплення полімерної білкової молекули на амінокислоти. Молекули води приєднуються за місцем пептидних зв'язків, останні руйнуються, замість пептидних груп утворюються аміно- й карбоксильні групи.

3. Розкладання. Під дією мікроорганізмів білки розкладаються з утворенням амоніаку, сірководню, фенолу, інших речовин з неприємним запахом. Його поява засвідчує, що відбувається процес розкладання (гниття) білка.
4. Кольорові реакції. Для аналітичного виявлення використовують кольорові реакції білків. Поява жовтого забарвлення в результаті реакції з концентрованою нітратною кислотою засвідчує наявність бензенових ядер у структурі білка. Червоно-фіолетове забарвлення білка в результаті дії купрум(ІІ) гідроксиду засвідчує наявність пептидних зв'язків.
Біологічне значення амінокислот і білків. Білки є основним будівельним матеріалом тваринних організмів, а саме їх клітин. Білки їжі безпосередньо не засвоюються організмом, спершу вони гідролізують до амінокислот, останні всмоктуються у кров, нею переносяться до печінки, де організм синтезує білки, властиві саме йому.
Для нормального функціонування організм мусить постійно поповнювати запас амінокислот переважно за рахунок білків їжі.
*Складіть структурні формули та дайте назву двом гомологам та двом ізомерам 2,2 диамінобутанової кислоти. * Напишіть рівняння реакцій за схемою: метан → карбон(ІІ)оксид → метанол → хлорометан → етан → етилен → етиленгліколь. *Як із етану добути пропіловий естер амінооцтової кислоти? *Яку масу аніліна можна отримати із 468 г бензена, якщо втрати на кожному етапі складають 10 %?

