
- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Сполуки неметалічних елементів ізГідрогеном
Сполуки неметалічних елементів ізГідрогеном складаються змолекул .
Атоми в них сполучені ковалентними зв’язками.
Фізичні властивості. Більшість сполук неметалічних елементів із Гідрогеном за звичайних умов є газами, а гідроген фторид HF(за температури нижче 19,5 °С) і вода — рідинами. Усі ці сполуки безбарвні; чимало їхможна виявити за характерним запахом —неприємним, іноді різким.Температури плавлення і кипіння сполукіз Гідрогеном неметалічних елементів кожної групи періодичної системи зростають зізбільшенням відносних молекулярних мас1.
Проте сполуки елементів 2_го періоду вода, амоніак і фтороводень — «випадають»із цієї залежності . Аномально високі температури їх плавлення і кипіння зумовлені існуванням водневих зв’язків між молекулами .
Вам відома аналогічна залежність для алканів СnH2n+2.
Найбільшу розчинність у воді мають сполуки галогенів із Гідрогеном та амоніак.
Метан дуже слабо розчиняється у воді через неполярність молекул СН4, неможливість утворення ними водневих зв’язків і нездатність до дисоціації.
Розчини сполук галогенів із Гідрогеном іСульфуру з Гідрогеном у воді виявляють властивості кислот. Досить полярні зв’язки Н–Езумовлюють дисоціацію молекул цих сполуку водному розчині з утворенням катіонів
Гідрогену:
HCl↔H+ + Cl–;
H2S↔H+ + HS–;
HS–↔H+ + S2–.
Водні розчини HCl, HBr і HI поводяться як сильні однооснoвні кислоти, HF — як кислота середньої сили, а H2S — як слабка двохоснoвна кислота.
Хлороводень і хлороводнева кислота
Фізичні властивості.
Хлороводень — безбарвний газ із різким запахом, важчий за повітря, добре розчиннийу воді. За температури 20 °С і нормального тиску в 1 л води розчиняється 445 л цього газу. У вологому повітрі гідроген хлорид
«димить» унаслідок утворення дрібних краплинок його водного розчину.
Хлороводень сильно подразнює дихальні шляхи. Тому досліди із цим газом та його концентрованим водним розчином (концентрованою хлоридною кислотою) проводять у витяжній шафі.
Хлоридна кислота
Водний розчин гідрогенхлориду називають хлоридною кислотою.Тривіальна назва цього розчину — соляна кислота. Вона зумовлена тим, що раніше длядобування кислоти використовували природну сіль (натрій хлорид).
Майже насичений водний розчин гідроген хлориду (масова частка HCl у
ньому становить 34—36 %) називають концентрованою хлоридною кислотою.
Із цього розчину постійно виділяється хлороводень.
Хлоридна кислота належить до сильних кислот; ступінь її дисоціації в розбавлених розчинах перевищує 90 %.
Хімічні властивості.
1)Хлороводень безпосередньо взаємодіє з амоніаком, лугами, органічними речовинами тощо:
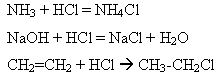
У лабораторній практиці здебільшого використовують не газуватий хлороводень, а його водний розчин – хлоридну кислоту, вона є сильною кислотою:
2)у водному розчині хлоридна кислота майже повністю дисоціює на йони:
*Поясніть, чому і як молекула HCl розпадається на йони у водному розчині.
HCl ↔ H++Cl-
3)взаємодіє з металами, які стоять в ряду активності (ряд стандартних електродних потенціалів) перед воднем:

4)взаємодіє з основними та амфотерними оксидами:
![]()
5)взаємодіє з основами та амфотерними гідроксидами:
NaOH + HCl = NaCl + H2O
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
6)взаємодіє з солями:
![]()
Унаслідок взаємодії хлоридної кислоти та її солей з розчином арґентум нітрату утворюється білий сирнистий осад аргентум хлориду, нерозчинний у нітратній кислоті:

Арґентум нітрат AgNO3 – реактив на хлоридну кислоту та її солі
*Для трьох останніх реакцій складіть йонно-молекулярні рівняння.
Добування гідроген хлориду і хлоридної кислоти.
-У промисловості гідрогенхлорид добувають спалюванням водню в атмосфері хлору
t H2 + Cl2 = 2HCl,
- в лабораторії — за реакцією обмінуміж твердою сіллю (натрій хлоридом) іконцентрованою сульфатною кислотою:
2NaCl (тв.) + H2SO4 (конц.) = 2HCl↑ + Na2SO4
Таким способом раніше добували хлороводень і в промисловості.
*Зазначити метали, з якими реагуватиме хлоридна кислота: Na, Ba, Ag, K, Ca, Ni, Mg, Al, Zn, Pb, Cr, Cu.
Застосування :
Виробництво соди, натрій гідроксиду, хлору, натрію
Кулінарія, консервування .
Харчова промисловість
У суміші з піском для розтоплення льоду на дорогах
Осушувач газів, органічних розчинників
Виробництво кальцію
Компонент охолоджувальних сумішей
Лікарський засіб при алергії, кровотечі
Виробництво калій гідроксиду
Мінеральне добриво
*Який заряд (ступінь окиснення) за величиною та за знаком має хлор в наступних сполуках: HCl, HClO, Cl2O7, HСlO4, Ca(OCl)2?
*Дано: хлоридну к-ту, калій оксид, цинк, воду, аргентум оксид. Як з них та продуктів їх реакцій добути дві складні та дві прості речовини ? Складіть рівняння реакцій, назвіть їх продукти, зазначте типи реакцій. Здійсніть класифікацію реагентів та продуктів реакцій.
