
FcεRI перемещаются в специфические рафты. Объединение этих рафтов индуцируется поливалентным антигеном, который, взаимодействуя с FcεRI и Lyn, запускает, таким образом, процесс передачи сигнала: ко-компартментацию FcεRI-рецепторов с рафтсвязанной Lyn-тирозинкиназой, обеспечивая пространственное сближение, необходимое для фосфорилирования FcεRI с образованием активированного мотива (ITAM). Этот мотив, в свою очередь, запускает сигнальный каскад, который приводит к высвобождению медиаторов аллергического ответа. Таким образом, авторы предполагают, что некоторые компоненты, участвующие в передаче сигнала, могут быть предварительно, до начала процесса, "собраны" в липидных рафтах мембран покоящихся клеток, способствуя, тем самым, быстрой и эффективной их активации на начальном этапе сигналинга.
Предполагается также участие рафтовых микродоменов мембран не только в сигналинге, направленном внутрь клетки, но и в сигналинге из клетки наружу, координирующем формирование наружного контакта между клеткой и клеточным матриксом, в котором участвует семейство белков, называемых интегринами. Считают, что интегрин-лигандные взаимодействия регулируются сигнальными молекулами (в основном киназами cемейства Src , ФИ-3-киназой, протеинкиназой С и связанными с ГТФазой пептидами Rho-семейства).
Липидные рафты способствуют образованию кластеров некоторых контактных белков и создают в мембране специализированные белок-липидные комплексы; с рафтами
связана кластеризация рецепторов адгезии. В процессах движения клеток рафты нужны для пространственной локализации псевдоподий в участке мембраны, соответствующем направлению клеточной миграции, что определяет эффективность миграции [156]. Вопросы о том, участвуют ли рафты в образовании ассоциатов (ансамблей, комплексов) на поверхности мембраны, необходимых для обеспечения межклеточного контакта, являются предметом специальных исследований [156 - 159].
Âцелом, рафты можно назвать сортирующей молекулы "машиной" или "платформой", способной координировать пространственно-временную организацию путей трансдукции сигнала внутри селективных областей ("сигналосомах") плазматической мембраны.
Âряде работ, опубликованных в последние годы, было показано, что липидные рафты могут использоваться широким диапазоном патогенов, включая вирусы, паразиты, бактерии и их токсины, для проникновения в клетку [160 - 161]. В этот процесс
61
могут быть вовлечены в качестве основных или вспомогательных рецепторов как расположенные на поверхности мембран клеток GPI-заякоренные белки, так и рафтовые липиды. Например, холерный токсин связывается с ганглиозидом GM1 [160], токсин Shiga - с нейтральным гликолипидом Gb3 [161], микобактерии - с холестерином, а E.coli через адгезин FimH присоединяется к GPIзаякоренному белку CD48 [162 - 164].
Большой интерес вызывает взаимодействие токсинов столбняка и ботулизма с нервной клеткой. Эти нейротоксины присоединяются к некоторым ди- и три-сиалоганглиозидам (в основном GD1a, GD1b и GT1b) на поверхности пресинаптической мембраны [121]. Однако при высоких уровнях токсичности, достигаемых субпикомолярными концентрациями токсинов, аффинность последних к этим ганглиозидам оказалась неожиданно низкой. Для объяснения этого парадокса Montecucco [165] предложил модель "двойного рецептора". Согласно этой модели, отрицательно заряженная поверхность пресинаптической мембраны содержит высокие концентрации ганглиозидных рецепторов, к которым токсин присоединяется через низкоаффинное взаимодействие.
Эту модель убедительно подтверждает идентификация белка 58 кДа, который связывает нейротоксины ботулизма и столбняка только в присутствии GT1b или GD1a [166]. В предложенной схеме требует доказательств предположение, что присоединение к ганглиозидам индуцирует такие конформационные изменения структуры токсина, которые увеличивают его аффинность к
белковому рецептору. Эта модель особенно интересна тем, что иллюстрирует разнообразные свойства липидных рафтов по отношению к различным патогенам и токсинам: (1) рафты обеспечивают окружение патогенов и токсинов большим количеством низко-аффинных рецепторов, которые стабилизируют "захват" на поверхности клетки; (2) рафты способны перемещать патогены и токсины к соответствующим высокоаффинным рецепторам, и (3) специфические липиды в рафтах могут действовать как шапероны, индуцируя конформационные изменения в структуре белков патогенов и токсинов, когда они сближены с высоко-аффинными рецепторами. Недавно было показано [167], что эта модель согласуется с реакцией слияния, описанной для процесса инфицирования клеток вирусом иммунодефицита человека 1 (ВИЧ-1).
В большинстве случаев, компоненты рафтов, узнаваемые токсинами, это рафтовые липиды - холестерин и/или сфингомиелин. В случае токсина Shiga, гликолипидный рецептор
62
(Gb3) является основным не только для обеспечения сайта связывания на поверхности клетки, но также для транспортировки токсина в ЭР [168, 169]. Интересно, что некоторые патогены и их токсины используют обычные функции липидных рафтов (например, внутриклеточный транспорт) для проникновения внутрь клетки [170].
В последние годы появилось много обзоров, посвященных изучению механизмов инфицирования клетки вирусами ВИЧ-1. В них показана важнейшая роль липидных рафтов в процессе слияния вируса ВИЧ-1 с клеткой и в дальнейшем развитии болезни [171 - 177]. Установлено, что в слизистой кишечника липидные рафты вовлечены в перенос ВИЧ-1 вириона через интактную эпителиальную клетку и в патогенез ВИЧ-1 энтеропатии.
Показана роль липидных рафтов в конверсии прионовых белков, и развитии болезни Альцгеймера [178 - 180].
Установление механизмов связывания рафтовыми липидами некоторых экзогенных белков и их транслокации в специфические сайты на поверхности плазматической мембраны, а также механизмов инициации необходимых конформационных изменений в перемещенных белках открывает новые области в молекулярной медицине [100]. Например, уже сегодня разработаны новые синтетические растворимые аналоги галактозилцерамида (GalCer), которые связываются с V3-петлей gp120 (белка вируса ВИЧ-1) и ингибируют слияние вируса с клеткой [181, 182]. Для антиадгезивной терапии вирусных и бактериальных токсинов разработаны и в настоящее время
испытываются моно- и поливалентные производные олигосахаридов (гликодендримеры) [183, 184].
Перспективным направлением в терапии прионовых, Альцгеймера и других заболеваний, вызванных дефектным фолдингом белков, является разработка пептидов, способных разрушить β-структуру в молекуле специфических белков, которые в процессе инфицирования присоединяются к прионовым (PrP) и амилоидным пептидам, тем самым стабилизируя их естественную конформацию [185, 186]. Экспериментально было показано, что снижающие холестерин агенты (статины), снижают у человека вероятность заболевания болезнью Альцгеймера [187]. У животных лечение статинами также снижает уровнь β-амилоидного пептида, что соответствует ключевой роли ХС в образовании амилоидных бляшек. Признание участия липидных рафтов в различных инфекционных и неинфекционных патологиях, без сомнения, откроет в ближайшем будущем новые возможности как для дальнейших фундаментальных исследований, так и для разработки
63
новых терапевтических средств.
2.6. Состав и молекулярная организация фосфолипидов в липопротеинах крови.
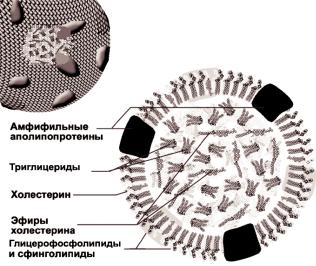
Липопротеины плазмы крови подразделяют на три основных класса - высокой (ЛВП), низкой (ЛНП) и очень низкой плотности (ЛОНП). Несмотря на различия в размере, содержании липидов, наличии определенных белков (апопротеинов) и метаболическом поведении, все три класса липопротеинов построены по общему принципу. Они представляют собой глобулы (мицеллы) нейтральных липидов - триглицеридов и эфиров ХС - покрытые мономолекулярным слоем фосфолипидов с белковыми включениями (рис. 2.6.1).
Строение и функции липопротеинов и их апопротеинов
Рис.2.6.1. Строение липопротеинов
подробно описаны во многих обзорах [188 - 192]. В основе функции ФЛ в липопротеинах крови лежит тот же принцип строения фосфолипидов, что и в биомембранах - их амфифильность. При этом ФЛ в липопротеинах также играют роль пограничного слоя между водной средой плазмы крови и гидрофобной глобулой нейтральных липидов. Такое назначение липопротеиновых фосфолипидов и обуславливает характер их организации в виде ориентированного к наружной водной фазе поверхностного монослоя полярных "головок" и устремленных к центру
64
жирнокислотных цепей.
Принцип молекулярной организации этого монослоя сходен с таковым для наружного слоя плазматических мембран клеток: расположение белков мозаично, и степень погруженности белковых молекул в липиды зависит от их гидрофобности и наличия α-спиральных фрагментов. Так, апопротеин А1 (апоА1) - основной белок ЛВП - локализуется целиком на поверхности глобулы, взаимодействуя преимущественно с полярными "головками" ФЛ. Значительная его область соприкасается с окружающей водной фазой. Это обуславливает его относительную подвижность вплоть до способности покидать "материнскую" липопротеиновую частицу в процессе трансформации липопротеинов в кровяном русле. Другой же белок тех же ЛВП - апопротеин АII, глубже погружен в гидрофобную область липопротеина из-за наличия жирнокислотных цепей фосфолипидов - и вследствие этого отделяется от липопротеиновой частицы с трудом, только в условиях in vitro, при действии детергентов. Еще большей гидрофобностью обладает основной белок ЛНП - апопротеин В, часть фрагментов которого взаимодействует не только с остатками жирных кислот ФЛ, но и в некоторой степени с неполярными гидрофобными липидами окружения ядра ("core") липопротеиновой частицы, состоящего из эфиров холестерина и триглицеридов.
Размером этого гидрофобного ядра, разного для каждого класса липопротеинов, и определяется относительное количественное содержание фосфолипидов. Из простых геометрических
соображений ясно, что при одинаковой толщине фосфолипидного монослоя (то есть длине жирнокислотных цепей ФЛ) доля его объема по отношению ко всей частице возрастает со снижением диаметра ядра. Поэтому процент фосфолипидов минимален (5- 15%) в самых крупных частицах - хиломикронах (диаметром от 200 до 1000 нм) и ЛОНП (40 - 60 нм), в которых преобладают нейтральные липиды, и максимален для относительно мелких ЛВП (диаметром 4 - 5 нм) (~ 30%) [191, 193].
Такая же направленность, но выраженная еще в большей степени - свойственна и другому компоненту поверхности липопротеинов - белкам. Их содержание возрастает от 2% в хиломикронах до 55% в наиболее мелкой по размеру и плотной подфракции ЛВП (ЛВП3). При этом часть поверхности липопротеина, занятая апопротеинами, и заменяющая тем самым фосфолипиды, также влияет на общий процент последних в липопротеиновой частице. Это особенно характерно для богатых белком подфракций ЛВП. ЛВП3 меньше по диаметру, чем продукт
65
их частичной трансформации в плазме крови - ЛВП2, поэтому относительная доля поверхностного монослоя (от всей массы частицы) в ЛВП3 максимальна. Но вследствие высокого процента белка на свободную от него зону фосфолипидам остается меньшая часть поверхности, что и объясняет несколько меньший (в среднем ~25%) процент ФЛ в ней по сравнению с более крупными ЛВП2 (~33%).
По даным Rye и Duong [194] количество фосфолипидов в ЛВП вносит основной вклад в их размер и структуру. При действии фосфолипазы А2, гидролизующей ФЛ происходит значительное уменьшение размера рекомбинированных ЛВП.
Свободный холестерин (процент которого в липопротеинах, в отличие от мембран клеток, невелик и составляет всего 5-15 %) локализуется в основном в поверхностном монослое, располагаясь между молекулами фосфолипидов, как и в наружном слое биомембран или липосом. Значения молярного отношения "холестерин-фосфолипиды", важного для структуры фосфолипидного монослоя, в ЛОНП и ЛНП близко к таковому для биомембран - 0,7-0,8, а для подфракций ЛВП - вдвое ниже.
Состав липопротеиновых ФЛ подобен составу наружного слоя плазматических мембран клеток, для которого, характерна преимущественная локализация холинсодержащих фосфолипидов, ФХ и СМ (табл. 2.6.1) [195-199]. В липопротеинах, где внутреннего мембранного слоя нет, почти нет и аминосодержащих фосфолипидов, что, возможно, связано с конусообразной формой их молекул, не соответствующей выпуклой сферической
поверхности липопротеинов. Более 90% от всех ФЛ приходится на ФХ, СМ и лизоФХ. В основном это ФХ, доля которого в среднем вдвое выше, чем в биомембранах. Такой состав липопротеинов может быть связан и с особенностями их синтеза и секреции мембранами гепатоцитов [200].
Как видно из таблицы 2.6.1, различия в составе ФЛ между отдельными классами липопротеинов выражены не очень резко; наиболее существенная специфическая особенность - это несколько больший процент сфингомиелина в богатых холестерином ЛНП по сравнению с другими классами липопротеинов, что является еще одним проявлением комплементарности сфингомиелина и холестерина.
Необходимо отметить, что существенные различия в составе ФЛ между липопротеинами в принципе невозможны из-за постоянно идущих в кровяном русле процессов превращения липопротеинов, транспорта и перехода апопротеинов и липидов, включая индивидуальные ФЛ, с участием фосфолипид-транспортного
66

Таблица 2.6.1. Состав фосфолипидов липопротеинов плазмы крови [197 - 199]
(в % от общего содержания фосфолипидов)
Классы |
ËÎÍÏ |
|
|
|
ËÍÏ |
|
|
ËÂÏ |
||
фосфолипидов |
[197] |
|
[197] |
[198] |
[197] |
|
[199] |
|||
Фосфатидилхолин |
76,2 |
± 1,6 |
77,1 |
± 2,1 |
66,0 ± 0,2 |
79,2 |
± 2,91 |
|
67,3 ± 3,8 |
|
|
|
|
|
|
|
|
|
|
|
|
Сфингомиелин |
13,1 |
± 0,4 |
16,2 |
± 0,1* |
29,2 ± 0.6 |
13,5 |
± 0,21 |
|
15,6 ± 0,1 |
|
|
|
|
ÐËÎÍÏ<0.05 |
|
|
|
|
|
||
|
|
|
ÐËÂÏ<0.05 |
|
|
|
|
|
||
Фосфатидил |
4,7 ± 0,2 |
3,6 |
± 0,4 |
4,8 ± 0,2** |
2,3± 2,19 |
|
- |
|||
этаноламин |
|
|
|
|
|
|
|
|
|
|
Фосфатидилсерин |
0,13 |
± 0,03 |
0,7 |
± 0,1 |
- |
0,06 |
± 0,02*** |
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
Фосфатидилинозит |
0,41 |
± 0,04 |
0,4 |
± 0,1 |
- |
2,81 |
± 0,04 |
|
- |
|
|
|
|
|
|
|
|
|
|
||
Лизофосфатидил - |
3,2 ± 0,1 |
2,1 |
+ 0,1. |
- |
0,14 |
± 0,08 |
|
- |
||
холин |
|
|
|
|
|
|
|
|
|
|
Кардиолипин + |
0,42 |
± 0,04 |
0,77 |
± 0,08 |
- |
0,4 ± 0,06*** |
|
- |
||
фосфатидилглицерин |
|
|
|
|
|
|
|
|
|
|
*ÐËÎÍÏ, ÐËÎÍÏ - достоверность по отношению к проценту в ЛОНП и ЛВП [197];
**-ÔÝ вместе с плазмалогеном
***- данные Deguchi H. Et al. [196]
(-) - измерения не проводились
белка (ФЛТБ), а также обмена фосфолипидов между липопротеинами и мембранами клеток [201 - 203].
Присутствие в липопротеинах, наряду с холинсодержащими ФЛ, оптимальными для формирования выпуклого монослоя, также и других классов фосфолипидов связано, по всей вероятности, с особенностями формирования липопротеиновой частицы в печени, когда под влиянием синтезированных в клетке апопротеинов секвестируется определенная область мембраны ЭР гепатоцитов со всеми находящимися в ней фосфолипидами. По мнению Vance и Vance [200] для секреции липопротеинов гепатоцитами используются специфические пулы ФЛ, что связано с путями их биосинтеза. При этом эффективным предшественником фосфолипидов липопротеинов оказывается не ФЭ, а ФХ.
Взаимодействие участка мембраны ЭР гепатоцита с апопротеином АI и/или АП приводит к секвестированию и
секреции участка микросомального мембранного бислоя, принимающего форму плоского диска с апопротеинами на периферии [204, 205] (называемого в последнее время по электрофоретической подвижности пре-β-ЛВП). В плазме они приобретают практически сразу сферическую форму, за счет катализируемого ЛХАТ образования эфиров холестерина,
67
формирующих сферическое гидрофобное ядро липопротеиновой частицы [206, 207].
В последнее время появились доводы в пользу другого, внеклеточного пути формирования пре-β-ЛВП. Имеются данные, что апоА1 может секретироваться из печени в свободном состоянии, или с очень небольшим количеством фосфолипидов, а остальные ФЛ забираются им с плазматических мембран клеток с помощью АТФсвязывающего транспортерного мембранного белка АВС А1 [208, 209]. Этим можно объяснить подобие состава фосфолипидного монослоя липопротеинов и наружного слоя мембран клеток.
При образовании же ЛОНП, как и хиломикронов в кишечнике, ФЛ вместе с небольшим количеством апопротеинов создают покрывающую поверхность для высоко гидрофобных триглицеридов, обеспечивая их секрецию в кровь в виде стабильных частиц.
Что касается топографии отдельных классов ФЛ на поверхности липопротеина, то они расположены не беспорядочно, а в виде сегрегированных доменов, что было показано с использованием флуоресцентно меченных фосфолипидов - ФХ и СМ [210]. Также была показана высокая микровязкость примыкающих к апопротеину микрообластей ФЛ. Одной из причин этого может быть электростатическое взаимодействие полярных аминокислотных остатков белка с фосфохолиновым фрагментом ФХ. Работами последних лет показана пластичность структуры липопротеинов, особенно ЛВП, в которых амфипатические α-спиральные домены основного белка апопротеина А1, взаимодействуют с
фосфолипидами [211, 212].
Частицы ЛВП в плазме высоко динамичны и подвергаются постоянному ремоделированию с участием специфических транспортных и ферментных белков плазмы крови и биомембран. В настоящее время методом ядерно-магнитного резонанса (ЯМР) была получена подробная информация о белок-фосфолипидных взаимодействиях в ЛВП, включая взаимодействия и с другими апопротеинами (СI, ÑII) [213]. Для более крупных липопротеинов - ЛНП, недавно предложена новая структурная модель - "трехслойная", в которой, помимо поверхности и ядра, отмечается присутствие промежуточного слоя [214]. Авторы отмечают важность вклада β-складчатой структуры белка (апопротеина В) и полярных головок фосфатидилхолина в формирование четвертичной структуры белка. При этом подчеркиваются изменения молекулярных характеристик и белок-липидных взаимодействий в модифицированных, наиболее атерогенных частицах ЛНП.
68
СПИСОК ЛИТЕРАТУРЫ К ГЛАВЕ 2.
1.Killian J.A., van Meer G. The "double life" of membrane lipids. EMBO Reports. 2001, 21, 91-95.
2.Singer S., Nicolson G. The fluid mosaiñ model of the structure of cell membranes. Science. 1972, 175, 720-731.
3.Накагаки М. Физическая химия мембран. Мир, М. 1991, 60.
4.Ho C., Slater S.J., Stubbs C.D., Slater S.J., Stubbs C.D. Hydration and order in lipid bilayers. Biochemistry. 1995, 34, 6188-6195.
5.Лопухин Ю.М., Арчаков А.И., Владимиров Ю.А., Коган Э.М. Холестериноз (Холестерин биомембран. Теоретические и клинические аспекты). Медицина, М. 1983.
6.Dahl C., Dahl J. In: Biology of cholesterol (Yagle P.L. ed). CRC Press, Boca Raton (Fl., USA). 1988, 147-172.
7.Ohvo-Rekila H., Ramsted B., Leppimaki P., Slotte P. Cholesterol interaction with phospholipids in membranes. Progr Lipid Res. 2002, 41, 66-97.
8.Barenholz Y. In: Physiology of membrane fluidity (Shinitzky M.ed). CRC Press, Boca Raton (Fl., USA). 1984, 131-173.
9.Huang J., Buboltz J.T., Feigenson G.W. Maximum solubility of cholesterol in phosphatidylcholine and phosphatidylethanolamine bilayers. Biochim Biophys Acta. 1999, 1417, 89-100.
10.Stockton B.W., Smith I.C.P. A deuterium nuclear magnetic resonance study of the condensing effect of cholesterol on egg phosphatidylcholine bilayer membranes. I. Perdeuterated fatty acid probes. Chem Phys Lipids. 1976, 17, 251-263.
11.Yeagle P.L Cholesterol and the cell membrane. Biochim Biophys
Acta.1985, 822, 267-287.
12.Yeagle P.L. In: Cholesterol in membrane models (Finegold L. ed). Boca Raton (Fl., USA), CRC Press. 1993, 1-12.
13.Sackmann E. In: Structure and dynamics of membranes-from cells to vesicles (Lipowsky R., Sackmann E. eds). North-Holland. 1995, 1-65.
14.Jacobon K., Sheets E.D., Simson R. Revisiting the fluid mosaic model of membranes. Science. 1995, 268, 1441-1442.
15.Sheets E.D., Lee G.M., Simson R., Jacobson K. Transient confinement of a glycosylphosphatidylinositol-anchored protein in the plasma membrane. Biochemistry. 1997, 36, 12449-12458.
16.Roper K., Corbeil D., Huttner W.B. Retention of prominin in microvilli reveals distinct cholesterol-based lipid microdomains in the apical plasma membrane. Nat. Cell Biol. 2000, 2, 582-592.
17.Somerharju P., Virtanen J.A., Cheng K.H. Lateral organisation of membrane lipids. The superlattice view. Biochim Biophys Acta. 1999, 1440, 32-48.
69
18.Virtanen J.A., Cheng K.H., Somerharju P. Phospholipid composition of the mammalian red cell membrane can be rationalized by a superlattice model. Proc Nat Acad Sci USA. 1998, 95, 4964-4969.
19.Boon J.M., Smith B.D. Chemical control of phospholipid distribution across bilayer membranes. Review. Med Res Rev. 2002, 22, 251-281.
20.Kol M.A., van Laak Rijkers, Killian J.A. Phospholipid flop induced by transmembrane peptides in model membranes is modulated by lipid composition. Biochemistry. 2003, 42, 231-237.
21.Okeley N.M., Gelb M. H. A designed probe for acidic phospholipids reveals the unique enriched anionic character of the cytosolic face of the mammalian plasma membrane. J Biol Chem. 2004, 279, 2183321840.
22.Op den Kamp J.A.F. Lipid asymmetry in membranes. Annu Rev Biochem. 1979, 48, 47-71.
23.Rothman J.E., Lenard J. Membrane asymmetry. Science. 1977, 195, 743-753.
24.Bretscher M.S. Phosphatidylethanolamine: differential labelling in intact cells and cell ghosts of human erythrocytes by a membraneimpermeable reagent. J Mol Biol. 1972, 71, 523-528.
25.Gascard P., Tran D., Sauvage M., Sulpice J.-C., Fukami K., Takenawa T., Claret M., Giraud F. Asymmetric distribution of phosphoinositides and phosphatidic acid in the human erythrocyte membrane. Biochim Biophys Acta. 1991, 1069, 27-36.
26.Butikofer P., Lin Z.W, Chiu D.T-Y., Kuypers F.A. Transbilayer distribution and mobility of phosphatidylinositol in human red blood cells. J Biol Chem. 1990, 265, 16035-16038.
27.Kato N., Nakanishi M., Hirashima N. Transbilayer asymmetry of phospholipids in plasma membrane rergulates exocytotic release in mast cells. Biochemistry. 2002, 41, 8068-8074.
28.Fadok V.A., Voelker D.R., Campbell P.A., Cohen J.J., Bratton D.L., Henson P.M. Exposure of phosphatidylserine on the surface of apoptotic lymphocytes triggers specific recognition and removal by macrophages. J Immunol. 1992, 148, 2207-2216.
29.Bevers E.M., Comfurius P., van Rijn J.L., Hemker H.C., Zwaal R.F. Generation of prothrombin-converting activity and the exposure of phosphatidylserine at the outer surface of platelets. Eur J Biochem. 1982, 122, 429-436.
30.Lubin B., Chiu D., Bastacky J., Roelofsen B., van Deenen L.L. Abnormalities in membrane phospholipid organization in sickled erythrocytes. J Clin Invest. 1981, 67, 1643-1649.
31.Schlegel R.A., McEvoy L., Williamson P. Membrane phospholipid asymmetry and the adherence of loaded red blood cells. Bibl Haematol. 1985, 51, 150-156.
70
