
чаще температурой фазового перехода (Тô.ï.). При этой температуре осуществляется переход ФЛ от фазы упорядоченного (твердого) гелеобразного состояния в фазу менее упорядоченного, текучего, так называемого, жидко-кристаллического состояния [54].
Жидкостность (или Тô.ï.) фосфолипидов существенно зависит от структуры жирнокислотных цепей, увеличиваясь с повышением длины цепей и снижаясь при возрастании степени их ненасыщенности. Сфинголипиды наиболее богаты длинными насыщенными жирнокислотными цепями, что создает условия для более плотной молекулярной упаковки, и поэтому они имеют сравнительно высокую Тô.ï.. В противоположность этому, у природных глицерофосфолипидов, содержащих обычно ненасыщенные ацильные цепи, Тô.ï. более низкая (Табл.1.3.1).
Таблица 1.3.1.
Температуры фазовых переходов ФХ и ФЭ с различными жирными кислоòами [по 54 c изменениями]
Фосфолипид |
Жирные кислоты |
Òô.ï. , îÑ |
ÔÕ: ÄÑÔÕ |
18:0, 18:0 |
55 |
ÄÏÔÕ |
16:0, 16:0 |
42 |
ÏÎÔÕ |
16:0, 18:1 |
- 7 |
ÑËÔÕ |
18:0, 18:2 |
- 16.7 |
ÄÎÔÕ |
18:1, 18:1 |
-21 |
ÔÝ : ÄÑÔÝ |
18:0, 18:0 |
58 |
ÄÌÔÝ |
14:0, 14:0 |
48 |
Cокращения: С - стеарил-, П - пальмитоил, О - олеоил, Л - линолеоил;
ДС-, ДП-, ДО-, ДМ - дистеароил-,дипальмитоил-, диолеоил-, димиристоил- , соответственно
Другие мембранные ФЛ, такие, как ФС, ФГ и ФИ, содержат в основном ненасыщенные жирные кислоты и поэтому, подобно ФХ, увеличивают жидкостность образованных из них мембран. В то же время, присутствие гликосфинголипидов (например, ганглиозидов), имеющих гидрофобную область, похожую на таковую у сфинголипидов, придает жесткость бислою [55].
СПИСОК ЛИТЕРАТУРЫ К ГЛАВЕ I
1.Бергельсон Л.Д. Мембраны, молекулы, клетки. М., Наука.
1982.
2.Avogaro H., Catapano A. Phospholipids and atherosclerosis. Raven Press, N.Y. 1983.
3.Pulfer M., Murphy R.C. Electrospray mass spectrometry of phospholipids. Mass Spectrom Rev. 2003, 22, 332-364.
4.Audesirik T., Audesirik G. Biology, life on earth prentice hall. New Jersey. 1999.
5.Alberts B., Bray D., Lewis J., Raff Ì., Roberts Ê., Watson J. D.
31
Molecular Biology of the Cell. N.Y. 1994.
6.Wolfe S.L. Molecular and Cellular Biology. Wadsworth Publishing Company. 1993.
7.Wang Y., Krull I.S, Liu C., Orr J.D. Derivatization of phospholipids. J Chromatogr B Analyt Technol Biomed Life Sci. 2003, 793, 3-14.
8.Васьковский В.Е. Соросовский образовательный журнал. 1997, 3, 32-37.
9.Zurier R.B. Prostaglandins: then and now and next. Semin Arthritis Rheum. 2003, 33, 137-139.
10.Scholz H. Prostaglandins. Am J Physiol Regul Integr Comp Physiol. 2003, 285, R512-514.
11.Claria J., Arroyo V. Prostaglandins and other cyclooxygenasedependent arachidonic acid metabolites and the kidney in liver disease. Prostaglandins Other Lipid Mediat. 2003, 72, 19-33.
12.Титов В.Н. Атеросклероз как патология полиеновых жирных кислот М., 2002.
13.Gundermann K.-J. Fd. The "essential" phospholipids as a membrane therapeutic Publisher Polish Section of European Society of biochemical pharmacology, Szczecin. 1993, 2-17.
14.Glomset J. The plasma lecithin:cholesterol acyltransferase reaction. J Lipid Res. 1968, 9, 155-167.
15.Проказова Н.В., Звездина Н.Д., Коротаева А.А.. Влияние лизофосфатидилхолина на передачу трансмембранного сигнала внутрь клетки. Биохимия, 1998, 63, 38-46.
16.Gouni-Berthold I., Sachinidis A. Does the coronar risk factor low density lipoprotein alter growth and signaling in vascular smooth muscle cells? FASEB J. 2002, 16, 1477-1488.
17.Эллиот В., Эллиот Д. Биохимия и молекулярная биология. Перевод с английского. М., 2002, 56.
18.Ивков В.Г., Берестовский Г.Н. Липидный бислой биологических мембран. М., 1982.
19.Coste H, Martel M.B., Got R. Topology of glucosylceramide synthesis in Golgi membranes from porcine submaxillary glands. Biochim Biophys Acta. 1986, 858, 6-12.
20.Hannun Y.A., Luberto C. Ceramide in the eukaryotic stress response. Trends Cell Biol. 2000, 10, 73-80.
21.van Meer G., Holthuis J.C. Sphingolipid transport in eukaryotic cells. Biochim Biophys Acta. 2000, 1486, 145-170.
22.Auge N., Negre-Salvayre A., Salvayre R., Levade T. Sphingomyelin metabolites in vascular cell signaling and atherogenesis. Prog Lipid Res. 2000, 39, 207-229.
23.Prieschl E.E., Baumruker T. Sphingolipids: second messengers, mediators and raft ñonstituents in signaling. Immunol Today. 2000, 21,
32
555-560.
24.Levade T., Auge N. Sphingolipid mediators in cardiovascular cell biology and pathology. Circulation Res. 2001, 89, 957-977.
25.zu Heringdorf D. M., van Koppen C. J., and Jakobs K. H. Molecular diversity of sphingolipid signalling. FEBS Lett. 1997, 410, 3438.
26.Silins I., Nordstrand M., Hogberg J., Stenius U. Sphingolipids suppress preneoplastic rat hepatocytes in vitro and in vivo. Carcinogenesis. 2003, 24, 1077-1083.
27.Spiegel S., Merrill A.H. Sphingolipid metabolism and cell growth regulation. FASEB J. 1996, 10, 1388-1397.
28.Chatterjee S.. Sphingolipids in atherosclerosis and vascular biology. Arterioscler Thromb Vasc Biol. 1998, 18, 1523-1533.
29.Kates M., Technigues of lipidology. Elsevier, Amsterdam.1986.
30.Calderon R.O., DeVries G.H. Lipid composition and phospholipid asymmetry of membrane from Schwann cell line. J Neurosci Res. 1997, 49, 372-380.
31.Greiner J.V., Glonek T., Townsend D.J., Hearn S.L. Epidermal and dermal phospholipids of the human eyelid: a 31P NMR sperctroscopy study. Arch Dermatol Res. 1998, 290, 298-305.
32.Murphy E.J., Joseph L., Stephens R., Horrock L.A. Phospholipid composition of cultured human endothelial cells. Lipids. 1992, 27, 150153.
33.Rosenberger T.A., Oki J., Purdon A.D., Rapoport S.I., Murphy E.J. Rapid synthesis and turnover of brain microsomal ether phospholipids in the adult rat. J Lipid Res. 2002, 43, 59-68.
34.Костецкий Э.Я. Сравнительное биохимическое исследование фосфолипидного состава морских беспозвоночных. Тез. Всесоюзн. конф. "Эволюционная биохимия и происхождение жизни". Ереван. 1978, 53-54.
35.Gorski J., Zendzian-Piotrowska M., deJong Y.F, Niklinska W., Glatz J.F. Effect of endurance training on the phospholipid content of skeletal muscles in the rat. Eur J Appl Physiol Occup Physiol. 1999, 79, 421-425.
36.Borchman D., Byrdwell W.C., Yappert M.C. Regional and agedependent differences in the phospholipid composition of human lens membranes. Invest Ophthalmol Vis Sci. 1994, 35, 3938-3942.
37.Кагава Ясуо. Биомембраны. М., 1985, 52-55.
38.Mahadevappa V.G., Holub B.J. The molecular species composition of individual diacyl phospholipids in human platelets. Âiochim Biophys Acta. 1982, 713, 73-79.
39.Van Dijk P.V.M., Van Zoelen E.J.J., Seldenrijk R., Van Deenen L.L.M. Calorimetric behaviour of individual phospholipid classes from
33
human and bovine erythrocyte membrane. Chem and Phys Lipids. 1976, 17, 336-343.
40.Laganiere S., Yu B.P. Modulation of membrane phospholipid fatty acid ñomposition by age and food restriction. Gerontology. 1993, 39, 7-18.
41.Hulbert A.J., Rana T., Couture P. The acyl composition of mammalian phospholipids: an allometric analysis. Comp Biochem Physiol B Biochem Mol Biol. 2002, 132, 515-527.
42.Bangham A.D., Horne R.W. Negative staining of phospholipids and their strucrured modification by surface agents as observed in electron microscope. J Mol Biol. 1964, 8, 660-668.
43.Bangham A.D., Standish M.M., Watkins J.C. Diffusion of univalent ions across the lamelae of swollen phospholipids. J Mol Biol. 1965, 13, 238-252.
44.Барсуков Л.И., Липосомы. Соросовский обозревательный журнал. 1998, N 10, 2-9.
45.Bangham A.D. In Liposomes Letters (Bangham À.ed), L., N.Y., Añad Press. 1983, 12-15.
46.Геннис Р.Б. Биомембраны. Молекулярная структура и функции. Перевод с английского, М., 1997, 83.
47Cavagnetto F., Relini A., Mirghani Z., Gliozzi A., Bertoia D., Gambacorta A. Molecular packing parameters of bipolar lipids. Biochim Biophys Acta. 1992, 1106, 273-281.
48.Марголис Л.Б., Бергельсон Л.Д. Липосомы и их взаимодействие с клетками. М., 1986.
49.Barenholz Y. Design of liposome-based drug carriers: From basic research to application as approved drugs. In Medical Applications of Liposomes (Lasic D.D. and Papahadjopoulos D. eds), N.Y., Elsevier Science BV. 1998, 545-565.
50.Allen Theresa M. and Cullis Pieter R. Drug Delivery Systems: Entering the Mainstream. Drug Discovery. 2004, 303, 1818 - 1822.
51.Bashir R. BioMEMS: state-of-the-art in detection, opportunities and prospects. Adv Drug Deliv Rev. 2004, 56, 1565-1586.
52.Allen T.M., Cullis P.R. Drug Delivery Systems: Entering the Mainstream. Science. 2004, 303, 1818-1822.
53.Torchilin V.P . Drug targeting. Eur J Pharm Sci. 2000, 11, Suppl 2, 81-91.
54.Shaw A.W, McLean M.A,.Sligar S.G. Phospholipid phase transitions in homogeneous nanometer scale bilayer discs. FEBS Letters. 2004, 556, 260-264.
55.Hoekstra D., Maier O., van der Wouden J.M., Slimane T.A. Membrane dynamics and cell polarity: the role of sphingolipids. J Lipid Res. 2003, 44, 869-877.
34
ГЛАВА 2. РОЛЬ ФОСФОЛИПИДОВ В СТРУКТУРНОЙ ОРГАНИЗАЦИИ БИОМЕМБРАН И ЛИПОПРОТЕИНОВ
Биомембраны имеют ключевое значение, как в организации структуры, так и в функционировании всех клеток: прокариотов, эукариотов, растений и животных. Мембраны, по существу, устанавливают границы компартментов клетки, осуществляют связь между ними.
Одна из важнейших функций биомембран заключается в отделении клетки от внешней среды и в сохранении автономности ее внутреннего устройства. Благодаря наличию мембраны, внутри клетки и в ее органеллах постоянно поддерживаются высокие концентрации необходимых веществ и ограничивается поступление чужеродных соединений, не участвующих в процессах жизнедеятельности. Компартментализация внутреннего содержимого клетки (т. е. пространственное разделение мембранами внутриклеточных систем) позволяет независимо осуществлять различные, иногда противоположно направленные реакции метаболизма, а также их тонкую регуляцию. Именно мембраны поддерживают клетку в неравновесном состоянии, обеспечивая сохранение градиентов концентраций и электрического потенциала. Свободная энергия, запасенная таким образом внутри клетки или ее органеллах, расходуется на осуществление многих жизненно важных функций - от генерации и распространения нервного импульса до химического синтеза и совершения механической работы. Разрушение мембраны приводит, как правило, к гибели клетки.
Мембраны определяют природу всех связей как внутри-, так и межклеточных. Они формируют системы активного внутри- и межклеточного транспорта, обеспечивают трансдукцию клеточного сигнала. В клеточную мембрану встроено большое количество транспортных, рецепторных белков, ферментов и ферментных систем/комплексов. Одни ферменты катализируют трансмембранные реакции или транспорт молекул, расположенных как на внутренней, так и на внешней стороне мембраны. Другие - вовлечены в целую серию последовательных реакций, которые протекают на поверхности мембраны, чем обеспечивается их высокая избирательность и эффективность. Другими словами, большинство фундаментальных процессов, протекающих в клетке (репликация ДНК, биосинтез и секреция белка, биоэнергетические и гормон-зависимые процессы и т.д.), происходит с вовлечением как плазматической мембраны, так и мембран ее компартментов.
Биологические мембраны содержат гетерогенную смесь ФЛ,
35
отличающихся друг от друга структурой полярной "головки", длиной жирнокислотной цепи, степенью ненасыщенности ацильных цепей, видом их связывания и т.д. Учитывая все это, очень сложно определить физические свойства и функциональную роль индивидуальных липидов, и способ их взаимодействия с другими липидами в природных биомембранах. Поэтому для получения информации о структурной организации и взаимодействии липидов внутри мембраны исследователи широко использовали искусственные системы, содержащие ФЛ и некоторые другие мембранные компоненты, такие как холестерин, интегральные белки. После периода относительного "застоя", в последнее десятилетие, с появлением новых методических подходов, был сделан большой шаг в понимании функционирования мембранных фосфолипидов. Как отмечают Killian и van Meer [1], липиды, в частности, ФЛ в мембране ведут "двойную жизнь", являясь, с одной стороны, "строительными блоками", а с другой - модуляторами важнейших клеточных процессов.
Применение современных компьютеризированных биохимических и биофизических методов исследования позволяет изучать поведение мембранных липидов на молекулярном и даже на атомном уровнях. Новые методические подходы позволили в последние годы достичь определенных успехов в области исследования структуры биомембран, в частности, пересмотреть классическую модель их строения. Так, оптические методы, связанные с развитием технологии флуоресцентных изображений
(мультифотонная лазерная сканнирующая микроскопия и конфокальная микроскопия), позволяют следить за реальным поведением во времени, динамикой и локализацией флуоресцентных аналогов природных липидов в мембранах живой клетки. С их помощью было впервые показано, что состав и структура мембраны характеризуются не статическими признаками, свойственными клетке в течение всей ее жизни и лишь немного меняющимися в процессе созревания и старения, а представляют собой динамическую, постоянно модифицирующуюся систему, скоординированную с большинством клеточных процессов. С другой стороны развитие методов протеомики и геномики качественно изменили в последнее десятилетие ситуацию во всех областях биохимии, включая и мембранологию, привели к обнаружению новых, ранее не известных мембранных белков: транспортеров, рецепторов, регуляторов, в частности, регуляторов состава и расположения индивидуальных классов мембранных фосфолипидов,
36
гликофосфолипидов, холестерина. Эти белки контролируют процессы не только биосинтеза ФЛ, но и деацилирования (фосфолипазами А) с последующим избирательным ацилированием (т.н. "ремоделирование"), а также существенное для функционирования мембраны трансбислойное перемещение ("флип-флоп") молекул ФЛ.
2.1. Строение биологических мембран
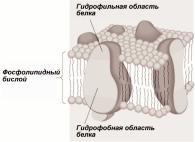
Согласно жидкомозаичной модели, предложенной в 1972 г. Сингером и Николсоном [2], фосфолипиды в мембране расположены в форме двойного слоя (бислоя), который образует жидкую или точнее жидкокристаллическую матрицу (рис. 2.1.1). Каждый слой ФЛ обращен жирнокислотными цепями внутрь бислоя, формируя гидрофобную фазу. Полярные гидрофильные "головки" ФЛ обращены наружу и внутрь клетки. Белки пронизывают всю мембрану или "плавают" внутри нее. Такая мембрана обладает определенной текучестью, обусловленной латеральной диффузией липидных и белковых молекул [3].
Рис.2.1.1. Жидко-êристаллическая модель мембраны (по [215] с изменениями)
Несмотря на существенные достижения, особенно в последние годы, показавшие огромную, пока еще полностью не объясненную усложненность молекулярной структуры биологических мембран, современная мембранология не отказалась от жидкомозаичной модели мембраны, постоянно дополняя ее новыми полученными данными. И в настоящее время мы, по-прежнему, пользуемся этой моделью строения мембраны, но в усложненной форме, в которой отражены новые, специфические, не известные ранее закономерности.
Согласно современным представлениям, центральный слой такой мембраны представляет собой текучий липидный бислой с включениями внутримембранных белков. Полагают, что
37
ассоциированные с мембранной белки являются глобулярными. Некоторые из них расположены на полярной поверхности мембраны или частично погружены в ее монослой как с наружной, так и с внутренней стороны. Это, так называемые, периферические, функционально ассоциированные с мембраной белки, удерживаемые на ее поверхности при помощи нековалентных связей. Другие, интегральные белки проходят через всю толщу мембраны, в том числе и через внутренние неполярные ее слои. В интегральных белках последовательность аминокислотных остатков распределена таким образом, что гидрофобные остатки аминокислот формируют структуры, которые пронизывают мембрану, а гидрофильные - образуют функциональные домены на внутренней и/или наружной поверхностях мембраны. Таким образом, функционально разные белки мембраны образуют в жидкокристаллическом бислое фосфолипидов своеобразную мозаичную структуру. Эта мозаика не является строго фиксированной, что позволяет разным классам ФЛ и минорным липидам мембраны при латеральной диффузии формировать определенные кластеры (участки поверхностного монослоя мембраны).
Плазматическая мембрана содержит много гликолипидов, полярные углеводные части которых (остатки моно- и олигосахаридов), расположены на ее поверхности, что позволяет им выполнять специфичные функции, такие как рецепция (клеточное узнавание) и иммунохимические реакции. Выступающие из бислоя гидрофильные олигосахаридные участки
гликолипидов образуют у эукариотических клеток подобие наружной оболочки - гликокаликса.
Определенную роль в стабилизации липидного бислоя играет и слой воды, покрывающий снаружи монослой фосфолипидов и мембранных белков. Такие монослои воды удерживаются на поверхности мембраны за счет водородных связей между полярными "головками" ФЛ и молекулами воды [4]. В бислое индивидуальные липидные молекулы могут перемещаться (латеральная диффузия), что обеспечивает мембране жидкостность
èгибкость. Отдельные молекулы ФЛ, в зависимости от длины их жирнокислотных цепей способны перемещаться между наружным
èвнутренним монослоем мембраны, используя механизм флипфлопа.
Все это указывает на то, что бислойная мембрана является единой динамичной и саморегулирующейся системой.
На рис. 2.1.2 представлена современная более усложненная жидкомозаичная модель мембраны эукариотической клетки.
38

Рис. 2.1.2. Современная интерпретация жидко-ìозаичной модели мембраны (по [215] с изменениями).
Видны встроенные в мембрану периферические и интегральные белки и молекулы холестерина; показано взаимодействие мембранных белков с внутриклеточными волокнами цитоскелета (нижняя часть рисунка) и с внеклеточным матриксом, при возможном участии связанных с мембраной гликолипидов и гликопротеинов (верхняя часть рисунка).
Жидкомозаичная модель объясняет многие свойства биологических мембран, например, неодинаковое число молекул белка на единицу площади, ассиметрию, возможность расположения белков только на внутренней или только на
наружной поверхности, разную толщину мембраны и др.
Эта модель позволяет понять высокое электрическое сопротивление мембраны, избирательную проницаемость, изменчивость, а также латеральную диффузию - перемещение отдельных липидов и белков в плоскости наружного монослоя со значительной скоростью.
Помимо белков и ФЛ, важнейшими компонентами всех биологических мембран являются стерины. В противоположность имеющемуся разнообразию ФЛ, клетки млекопитающих содержат только один важнейший стерин - холестерин, который необходим для их жизнедеятельности и пролиферации [5 - 7]. Максимальная
растворимость холестерина в фосфолипидном бислое варьирует в
пределах 50 - 66 мол% в зависимости от вида доминирующего в нем липида [8, 9]. Встраиваясь между молекулами липидов, ХС участвует в регуляции текучести мембраны, препятствуя плотной упаковке углеводородных цепей и тем самым, снижая температуру плавления липидов. Внешне это проявляется в "расширении"
39
области фазового перехода в липидном бислое. В жидкокристаллическом состоянии ХС повышает степень упорядоченной ориентации и снижает скорость движения углеводородных цепей ФЛ [10, 11].
Таким образом, ХС и мембранные белки заметно влияют на организацию липидного бислоя, увеличивая его структурную гетерогенность [12].
Необходимо отметить, что структурная динамика бислоя в целом (фазовые переходы, поддержание асимметрии, текучесть, латеральная диффузия, "флип-флоп" и др.) играет ключевую роль в реализации мембранных и трансмембранных процессов. В основе структурной динамики бислоя лежат липид/липидные и липид/белковые взаимодействия или, другими словами, поведением липидов управляет их химическая структура.
Так, пространственная структура и размер полярной области ФЛ влияют на плотность молекулярной упаковки, т.е. на пространственное расположение в мембране жирнокислотных цепей фосфолипидных молекул. Например, этаноламин конформационно занимает меньший объем, чем холин (в котором атомы водорода в аминогруппе заменены большими по объему метильными группами), что создает возможность более плотной упаковки ацильных цепей в бислое, содержащем ФЭ, по сравнению с ФХ. Более того, ФЭ может образовывать обширную сеть водородных связей, которые дополнительно повышают плотность упаковки жирнокислотных цепей.
Характер упаковки жирнокислотных цепей ФЛ в мембране
существенно зависит от их химической структуры. Так, в полностью насыщенных жирнокислотных цепях ФЛ все атомы углерода находятся полностью в транс-конформации. В случае двух цепей в молекуле они имеют возможность располагаться параллельно друг другу (и параллельно ацильным цепям соседних ФЛ молекул). Примером этого может служить молекула
сфингомиелина, которой свойственны наиболее насыщенные
° 2
ацильные цепи - она занимает в среднем область 36 Α . Введение двойной связи с цис-конформацией (а именно в такой
конформации находятся ненасыщенные ЖК природных ФЛ) приводит к образованию в жирнокислотной цепи перегиба (кинк), разрыхляющего плотную упаковку, ван-дер-ваальсовское взаимодействие при этом ослабляется. Поэтому присутствие хотя бы одной единственной двойной связи достаточно для того, чтобы оказать выраженное влияние на физические свойства ФЛ.
При наличии в молекуле ФЛ двух жирнокислотных цепей, содержащих ненасыщенные двойные связи (как, например, в
40
