
отрицательный заряд и требует присутствия противоионов (Рис. 1.1.2.6).
Лизофосфатидная кислота (лизоФК) - 1-ацил-sn-глицерин-3- фосфат - отличается от фосфатидной кислоты тем, что имеет только одну молекулу ЖК на молекулу фосфолипида. Хотя лизоФК присутствует в очень низких количествах только в животных тканях, она имеет важное биологическое значение, т.к. влияет на многие биохимические процессы. ЛизоФК является внутриклеточным липидным медиатором с активностью, подобной факторам роста. Она быстро продуцируется и высвобождается из активированных тромбоцитов, оказывая влияние на многие клетки-мишени.
Фосфатидилглицерин. При соединении двух молекул фосфатидной кислоты через гидроксил фосфатной группы, образуется молекула фосфатидилглицерина (ФГ) (Рис. 1.1.2.7).
ФГ - отрицательно заряженная молекула при физиологических значениях рН. Этот фосфолипид обладает выраженными поверхностно-активными свойствами, что определяет его локализацию в сурфактанте альвеол вместе с ДПФХ - основным ФЛ легких. Именно выраженные поверхностно-активные свойства ФГ позволяют использовать его как один из компонентов липосомальных носителей ряда лекарств.
Присоединение еще одного фосфоглицеринового фрагмента через гидроксил второй фосфатной группы, приводит к образованию дифосфатидилглицерина, называемого также кардиолипином.
Кардиолипин (КЛ) - представляет собой очень кислую
молекулу, несущую при физиологических значениях рН два отрицательных заряда (-2) (Рис. 1.1.2.8). Этот фосфолипид локализован, главным образом, на внутренней стороне митохондриальной мембраны. Кардиолипин был открыт позже других ФЛ, в 30-х годах прошлого века. Впервые он был выделен и охарактеризован из сердца быка. КЛ присутствует также и в других тканях, однако его распределение в клетке неравномерно, и местом преимущественной локализации являются митохондрии.
Фактор активации тромбоцитов (PAF, platelet activating factor) - 1-алкил-2-ацетил-sn-глицеро-3-фосфохолин - биологически активный аналог ФХ с простой эфирной связью (вместо сложноэфирной связи, как в ФХ) (Рис. 1.1.2.9). Первоначально PAF привлек внимание своей способностью в очень низких концентрациях вызывать агрегацию тромбоцитов, а также оказывать гипертензивное действие. В последующих работах была выявлена его роль как медиатора воспаления, участвующего в патогенезе ряда заболеваний.
21
PAF был первым ФЛ, для которого установлены функции мессенджера, причем процесс передачи сигнала с помощью PAF происходит не в результате прямого воздействия на плазматическую мембрану клетки, а опосредуется через присоединение этой молекулы к специфическим рецепторам. PAF обычно не накапливается в клетках, но синтезируется ими в условиях воспаления в ответ на специфические стимулы. Концентрация PAF в клетках контролируется соответствующими гидролазами, которые неактивны по отношению к наиболее распространенным ФЛ.
PAF функционирует как медиатор гиперчувствительности, острой воспалительной реакции и анафилактического шока. Он синтезируется в ответ на образование комплекса антиген-IgE на поверхности базофилов, нейтрофилов, эозинофилов, макрофагов и моноцитов. Синтез и высвобождение PAF из клетки приводит к агрегации и освобождению серотонина из тромбоцитов. PAF также инициирует реакции "клеточного ответа" в печени, сердце, гладкой мышце, легочной тканях.
Плазмалоген является распространенным представителем формы винилового эфира фосфолипидов (алкильной и алкенильной форм) (Рис. 1.1.2.10 À, Á).
Плазмалогены - важнейшие компоненты миелина и саркоплазматического ретикулума ткани сердца. Холинплазмалогены в изобилии присутствуют в сердечных тканях.
1.1.3.Сфингофосфолипиды.
Âотличие от глицерина, сфингозин содержит одну из двух имеющихся в молекуле глицерофосфолипидов углеводородных цепей (как правило, включающую 15 углеродных атомов). Другая углеводородная цепь в полярных липидах этого типа, представленная остатком ЖК, связана со сфингозином амидной связью (Рис. 1.1.4 А) [17]. Семейство сфинголипидов включает сфингомиелины и гликосфинголипиды (цереброзиды, сульфатиды, глобозиды и ганглиозиды).
Сфингомиелин (СМ) является сфинголипидным аналогом ФХ и по строению представляет собой фосфорилхолиновое производное церамида (церамид фосфорилхолин) (Рис. 1.1.4.Б). Церамид представляет собой длинноцепочечное сфингоидное основание, связанное с жирной кислотой амидной связью.
СМ широко распространен в природе как необходимый компонент мембран животных клеток, в которых он является преобладающим сфинголипидом.
Âнекоторых тканях содержание СМ может составлять до 50%
22
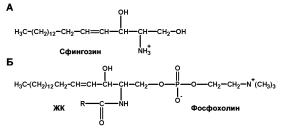
Рис 1.1.4. Химическое строение сфингозина, церамидов и сфинголипидов.
от общего количества липидов, хотя, как правило, в животной клетке его содержится меньше, чем ФХ. Например, около 10% липидов головного мозга составляет СМ. Также, сфингомиелин фактически полностью замещает ФХ в эритроцитах большинства жвачных животных.
Подобно ФХ, сфингомиелин преимущественно локализуется в плазматической мембране, особенно на ее внешней стороне.
Обычно в молекулах СМ содержатся жирные кислоты с очень длинной цепью, содержащей свыше 22 атомов С - насыщенные и мононенасыщенные, в том числе и с нечетным количеством углеродных атомов (что не свойственно глицерофосфолипидам). Долгое время считали, что единственной функцией сфингомиелина является замена ФХ как строительной единицы мембраны [5, 21]. Полагали, что присутствие СМ необходимо для образования стабильной наружной поверхности липидного бислоя плазматической мембраны. Действительно, это одно из свойств СМ. Имеются данные, свидетельствующие о тесной взаимосвязи сфингомиелина и холестерина в клетке [18]. В отличие от мембран других внутриклеточных органелл (например, митохондрий), оба фосфолипида преобладают в плазматической мембране и мембране аппарата Гольджи [18, 19].
Имея разное строение, СМ и ФХ естественно отличаются по физико-химическим свойствам, в частности, по способности образовывать водородные связи. Амидная связь во 2-ом положении остатка спирта сфингозина и гидроксильная группа в положении 3 могут участвовать в формировании водородных связей.
Имеющаяся двойная связь в углеводородной цепи СМ обеспечивает межмолекулярные взаимодействия в мембранах. У ФХ, напротив, две сложноэфирные карбонильные группы могут служить только как акцепторы водорода. СМ существенно отличается от ФХ и по степени ненасыщенности жирнокислотных
23
цепей, так как содержит заметные количества несвойственных другим ФЛ длинноцепочечных насыщенных и моноеновых ЖК.
В настоящее время известно, что СМ (как и другие сфинголипиды) вместе с холестерином составляют основу специфических мембранных доменов, называемых "рафтами" и "кавеолами", которые играют важнейшую роль в механизмах передачи сигналов в клетке (см. главу 2).
Помимо этого, СМ служит предшественником для образования церамидов, длинноцепочечных оснований, сфингозин-1-фосфата (S1P) и многих других важных сфинголипидов. Некоторые из этих соединений выполняют функции внутриклеточных мессенджеров, а другие являются важными составными частями мембраны. Сфинголипиды, поступающие с пищей, гидролизуются в кишечнике до церамидов и длинноцепочечных оснований, которые затем всасываются и метаболизируются.
Считают, что сфинголипиды незаменимы для развития и жизнедеятельности эукариотических клеток [20, 21]. В дополнении к их первичной роли в качестве структурных компонентов биологических мембран, они выполняют важные функции и как вторичные мессенджеры. СМ является компонентом липопротеинов сыворотки крови. Сфинголипиды выполняют регуляторную роль в клетке, участвуя в процессах передачи клеточных сигналов [22, 23]. При этом СМ внутренней поверхности бислоя плазматической мембраны является донором вторичных мессенджеров в сфингомиелиновом цикле [24, 25]. Несмотря на отсутствие данных о потребности организма в
сфинголипидах, включая СМ, как компонентов питания, ориентировочно подсчитано, что потребление сфинголипида на душу населения в США составляет порядка 0,3 - 0,4 г в день. Совсем недавно предположили, что СМ может служить "функциональным" компонентом биологически активных добавок к пище для профилактики ряда заболеваний. В настоящее время появились данные об ингибиторном действии СМ на развитие атеросклероза и рака. Опыты на животных показали, что кормление сфинголипидами ингибирует рост опухоли толстой кишки у крыс, снижает содержание ХС в липопротеинах низкой плотности (ЛНП) в крови и повышает ХС липопротеинов высокой плотности (ЛВП) [26, 27, 28].
Таким образом, фосфолипиды и их метаболиты разнообразны в различных природных объектах. В то же время не все приведенные выше фосфолипидные соединения имеют одинаковое значение и распространенность в клетках животных и человека. Набор наиболее распространенных ФЛ биомембран ограничен
24
несколькими видами. Разнообразие же молекулярных видов мембранных ФЛ осуществляется за счет множественности комбинаций относительно небольшого числа их компонентов - жирных кислот, одного из двух типов полярных головок и типа полярного фрагмента глицерофосфолипида.
1.2. Фосфолипидный состав органов и тканей человека и животных
ФЛ обычно выделяют из тканей путем обработки органическими растворителями с последующим хроматографическим разделением [29].
Практически в любой животной ткани обнаруживается семь основных классов ФЛ (в порядке убывания) - ФХ, ФЭ, СМ, а также, в значительно меньших количествах (менее 10%), ФС, ФИ, лизоФХ и КЛ (рис. 1.1.2).
Одноцепочечные липиды типа лизоФЛ обычно не синтезируются клеткой в значительном количестве, так как они, подобно детергентам, разрушают мембраны. Примером может служить действие лизоФХ, который образуется из ФХ под влиянием фосфолипазы А2. Увеличение концентрации этого ФЛ может привести к распаду клеточных мембран, что и является одной из причин смерти при укусе змеи, яд которой содержит значительные количества фосфолипазы А2.
Âпринципе все ткани млекопитающих содержат схожие ФЛ в близком количественном соотношении [13]. Например, ФЛ нервной ткани высших животных отличаются от ФЛ животных,
стоящих на более низких ступенях эволюции, в основном наличием СМ и ФИ-4-фосфата. В клетках животных организмов суммарное содержание цвиттерионных (электронейтральных) липидов (ФХ+ФЭ+СМ) составляет 75-90% от общего количества фосфолипидов. Существуют некоторые специфические особенности набора ФЛ различных биомембран. Например, в мембранах шванновской клетки мозга отмечается высокое содержание ФИ (10%) и низкое - ФС и ФЭ - 3 и 14%, соответственно [30]. Характерной особенностью мембран эритроцитов крупного рогатого скота является практически полное отсутствие ФХ.
Âтканях животных и человека обнаруживаются и минорные ФЛ. Например, в слоях кожи глазного века человека обнаружены алкил-ацил-ФХ и этаноламин-плазмалогены [31], причем в эпидермисе уровень этих ФЛ снижен на фоне повышенного содержания ФХ. На основании различий в гидрофобности этих ФЛ авторы предполагают, что такой состав ФЛ эпидермиса
25
способствует осуществлению функции эффективного водного барьера. Присутствие ФЛ с простыми эфирными связями (алкилФЛ) отмечается и в эндотелиальных клетках человека [32], а также в миелине и сером веществе мозга крыс [33].
Систематический анализ фосфолипидного состава тканей около 180 видов морских беспозвоночных показал, что все они содержат ФХ, ФЭ, ФС и ФИ в качестве основных компонентов; кроме того, в небольших количествах в мембранах содержатся ФК, КЛ и ФИ-4- фосфат. У более высокоразвитых видов (членистоногие, оболочники, иглокожие) содержание ФХ достигает 65%, в то время как губки, кольчатые черви и моллюски содержат ~30% этого липида [34]. Наиболее ярко систематические различия проявляются в содержании сфинголипидов - в процессе эволюции нарастает содержание СМ. У губок (наименее развитых животных) содержание ФС достигает 25%, причем сфинголипиды отсутствуют совсем [34]. В процессе эволюции беспозвоночных происходило увеличение содержания фосфолипидов с холиновыми группами (ФХ и СМ) и уменьшалось суммарное количество липидов, содержащих аминогруппы (ФЭ, ФС).
Соотношение отдельных классов ФЛ в клетке меняется в различных ситуациях и стадиях жизнедеятельности клетки и организма в целом. Так, при длительной физической нагрузке в скелетных мышцах крысы содержание отдельных ФЛ меняется, причем в различных типах мышц это изменение происходит поразному [35]. Имеются данные о возрастании количества СМ в мембранах ряда клеток при старении [36].
Любой из природных глицерофосфолипидов, например ФХ,
является не индивидуальным веществом, а смесью веществ, молекулы которых содержат одну и ту же полярную часть - фосфохолин, и различные жирнокислотные остатки. Поскольку одна и та же полярная головка может соединяться с разными цепями, открывается возможность огромного числа комбинаций - молекулярных видов. Именно благодаря разнообразию ЖК при выделении какого-либо фосфолипида практически трудно получить его в полностью однородном состоянии, так как полученное вещество будет представлять смесь молекулярных видов данного ФЛ, отличающихся разным набором жирных кислот.
В одном объекте могут сосуществовать более сотни неодинаковых по структуре липидных соединений, причем соотношения между ними специфичны, что предполагает их участие во многих клеточных процессах.
Как уже отмечалось, в природе наиболее распространены следующие виды ЖК: пальмитиновая (16:0), стеариновая (18:0), олеиновая (18:1), линолевая (18:2), арахидоновая (20:4), а также
26
линоленовая (18:3), эйкозопентаеновая (20:5) и докозагексаеновая (22:6) кислоты. В молекуле ФХ эти кислоты связаны с глицерином в двух положениях, поэтому различные сочетания создают возможность существования разных молекул. Если учесть еще менее распространенные виды жирных кислот, то число молекулярных видов еще более возрастает, хотя и ограничивается общим правилом преимущественной (90-95%) локализацией в ФЛ насыщенных и ненасыщенных ЖК в положении sn-1 и в положении sn-2, соответственно. Так, было идентифицировано около 10 основных видов молекул ФХ, различающихся жирнокислотным составом. Например, установлено, что в печени крысы присутствуют около 30% ФХ, содержащего пальмитиновую кислоту (16:0), 18% ФХ с арахидоновой кислотой (20:4), более 16% ФХ, содержащего линолевую кислоту (18:2), почти 50% от общего количества ФИ содержало в положении sn-1 стеариновую кислоту (18:0), а 37% - арахидоновую в положении sn-2, è ò.ä. [37].
Насыщенные жирные кислоты составляют в большинстве ФЛ около 50% (что соответствует почти полному их заполнению положения sn-1 молекулы ФЛ). Кроме того, существует определенная избирательность в предпочтении отдельных жирных кислот отдельными ФЛ [18, 37]. Для ФК, ФХ и ФС это в основном кислота С16:0, а для ФИ - С18:0. Для СМ характерны насыщенные (и мононенасыщенные) кислоты с особо длинной цепью, С24 и более. Линолевая кислота (С18:2) в заметном количестве присутствует в ФС, ФК и ФХ, но больше всего ее в кардиолипине (например, в КЛ печени - 77,5%). Наиболее высокое содержание арахидоновой кислоты
(С20:4) характерно для ФИ.
Разнообразие молекулярных видов ФЛ связано с их участием в метаболических процессах. Так, для тромбоцитов человека показана гетерогенность жирных кислот в разных классах ФЛ. Сочетание пальмитиновой и олеиновой кислот оказалось характерным в основном для ФХ (21% от общего ФХ), в молекулах ФЭ, ФИ и ФС тромбоцитов эта пара ЖК практически не встречается. Сочетание стеариновой и арахидоновой кислот преобладает в молекулах ФЭ и ФИ (71%). Так как арахидоновая кислота является источником тромбоксана, то ее неравномерное распределение между ФЛ указывает на определенную степень селективности в начальном этапе образования тромбоксана и простагландинов: гидролизу фосфолипазой А2 (PLÀ2) подвергаются в первую очередь ФЭ и ФИ [38].
Другой жирнокислотный состав свойственен, например, ФЛ эритроцитов, причем между отдельными видами животных наблюдаются существенные различия. Например, эритроциты
27
человека содержат около 5 различных молекулярных видов ФХ, а в эритроцитах крупного рогатого скота обнаруживаются только следы ФХ; эритроциты человека и крупного рогатого скота содержат около 8 молекулярных видов ФЭ, различающихся как по количественному содержанию, так и по жирнокислотному составу. В ФЭ эритроцитов человека преобладающей ЖК является С16:0, а крупного рогатого скота - С18:1; для СМ, соответственно, С18:0 и С24:0 и т.д. [39]. Состав ЖК, входящих в данный фосфолипид, может изменяться при ряде патологий или при старении [40].
Гульберт с соавт. [41] провели аллометрический анализ состава жирных кислот ФЛ тканей различных классов животных и сгруппировали их в порядке увеличения массы тела животного - от землеройки (с весом порядка 7 г) до крупного рогатого скота (с весом более 370 кг). Оказалось, что по мере увеличения массы тела в ФЛ сердца, мышц, печени и почек снижается содержание n-3 ПНЖК, особенно 22:6, хотя в мозге у всех видов животных отмечалось высокое содержание этих жирных кислот. Авторы выдвигают гипотезу, что содержание 22:6 жирной кислоты в мембранах ФЛ отражает степень метаболической активности.
1.3. Физико-õимические свойства фосфолипидов
Наличие у молекул ФЛ двух частей - сильно полярной "головки" и неполярных жирнокислотных цепей, препятствует их растворимости в воде и других полярных растворителях и
обуславливает их способность образовывать мембраны. Локализация углеводородных цепей ЖК в упорядоченной структуре воды энергетически невыгодна, и именно поэтому ФЛ стремятся к образованию везикулярных или мицеллярных дисперсий (рис. 1.3.1).
На электронных микрофотографиях таких дисперсий обнаружены слоистые структуры, замыкающиеся друг с другом с образованием мембранных оболочек, которые оказались внешне чрезвычайно похожими на мембраны клеток. Вскоре было показано, что если в контактирующем с ФЛ водном растворе присутствуют ионы, то они включаются в образующуюся внутреннюю водную область и удерживаются там длительное время. Это происходит за счет того, что создаваемые фосфолипидами слоистые мембранные оболочки захватывают при замыкании часть водного раствора и обладают свойствами полупроницаемого барьера, легко пропускающего воду, но ограничивающего диффузию растворенных в ней других веществ [42, 43]. ФЛ, являющиеся основными компонентами и
28
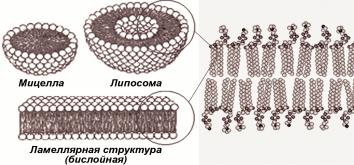
строительными блоками биомембран, могут в водном окружении спонтанно образовывать замкнутые мембранные структуры. Это открытие сыграло большую роль в мембранологии. Энергетически выгодное расположение для таких амфифильных соединений как ФЛ - мономолекулярный слой на поверхности раздела между водой и гидрофобной средой; в таком случае полярные "головки" ориентированы в сторону воды, а жирнокислотные цепи погружены в неполярную среду (рис. 1.3.1). Поэтому в водной среде молекулы ФЛ ассоциируются друг с другом, образуя микроскопические ассоциаты или бислои, в которых расположенные внутри гидрофобные цепи ("хвосты") защищены от воды полярными головками. Стремление максимально ограничить контакт неполярных цепей липида с водой приводит к тому, что бислой при его достаточной протяженности, может замыкаться сам на себя, формируя сферические полые оболочечные структуры, получившие название везикулы.
Рис. 1.3.1. Формы ориентации молекул ФЛ в воде. Образование мицелл, липосом, ламеллярных структур.
Обычно названия "липосомы" и "липидные везикулы" используют как синонимы, но необходимо отметить, что липосомами впервые были названы частицы, образующиеся при механическом диспергировании взвеси ФЛ в воде. В этом случае образуются большого размера (до 50 мкм), состоящие из нескольких десятков липидных бислоев, разделенных водными промежутками (мультиламеллярные) везикулы (липосомы), имеющие недостаточно развитую поверхность [44, 45]. Применение специальных технологий (ультразвук, детергенты и др.) позволяет получить моноламеллярные липосомы с большей поверхностью, диаметром 100 - 200 нм, которые сохраняют
29
некоторое количество захваченной при замыкании водной фазы, окруженной бислойной фосфолипидной оболочкой (рис. 1.3.1). Наиболее мелкие фосфолипидные частицы (менее 100 нм) с высокоразвитой поверхностью, с полярными группами снаружи и жирнокислотными цепями внутри называют мицеллами. В отличие от липосом, они не имеют внутреннего водного объема.
Формы самоорганизации ФЛ в воде определяются зарядом их полярных головок и соотношением объемов, занимаемых головками и неполярными жирнокислотными цепями. Когда эти объемы примерно одинаковы, т. е. когда молекулы липида имеют цилиндрические очертания, преобладает тенденция к образованию бислоя. Если же объем полярной головки больше объема цепей (как, например, у лизоФХ), то молекула по форме приближается к обращенному конусу, и в водном окружении она будет находиться в мицеллярной фазе [46].
Липидная мицелла может быть окружена предпочтительно ионами водорода или гидроксильными группами окружающей ее воды. Поэтому по своим физическим свойствам вода вблизи поверхности мицеллы заметно отличается от остальной.
Способность мембранных липидов образовывать бислойную структуру является следствием их амфипатичности [47].
Склонность ФЛ к ассоциации и формированию бислоев и определяет их функции в живой клетке, где они являются основными "строительными блоками" биомембран всех клеток в живой природе, основным матриксом, куда встроены многочисленные мембранные белки и ферментные системы.
Примером природных липосом является сама клетка и ее органеллы, а липопротеины крови, ответственные за транспорт биоактивных соединений, по строению являются мицеллами.
Первое применение липосом в научных исследованиях было связано с моделированием клеточных мембран. С их помощью были установлены основные закономерности транспорта веществ через мембрану, определены параметры липидного бислоя и его динамические характеристики, изучены процессы слияния мембран. Реконструированные фосфолипидные системы используют для изучения мембранных белков и белковых ансамблей. Фармакологическое применение фосфолипидных частиц (мицелл, липосом) связано с их способностью транспортировать самые разнообразные химические соединения [48-53].
Характерной особенностью фосфолипидных упорядоченных структур является их способность к фазовым переходам. Чистым индивидуальным ФЛ, как и многим химическим соединениям, свойственна определенная температура плавления, называемая
30
