
- •Е. В. Ванчикова, м. А. Рязанов,
- •В. В. Сталюгин
- •Практические работы
- •По физической химии
- •Содержание
- •Числа переноса ионов Электролиз и числа переноса
- •Работа 1 определение чисел переноса ионов в растворе серной кислоты выполнение измерений
- •1 Подготовка медного кулонометра
- •1.1 Подготовка катода
- •2 Приготовление растворов
- •3 Электролиз водного раствора серной кислоты
- •4 Определение количества эквивалентов кислоты в анодном и катодном пространстве
- •4.1 Титрование растворов серной кислоты
- •4.2 Расчет изменения количества кислоты в растворах
- •5 Оценка значения числа переноса сульфат-ионов
- •Работа 2 определение чисел переноса ионов
- •3 Электролиз водного раствора гидроксида натрия
- •4 Определение количества эквивалентов гидроксида натрия в анодном и катодном пространстве
- •4.1 Титрование растворов гидроксида натрия
- •4.2 Расчет изменения количества гидроксида натрия в растворах
- •5 Оценка значения числа переноса ионов натрия
- •Поляризация молекул и молекулярная рефракция
- •1 Законы поляризации молекул
- •2 Рефракция
- •2.1 Аддитивность рефракции
- •2.2 Рефракция растворов
- •3 Показатель преломления
- •4 Молекулярная рефракция раствора
- •5 Дисперсия молярной рефракции
- •Работа 3 опредение рефракции органических соединений выполнение измерений
- •4.2 Измерение показателя преломления вещества
- •4.3 Расчет молекулярной рефракции вещества
- •Работа 4 Определение молекулярной рефракции растворов и оценка эффективного радиуса молекулы растворенного вещества
- •Выполнение измерений
- •1 Приготовление растворов
- •2 Измерение плотности растворов
- •3 Измерение показателя преломления растворов
- •4 Математическая обработка результатов измерений
- •Работа 5 Анализ смеси углеводородов по относительной дисперсии молекулярной рефракции
- •1 Приготовление растворов и измерение показателя преломления
- •2 Оценка значений коэффициентов градуировочной функции
- •3 Определение массовой доли ароматического углеводорода
- •Кинетика гомогенных химических реакций
- •1 Определение молярной концентрации ионов железа (III)
- •2 Определение частного порядка реакции по отношению к ионам железа (III)
- •2.1 Приготовление растворов
- •2.2 Исследование кинетики реакции
- •3 Определение частного порядка по отношению к йодид-ионам
- •3.1 Приготовление растворов
- •3.2 Исследование кинетики реакции
- •3.3 Расчет частного порядка реакции по отношению к йодид-ионам
- •14 Определение порядка реакции окисления йодид-ионов ионами железа (III)
- •Работа 7 Гидролиз сложного эфира в щелочном растворе
- •1 Приготовление раствора гидроксида натрия
- •2 Подготовка вспомогательных средств
- •3 Изучение кинетики реакции
- •3 Математическая обработка результатов исследования системы, в которой с(r1coor2) с(NaOh)
- •3.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •3.2 Расчет константы скорости реакции
- •4.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •4.2 Расчет константы скорости реакции
- •Работа 8 определение константы скорости и энергии активации реакции ГидролизА сложного эфира кондуктометрическим методом
- •1 Оценка значения характеристики ячейки кондуктометра
- •1 Измерение
- •3 Измерение электропроводности исследуемой системы
- •5 Расчет равновесных концентраций компонентов смеси и константы скорости реакции
- •Кинетика гомогенных каталитических химических реакций Работа 9 Определение константы скорости и энергии активации реакции гидролиза сложного эфира в присутствии кислоты
- •Выполнение измерений
- •1 Приготовление раствора сильной кислоты
- •2 Определение молярной концентрации эфира в исследуемой системе
- •3 Определение константы скорости реакции гидролиза сложного эфира при т 30 с
- •4 Определение константы скорости реакции гидролиза сложного эфира при т 45 с
- •4 Оценка энергии активации реакции гидролиза сложного эфира в водном растворе
- •Работа 10 Изучение кинетики реакции гидролиза сахарозы (тростникового сахара)
- •1 Поляризация излучения
- •2 Зависимость угла вращения плоскости поляризации поляризованного излучения от молярной концентрации оптически активного соединения
- •3 Поляриметр
- •1 Определение нулевого положения анализатора
- •2 Приготовление растворов сахарозы и измерение угла вращения
- •2.1 Приготовление и исследование водного раствора сахарозы
- •2.1 Приготовление и исследование кислого раствора сахарозы
- •3 Математическая обработка результатов измерений
- •4 Каталитическая активность кислот
- •Работа 11 Изучение скорости разложения мурексида. Определение константы диссоциации слабой кислоты
- •1 Изучение оптимальных условий измерения оптической плотности растворов
- •1.3 Приготовление рабочего раствора индикатора
- •2 Изучение кинетики разложения мурексида в присутствии сильной кислоты
- •2.1 Приготовление растворов сильной кислоты
- •2.2 Кинетические измерения для реакции разложения мурексида
- •2.3 Расчет константы скорости реакции
- •2.3.2 Метод наименьших квадратов
- •2.4 Оценка значений ko, kH
- •3 Изучение кинетики разложения мурексида в присутствии слабой кислоты
- •3.1 Приготовление растворов слабой кислоты
- •3.2 Кинетические измерения
- •4 Оценка значения константы диссоциации слабой кислоты
- •Работа 12 Йодирование ацетона в кислой среде
- •Выполнение измерений
- •1 Вспомогательные растворы
- •2 Приготовление реакционной смеси
- •3 Определение молярной концентрации эквивалента кислоты в растворе
- •4 Определение молярных концентраций ацетона и йодацетона
- •5 Расчет константы скорости реакции
- •5.1 Расчетный способ
- •5.2 Метод наименьших квадратов
- •Влияние ионной силы на кинетику ионных реакций
- •1 Приготовление раствора индикатора
- •2 Приготовление щелочных растворов соли с различной ионной силой
- •3 Измерение оптической плотности исследуемых растворов индикатора с электролитом
- •4 Математическая обработка результатов измерений
- •4.1 Расчет констант скорости реакции
- •4.2 Расчет ионной силы раствора
- •4.3 Расчет значения параметра а уравнения Дебая – Хюккеля
- •Равновесия в растворах
- •Выполнение измерений
- •1 Приготовление растворов
- •1.1 Основной раствор индикатора
- •1.2 Растворы индикатора, имеющие различное значение рН
- •3 Математическая обработка результатов измерений
- •3.1 Определение числа поглощающих частиц в растворе по числу изобестических точек
- •3.2 Оценка значения константы диссоциации органического реагента
- •Работа 15 Определение рН образоваНия гидроксида металла и его произведения растворимости
- •1 Определение значения рНо
- •1.1 Измерение рН растворов
- •2 Математическая обработка результатов измерений
- •2.1 Определение пр по значению рНо
- •Литература
- •167982, Г. Сыктывкар, ул. Коммунистическая, д. 28
2 Рефракция
Электромагнитная теория Максвелла для прозрачных неполярных веществ приводит к соотношению:
![]() ,
(46)
,
(46)
где
![]() – показатель преломления (для полярных
веществ
– показатель преломления (для полярных
веществ![]() ).
Подставив в уравнение (45) уравнение
(46) и полагая, что
).
Подставив в уравнение (45) уравнение
(46) и полагая, что![]() ,
получаем:
,
получаем:
![]() .
(47)
.
(47)
Величина
![]() называется молекулярной рефракцией
вещества.
называется молекулярной рефракцией
вещества.
Из уравнения (47) следует, что величина R, определяемая через показатель преломления вещества, служит мерой электронной поляризуемости его молекул. Вообще говоря, показатель преломления n зависит от длины волны излучения и равенство строго справедливо для = . Экстраполяция n к n проводится обычно по формуле Коши:
n= n + b/. (48)
Константы b и n определяют, измерив n при двух разных , например F и C линий спектра водорода. В большинстве случаев определяют не R, а RD, измерив nD для желтой D линии натрия.
В физико-химических исследованиях пользуются также удельной рефракцией:
![]() .
(49)
.
(49)
Рефракция имеет размерность объема, отнесенного к определенной порции вещества:
удельная рефракция – (см3/г);
молекулярная – (см3/моль).
Весьма приближенно молекулу можно рассматривать как сферу эффективного радиуса rM с проводящей поверхностью. В этом случае:
![]() .
(50)
.
(50)
Тогда из уравнений (47, 50) получим:
![]() .
(51)
.
(51)
Таким образом, молекулярная рефракция равна собственному объему NA молекул вещества.
Для неполярных
веществ R
![]() ,
для полярных веществ R
меньше
,
для полярных веществ R
меньше ![]() на значение ориентационной поляризации.
на значение ориентационной поляризации.
Как следует из уравнения (47), молекулярная рефракция определяется только поляризуемостью и поэтому не зависит от температуры и агрегатного состояния вещества. Таким образом, рефракция является характеристической константой вещества.
2.1 Аддитивность рефракции
Рефракция – мера поляризуемости молекулярной электронной оболочки. Последняя слагается из оболочек атомов. Поэтому, если приписать определенные значения рефракциям отдельных атомов или ионам, то рефракция молекулы будет равна сумме рефракций атомов или ионов. Рассчитывая рефракцию молекулы через рефракции составляющих ее частиц, следует учитывать также валентные состояния атомов и особенности их расположения, для чего вводят слагаемые – инкременты двойной связи –С=С, тройной связи СС и др., а также поправки на особое положение отдельных атомов и групп в молекуле:
![]() ,
(52)
,
(52)
где
![]() и
и![]() –
атомные рефракции и инкременты связей
соответственно, см3/моль.
–
атомные рефракции и инкременты связей
соответственно, см3/моль.
Значения
![]() и
и![]() приведены
в таблице 3.1.
приведены
в таблице 3.1.
Таблица 3.1– Атомные рефракции и инкременты связей (по Эйзенлору)
|
Атом N в аминах: |
RD, см3/моль |
Атом О |
RD, см3/моль |
Атом C и связи |
RD, см3/моль |
|
первичных |
2.322 |
в гидроксиле |
1.525 |
С |
2.418 |
|
вторичных |
2.502 |
в карбониле |
2.211 |
С=С |
1.733 |
|
третичных |
2.84 |
в эфире |
1.643 |
СС |
2.398 |
|
Атом Н |
1.100 |
|
|
|
-0.55 |
Уравнение (52)
выражает правило аддитивности молекулярной
рефракции. Фигурирующие в таких расчетах
атомные рефракции частично включают
эффекты взаимного влияния атомов в
молекуле соединения и не равны атомным
рефракциям соответствующих простых
веществ. Влияние структуры на молекулярную
рефракцию учитывается введением
различных значений атомной рефракции
одного и того же элемента в разных
группировках (в частности, кислороду и
эфирах, спиртах и карбонильных соединениях
приписываются три разных атомных
рефракции), использованием групповых
рефракций
![]() и
т.д., а также специальных инкрементов
для кратных связей С=С, СС,
обозначаемых как |= , |.
Например, для хлористого аллила
СН2=СН–СН2Cl
молекулярная рефракция равна:
и
т.д., а также специальных инкрементов
для кратных связей С=С, СС,
обозначаемых как |= , |.
Например, для хлористого аллила
СН2=СН–СН2Cl
молекулярная рефракция равна:
RI = 3RC + 5RH + RCl + |= . (53)
Физически более обоснован способ расчета рефракции как суммы рефракций не атомов, а связей (СH, OH, NH, C=O и т.д.), поскольку поляризуются излучением именно валентные электроны, образующие связь (таблица 3.2). В этом случае для хлористого аллила имеем:
RII =5RC-H + RC-C + RC=C + RC-Cl. (54)
Молекулярную рефракцию соединений, построенных из ионов, рассчитывают как сумму ионных рефракций.
Таблица 3.2 – Рефракции связей (по Фогелю)
|
Связь |
RD, см3/моль |
Связь |
RD, см3/моль |
Связь |
RD, см3/моль |
|
СH |
1.676 |
CO |
1.54 |
OH |
1.66 |
|
CC |
1.296 |
CO |
3.32 |
NH |
1.76 |
|
CC |
4.17 |
CN |
1.57 |
CCl |
6.51 |
|
CC (концевая) |
5.87 |
CN |
3.76 |
CBr |
9.39 |
Правило аддитивности (52) может быть использовано для установления строения молекул: сравнивают значение R, найденное экспериментально, с рассчитанным по уравнению (52) для предполагаемой молекулярной структуры. Совпадение значений служит подтверждением предполагаемого строения. Расхождения от 0.2 до 0.4 см3 относят за счет возможных погрешностей опыта и значений аддитивных констант. У ионных соединений небольшие отклонения от аддитивности связаны с взаимной поляризацией ионов.
Наблюдаемое в ряде случаев явление экзальтации рефракции состоит в значительном превышении экспериментального значения R по сравнению с вычисленным по уравнениям (53, 54). Экзальтация указывает на наличие в молекуле сопряженных кратных связей, например,
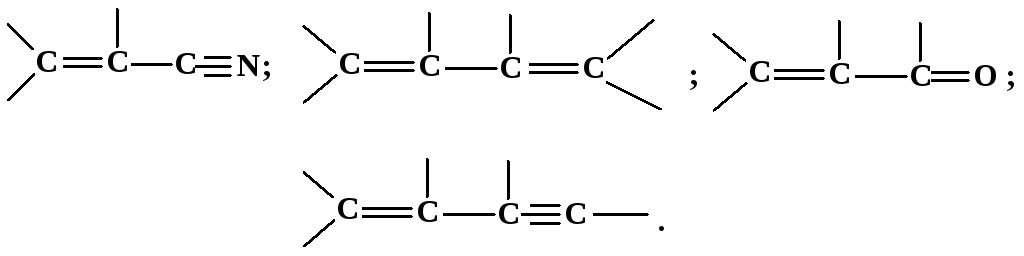
В молекулах с такими связями -электроны принадлежат всем атомам, образующим систему сопряженных связей, и могут свободно перемещаться вдоль этой системы, то есть обладают высокой подвижностью. Они легко смещаются под действием поля, благодаря чему молекула приобретает повышенную поляризуемость и наблюдается экзальтация рефракции.
