
- •Е. В. Ванчикова, м. А. Рязанов,
- •В. В. Сталюгин
- •Практические работы
- •По физической химии
- •Содержание
- •Числа переноса ионов Электролиз и числа переноса
- •Работа 1 определение чисел переноса ионов в растворе серной кислоты выполнение измерений
- •1 Подготовка медного кулонометра
- •1.1 Подготовка катода
- •2 Приготовление растворов
- •3 Электролиз водного раствора серной кислоты
- •4 Определение количества эквивалентов кислоты в анодном и катодном пространстве
- •4.1 Титрование растворов серной кислоты
- •4.2 Расчет изменения количества кислоты в растворах
- •5 Оценка значения числа переноса сульфат-ионов
- •Работа 2 определение чисел переноса ионов
- •3 Электролиз водного раствора гидроксида натрия
- •4 Определение количества эквивалентов гидроксида натрия в анодном и катодном пространстве
- •4.1 Титрование растворов гидроксида натрия
- •4.2 Расчет изменения количества гидроксида натрия в растворах
- •5 Оценка значения числа переноса ионов натрия
- •Поляризация молекул и молекулярная рефракция
- •1 Законы поляризации молекул
- •2 Рефракция
- •2.1 Аддитивность рефракции
- •2.2 Рефракция растворов
- •3 Показатель преломления
- •4 Молекулярная рефракция раствора
- •5 Дисперсия молярной рефракции
- •Работа 3 опредение рефракции органических соединений выполнение измерений
- •4.2 Измерение показателя преломления вещества
- •4.3 Расчет молекулярной рефракции вещества
- •Работа 4 Определение молекулярной рефракции растворов и оценка эффективного радиуса молекулы растворенного вещества
- •Выполнение измерений
- •1 Приготовление растворов
- •2 Измерение плотности растворов
- •3 Измерение показателя преломления растворов
- •4 Математическая обработка результатов измерений
- •Работа 5 Анализ смеси углеводородов по относительной дисперсии молекулярной рефракции
- •1 Приготовление растворов и измерение показателя преломления
- •2 Оценка значений коэффициентов градуировочной функции
- •3 Определение массовой доли ароматического углеводорода
- •Кинетика гомогенных химических реакций
- •1 Определение молярной концентрации ионов железа (III)
- •2 Определение частного порядка реакции по отношению к ионам железа (III)
- •2.1 Приготовление растворов
- •2.2 Исследование кинетики реакции
- •3 Определение частного порядка по отношению к йодид-ионам
- •3.1 Приготовление растворов
- •3.2 Исследование кинетики реакции
- •3.3 Расчет частного порядка реакции по отношению к йодид-ионам
- •14 Определение порядка реакции окисления йодид-ионов ионами железа (III)
- •Работа 7 Гидролиз сложного эфира в щелочном растворе
- •1 Приготовление раствора гидроксида натрия
- •2 Подготовка вспомогательных средств
- •3 Изучение кинетики реакции
- •3 Математическая обработка результатов исследования системы, в которой с(r1coor2) с(NaOh)
- •3.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •3.2 Расчет константы скорости реакции
- •4.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •4.2 Расчет константы скорости реакции
- •Работа 8 определение константы скорости и энергии активации реакции ГидролизА сложного эфира кондуктометрическим методом
- •1 Оценка значения характеристики ячейки кондуктометра
- •1 Измерение
- •3 Измерение электропроводности исследуемой системы
- •5 Расчет равновесных концентраций компонентов смеси и константы скорости реакции
- •Кинетика гомогенных каталитических химических реакций Работа 9 Определение константы скорости и энергии активации реакции гидролиза сложного эфира в присутствии кислоты
- •Выполнение измерений
- •1 Приготовление раствора сильной кислоты
- •2 Определение молярной концентрации эфира в исследуемой системе
- •3 Определение константы скорости реакции гидролиза сложного эфира при т 30 с
- •4 Определение константы скорости реакции гидролиза сложного эфира при т 45 с
- •4 Оценка энергии активации реакции гидролиза сложного эфира в водном растворе
- •Работа 10 Изучение кинетики реакции гидролиза сахарозы (тростникового сахара)
- •1 Поляризация излучения
- •2 Зависимость угла вращения плоскости поляризации поляризованного излучения от молярной концентрации оптически активного соединения
- •3 Поляриметр
- •1 Определение нулевого положения анализатора
- •2 Приготовление растворов сахарозы и измерение угла вращения
- •2.1 Приготовление и исследование водного раствора сахарозы
- •2.1 Приготовление и исследование кислого раствора сахарозы
- •3 Математическая обработка результатов измерений
- •4 Каталитическая активность кислот
- •Работа 11 Изучение скорости разложения мурексида. Определение константы диссоциации слабой кислоты
- •1 Изучение оптимальных условий измерения оптической плотности растворов
- •1.3 Приготовление рабочего раствора индикатора
- •2 Изучение кинетики разложения мурексида в присутствии сильной кислоты
- •2.1 Приготовление растворов сильной кислоты
- •2.2 Кинетические измерения для реакции разложения мурексида
- •2.3 Расчет константы скорости реакции
- •2.3.2 Метод наименьших квадратов
- •2.4 Оценка значений ko, kH
- •3 Изучение кинетики разложения мурексида в присутствии слабой кислоты
- •3.1 Приготовление растворов слабой кислоты
- •3.2 Кинетические измерения
- •4 Оценка значения константы диссоциации слабой кислоты
- •Работа 12 Йодирование ацетона в кислой среде
- •Выполнение измерений
- •1 Вспомогательные растворы
- •2 Приготовление реакционной смеси
- •3 Определение молярной концентрации эквивалента кислоты в растворе
- •4 Определение молярных концентраций ацетона и йодацетона
- •5 Расчет константы скорости реакции
- •5.1 Расчетный способ
- •5.2 Метод наименьших квадратов
- •Влияние ионной силы на кинетику ионных реакций
- •1 Приготовление раствора индикатора
- •2 Приготовление щелочных растворов соли с различной ионной силой
- •3 Измерение оптической плотности исследуемых растворов индикатора с электролитом
- •4 Математическая обработка результатов измерений
- •4.1 Расчет констант скорости реакции
- •4.2 Расчет ионной силы раствора
- •4.3 Расчет значения параметра а уравнения Дебая – Хюккеля
- •Равновесия в растворах
- •Выполнение измерений
- •1 Приготовление растворов
- •1.1 Основной раствор индикатора
- •1.2 Растворы индикатора, имеющие различное значение рН
- •3 Математическая обработка результатов измерений
- •3.1 Определение числа поглощающих частиц в растворе по числу изобестических точек
- •3.2 Оценка значения константы диссоциации органического реагента
- •Работа 15 Определение рН образоваНия гидроксида металла и его произведения растворимости
- •1 Определение значения рНо
- •1.1 Измерение рН растворов
- •2 Математическая обработка результатов измерений
- •2.1 Определение пр по значению рНо
- •Литература
- •167982, Г. Сыктывкар, ул. Коммунистическая, д. 28
Работа 12 Йодирование ацетона в кислой среде
Реакция йодирования ацетона, катализируемая в водных растворах протонами, протекает по стадиям:
CH3
– CO – CH3
+ H+
![]() CH3
– C(OH)+
– CH3,
CH3
– C(OH)+
– CH3,
CH3
– C(OH)+
– CH3
![]() CH3
– C(OH) = CH2
+ H+,
CH3
– C(OH) = CH2
+ H+,
CH3
– C(OH) = CH2
+ I2
![]() CH3
– CO – CH2I
+ H+
+ I-.
(141)
CH3
– CO – CH2I
+ H+
+ I-.
(141)
Реакция сопровождается возрастанием концентрации ионов водорода (катализатора), то есть процесс является автокаталитическим.
Методом квазистационарных концентраций или методом маршрутов покажите, при каких условиях скорость расхода ацетона в реакции йодирования не зависит от концентрации йода и может быть выражена уравнением:
![]() .
(142)
.
(142)
От констант скоростей каких стадий реакции зависит k ?
Обозначим:
а – молярная концентрация ацетона в начальный момент времени, моль/дм3;
b – молярная концентрация эквивалента кислоты в начальный момент времени, моль/дм3;
х – молярная концентрация образовавшегося йодацетона в момент времени t , моль/дм3.
Тогда в момент
времени t:
![]()
Докажите, что в
этот момент времени![]() .
.
Уравнение (142) принимает вид:
![]() ,
(143)
,
(143)
или
![]() .
(144)
.
(144)
Интегрирование этого выражения приводит к уравнению:
![]() ,
(145)
,
(145)
или линейной функции:
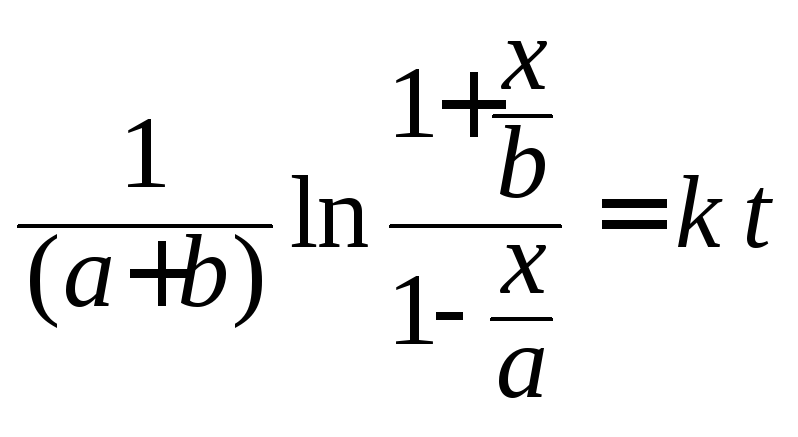 .
(146)
.
(146)
Выполнение измерений
1 Вспомогательные растворы
Готовят две бюретки:
1) с раствором гидроксида натрия (с(NaOH) = 0.2 моль/дм3);
2) с раствором тиосульфата натрия
(с(1/zNa2S2O3) = 0.01 моль/дм3, z = ?).
2 Приготовление реакционной смеси
Содержание ацетона и кислоты в растворе задает преподаватель (таблица 12.1).
Таблица 12.1 – Молярная концентрация эквивалента кислоты и масса ацетона в реакционной смеси
|
Номер системы |
Молярная концентрация эквивалента кислоты |
Масса ацетона |
Объем ацетона |
|
с(H+), моль/дм3 |
m, г |
V, см3 | |
|
1 |
0.10 |
1.45 |
1.8 |
|
2 |
0.11 |
1.60 |
2.0 |
|
3 |
0.12 |
1.74 |
2.2 |
|
4 |
0.13 |
1.89 |
2.4 |
|
5 |
0.14 |
2.03 |
2.6 |
|
6 |
0.15 |
2.18 |
2.8 |
|
7 |
0.16 |
2.32 |
2.9 |
|
8 |
0.17 |
2.47 |
3.1 |
|
9 |
0.18 |
2.61 |
3.3 |
|
10 |
0.19 |
2.76 |
3.5 |
|
11 |
0.20 |
2.90 |
3.7 |
Рассчитывают объем хлороводородной кислоты
(с(HCl) = 1 моль/дм3), необходимый для приготовления 250 см2 раствора кислоты заданной концентрации.
В мерную колбу вместимостью 250 см3 помещают мерной пипеткой 25 см3 раствора, содержащего I2 и KI (с(1/2I2) = 0.1 моль/дм3, (KI ) = 4 %), прибавляют к нему мерным цилиндром рассчитанный объем раствора хлороводородной кислоты. Добавляют дистиллированной воды до объема 220 230 см3 (внимание, не до метки). После этого колбу, закрытую притертой пробкой, помещают в термостат.
Навеску ацетона (таблица 12.1) берут следующим образом: на аналитических весах взвешивают бюкс с притертой пробкой, в который помещено 10 12 см3 дистиллированной воды, затем пипеткой добавляют ацетон и снова взвешивают. Рассчитывают навеску ацетона.
Водный раствор ацетона вливают в мерную колбу с растворами йода и кислоты. Ополаскивают бюкс двумя порциями по 2 3 см3 дистиллированной воды и добавляют их к исследуемой системе. Добавляют дистиллированной воды до метки на колбе, перемешивают раствор.
Включают секундомер.
Помещают колбу с исследуемой системой в термостат, где она находится в течение всего эксперимента (Т = 30 С).
