
- •Е. В. Ванчикова, м. А. Рязанов,
- •В. В. Сталюгин
- •Практические работы
- •По физической химии
- •Содержание
- •Числа переноса ионов Электролиз и числа переноса
- •Работа 1 определение чисел переноса ионов в растворе серной кислоты выполнение измерений
- •1 Подготовка медного кулонометра
- •1.1 Подготовка катода
- •2 Приготовление растворов
- •3 Электролиз водного раствора серной кислоты
- •4 Определение количества эквивалентов кислоты в анодном и катодном пространстве
- •4.1 Титрование растворов серной кислоты
- •4.2 Расчет изменения количества кислоты в растворах
- •5 Оценка значения числа переноса сульфат-ионов
- •Работа 2 определение чисел переноса ионов
- •3 Электролиз водного раствора гидроксида натрия
- •4 Определение количества эквивалентов гидроксида натрия в анодном и катодном пространстве
- •4.1 Титрование растворов гидроксида натрия
- •4.2 Расчет изменения количества гидроксида натрия в растворах
- •5 Оценка значения числа переноса ионов натрия
- •Поляризация молекул и молекулярная рефракция
- •1 Законы поляризации молекул
- •2 Рефракция
- •2.1 Аддитивность рефракции
- •2.2 Рефракция растворов
- •3 Показатель преломления
- •4 Молекулярная рефракция раствора
- •5 Дисперсия молярной рефракции
- •Работа 3 опредение рефракции органических соединений выполнение измерений
- •4.2 Измерение показателя преломления вещества
- •4.3 Расчет молекулярной рефракции вещества
- •Работа 4 Определение молекулярной рефракции растворов и оценка эффективного радиуса молекулы растворенного вещества
- •Выполнение измерений
- •1 Приготовление растворов
- •2 Измерение плотности растворов
- •3 Измерение показателя преломления растворов
- •4 Математическая обработка результатов измерений
- •Работа 5 Анализ смеси углеводородов по относительной дисперсии молекулярной рефракции
- •1 Приготовление растворов и измерение показателя преломления
- •2 Оценка значений коэффициентов градуировочной функции
- •3 Определение массовой доли ароматического углеводорода
- •Кинетика гомогенных химических реакций
- •1 Определение молярной концентрации ионов железа (III)
- •2 Определение частного порядка реакции по отношению к ионам железа (III)
- •2.1 Приготовление растворов
- •2.2 Исследование кинетики реакции
- •3 Определение частного порядка по отношению к йодид-ионам
- •3.1 Приготовление растворов
- •3.2 Исследование кинетики реакции
- •3.3 Расчет частного порядка реакции по отношению к йодид-ионам
- •14 Определение порядка реакции окисления йодид-ионов ионами железа (III)
- •Работа 7 Гидролиз сложного эфира в щелочном растворе
- •1 Приготовление раствора гидроксида натрия
- •2 Подготовка вспомогательных средств
- •3 Изучение кинетики реакции
- •3 Математическая обработка результатов исследования системы, в которой с(r1coor2) с(NaOh)
- •3.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •3.2 Расчет константы скорости реакции
- •4.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •4.2 Расчет константы скорости реакции
- •Работа 8 определение константы скорости и энергии активации реакции ГидролизА сложного эфира кондуктометрическим методом
- •1 Оценка значения характеристики ячейки кондуктометра
- •1 Измерение
- •3 Измерение электропроводности исследуемой системы
- •5 Расчет равновесных концентраций компонентов смеси и константы скорости реакции
- •Кинетика гомогенных каталитических химических реакций Работа 9 Определение константы скорости и энергии активации реакции гидролиза сложного эфира в присутствии кислоты
- •Выполнение измерений
- •1 Приготовление раствора сильной кислоты
- •2 Определение молярной концентрации эфира в исследуемой системе
- •3 Определение константы скорости реакции гидролиза сложного эфира при т 30 с
- •4 Определение константы скорости реакции гидролиза сложного эфира при т 45 с
- •4 Оценка энергии активации реакции гидролиза сложного эфира в водном растворе
- •Работа 10 Изучение кинетики реакции гидролиза сахарозы (тростникового сахара)
- •1 Поляризация излучения
- •2 Зависимость угла вращения плоскости поляризации поляризованного излучения от молярной концентрации оптически активного соединения
- •3 Поляриметр
- •1 Определение нулевого положения анализатора
- •2 Приготовление растворов сахарозы и измерение угла вращения
- •2.1 Приготовление и исследование водного раствора сахарозы
- •2.1 Приготовление и исследование кислого раствора сахарозы
- •3 Математическая обработка результатов измерений
- •4 Каталитическая активность кислот
- •Работа 11 Изучение скорости разложения мурексида. Определение константы диссоциации слабой кислоты
- •1 Изучение оптимальных условий измерения оптической плотности растворов
- •1.3 Приготовление рабочего раствора индикатора
- •2 Изучение кинетики разложения мурексида в присутствии сильной кислоты
- •2.1 Приготовление растворов сильной кислоты
- •2.2 Кинетические измерения для реакции разложения мурексида
- •2.3 Расчет константы скорости реакции
- •2.3.2 Метод наименьших квадратов
- •2.4 Оценка значений ko, kH
- •3 Изучение кинетики разложения мурексида в присутствии слабой кислоты
- •3.1 Приготовление растворов слабой кислоты
- •3.2 Кинетические измерения
- •4 Оценка значения константы диссоциации слабой кислоты
- •Работа 12 Йодирование ацетона в кислой среде
- •Выполнение измерений
- •1 Вспомогательные растворы
- •2 Приготовление реакционной смеси
- •3 Определение молярной концентрации эквивалента кислоты в растворе
- •4 Определение молярных концентраций ацетона и йодацетона
- •5 Расчет константы скорости реакции
- •5.1 Расчетный способ
- •5.2 Метод наименьших квадратов
- •Влияние ионной силы на кинетику ионных реакций
- •1 Приготовление раствора индикатора
- •2 Приготовление щелочных растворов соли с различной ионной силой
- •3 Измерение оптической плотности исследуемых растворов индикатора с электролитом
- •4 Математическая обработка результатов измерений
- •4.1 Расчет констант скорости реакции
- •4.2 Расчет ионной силы раствора
- •4.3 Расчет значения параметра а уравнения Дебая – Хюккеля
- •Равновесия в растворах
- •Выполнение измерений
- •1 Приготовление растворов
- •1.1 Основной раствор индикатора
- •1.2 Растворы индикатора, имеющие различное значение рН
- •3 Математическая обработка результатов измерений
- •3.1 Определение числа поглощающих частиц в растворе по числу изобестических точек
- •3.2 Оценка значения константы диссоциации органического реагента
- •Работа 15 Определение рН образоваНия гидроксида металла и его произведения растворимости
- •1 Определение значения рНо
- •1.1 Измерение рН растворов
- •2 Математическая обработка результатов измерений
- •2.1 Определение пр по значению рНо
- •Литература
- •167982, Г. Сыктывкар, ул. Коммунистическая, д. 28
3 Электролиз водного раствора серной кислоты
Рисунок 1.2 –
Прибор для
электролиза серной
кислоты
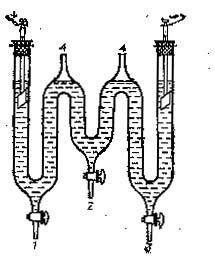
Электролизер (рисунок 1.2) может иметь только одно промежуточное колено (один кран 4).
Заполняют сосуд для электролиза приготовленным раствором серной кислоты, следующим образом.
Краны 1, 2, 3 закрыты.
При открытом кране 4 в оба колена электролизера наливают раствор кислоты до нижнего уровня соединительного канала. Грушей, приставленной к отверстию 4, затягивают раствор до верхнего края соединительного колена и быстро перекрывают кран 4.
В сосуд вставляют свинцовые или угольные электроды.
Собирают установку для проведения электролиза раствора серной кислоты (рисунок 1.3).
|
|
Рисунок 1.3 – Схема цепи для определения чисел переноса |
|
Включают источник постоянного тока.
Проводят электролиз в течение 1.5 часов при силе тока по показанию амперметра 80 мА, включенного дополнительно в цепь установки. Необходимого значения силы тока добиваются увеличением напряжения тока в цепи.
Почему резко упала сила тока в цепи при подключении в нее электролизера с раствором серной кислоты?
Готовят две конические колбы вместимостью 250 см3 – моют их, высушивают и взвешивают на электротехнических весах с точность до второго десятичного разряда.
По окончании электролиза:
– выключают источник электрического тока;
– вынимают электроды;
– открывают кран 4, при этом электролиты в двух коленах электролизера не должны соприкасаться;
– через краны 1, 3 сливают жидкости в предварительно подготовленные колбы для катодного и анодного растворов;
– колбы с растворами снова взвешивают.
4 Определение количества эквивалентов кислоты в анодном и катодном пространстве
4.1 Титрование растворов серной кислоты
Отбирают по три аликвотных части растворов серной кислоты,находившихся ранее в катодном и анодном пространстве, и титруют раствором щелочи (таблица 1.2).
Не следует менять объем раствора, взятый для титрования исходного раствора (п. 2) и растворов, полученных после электролиза.
Таблица 1.2 – Объемы раствора гидроксида натрия, пошедшие на титрование … см3 раствора серной кислоты
|
Раствор серной кислоты до электролиза |
Раствор серной кислоты после электролиза | ||||||||
|
в анодном пространстве |
в катодном пространстве | ||||||||
|
Характеристики объемов раствора гидроксида натрия, пошедших на титрование аликвотной части растворов серной кислоты, см3 | |||||||||
|
повторные определения |
среднее значение |
стандартное отклонение |
повторные определения |
среднее значение |
стандартное отклонение |
повторные определения |
среднее значение |
стандартное отклонение | |
|
Voi |
|
|
VAi |
|
|
VКi |
|
| |
4.2 Расчет изменения количества кислоты в растворах
Расчет изменения количества эквивалентов серной кислоты в анодном и катодном пространстве после электролиза рассчитывают по формуле:
![]() ,
моль; (29)
,
моль; (29)
![]() ,
моль, (30)
,
моль, (30)
где
![]() – объемы раствора гидроксида натрия,
пошедшие на титрование аликвотной части
раствора кислоты: до электролиза, после
электролиза – в анодном и катодном
пространстве соответственно, см3;
– объемы раствора гидроксида натрия,
пошедшие на титрование аликвотной части
раствора кислоты: до электролиза, после
электролиза – в анодном и катодном
пространстве соответственно, см3;
mA, mK – масса раствора серной кислоты в катодном и анодном пространстве электролизера, г;
с(ОН-) – молярная концентрация гидроксида натрия в титранте, моль/дм3;
А, K – плотность растворов серной кислоты в анодном и катодном пространстве соответственно, А K 1 г/см3;
Va – аликвотная часть раствора кислоты, взятая для анализа, см3.

