
- •Е. В. Ванчикова, м. А. Рязанов,
- •В. В. Сталюгин
- •Практические работы
- •По физической химии
- •Содержание
- •Числа переноса ионов Электролиз и числа переноса
- •Работа 1 определение чисел переноса ионов в растворе серной кислоты выполнение измерений
- •1 Подготовка медного кулонометра
- •1.1 Подготовка катода
- •2 Приготовление растворов
- •3 Электролиз водного раствора серной кислоты
- •4 Определение количества эквивалентов кислоты в анодном и катодном пространстве
- •4.1 Титрование растворов серной кислоты
- •4.2 Расчет изменения количества кислоты в растворах
- •5 Оценка значения числа переноса сульфат-ионов
- •Работа 2 определение чисел переноса ионов
- •3 Электролиз водного раствора гидроксида натрия
- •4 Определение количества эквивалентов гидроксида натрия в анодном и катодном пространстве
- •4.1 Титрование растворов гидроксида натрия
- •4.2 Расчет изменения количества гидроксида натрия в растворах
- •5 Оценка значения числа переноса ионов натрия
- •Поляризация молекул и молекулярная рефракция
- •1 Законы поляризации молекул
- •2 Рефракция
- •2.1 Аддитивность рефракции
- •2.2 Рефракция растворов
- •3 Показатель преломления
- •4 Молекулярная рефракция раствора
- •5 Дисперсия молярной рефракции
- •Работа 3 опредение рефракции органических соединений выполнение измерений
- •4.2 Измерение показателя преломления вещества
- •4.3 Расчет молекулярной рефракции вещества
- •Работа 4 Определение молекулярной рефракции растворов и оценка эффективного радиуса молекулы растворенного вещества
- •Выполнение измерений
- •1 Приготовление растворов
- •2 Измерение плотности растворов
- •3 Измерение показателя преломления растворов
- •4 Математическая обработка результатов измерений
- •Работа 5 Анализ смеси углеводородов по относительной дисперсии молекулярной рефракции
- •1 Приготовление растворов и измерение показателя преломления
- •2 Оценка значений коэффициентов градуировочной функции
- •3 Определение массовой доли ароматического углеводорода
- •Кинетика гомогенных химических реакций
- •1 Определение молярной концентрации ионов железа (III)
- •2 Определение частного порядка реакции по отношению к ионам железа (III)
- •2.1 Приготовление растворов
- •2.2 Исследование кинетики реакции
- •3 Определение частного порядка по отношению к йодид-ионам
- •3.1 Приготовление растворов
- •3.2 Исследование кинетики реакции
- •3.3 Расчет частного порядка реакции по отношению к йодид-ионам
- •14 Определение порядка реакции окисления йодид-ионов ионами железа (III)
- •Работа 7 Гидролиз сложного эфира в щелочном растворе
- •1 Приготовление раствора гидроксида натрия
- •2 Подготовка вспомогательных средств
- •3 Изучение кинетики реакции
- •3 Математическая обработка результатов исследования системы, в которой с(r1coor2) с(NaOh)
- •3.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •3.2 Расчет константы скорости реакции
- •4.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •4.2 Расчет константы скорости реакции
- •Работа 8 определение константы скорости и энергии активации реакции ГидролизА сложного эфира кондуктометрическим методом
- •1 Оценка значения характеристики ячейки кондуктометра
- •1 Измерение
- •3 Измерение электропроводности исследуемой системы
- •5 Расчет равновесных концентраций компонентов смеси и константы скорости реакции
- •Кинетика гомогенных каталитических химических реакций Работа 9 Определение константы скорости и энергии активации реакции гидролиза сложного эфира в присутствии кислоты
- •Выполнение измерений
- •1 Приготовление раствора сильной кислоты
- •2 Определение молярной концентрации эфира в исследуемой системе
- •3 Определение константы скорости реакции гидролиза сложного эфира при т 30 с
- •4 Определение константы скорости реакции гидролиза сложного эфира при т 45 с
- •4 Оценка энергии активации реакции гидролиза сложного эфира в водном растворе
- •Работа 10 Изучение кинетики реакции гидролиза сахарозы (тростникового сахара)
- •1 Поляризация излучения
- •2 Зависимость угла вращения плоскости поляризации поляризованного излучения от молярной концентрации оптически активного соединения
- •3 Поляриметр
- •1 Определение нулевого положения анализатора
- •2 Приготовление растворов сахарозы и измерение угла вращения
- •2.1 Приготовление и исследование водного раствора сахарозы
- •2.1 Приготовление и исследование кислого раствора сахарозы
- •3 Математическая обработка результатов измерений
- •4 Каталитическая активность кислот
- •Работа 11 Изучение скорости разложения мурексида. Определение константы диссоциации слабой кислоты
- •1 Изучение оптимальных условий измерения оптической плотности растворов
- •1.3 Приготовление рабочего раствора индикатора
- •2 Изучение кинетики разложения мурексида в присутствии сильной кислоты
- •2.1 Приготовление растворов сильной кислоты
- •2.2 Кинетические измерения для реакции разложения мурексида
- •2.3 Расчет константы скорости реакции
- •2.3.2 Метод наименьших квадратов
- •2.4 Оценка значений ko, kH
- •3 Изучение кинетики разложения мурексида в присутствии слабой кислоты
- •3.1 Приготовление растворов слабой кислоты
- •3.2 Кинетические измерения
- •4 Оценка значения константы диссоциации слабой кислоты
- •Работа 12 Йодирование ацетона в кислой среде
- •Выполнение измерений
- •1 Вспомогательные растворы
- •2 Приготовление реакционной смеси
- •3 Определение молярной концентрации эквивалента кислоты в растворе
- •4 Определение молярных концентраций ацетона и йодацетона
- •5 Расчет константы скорости реакции
- •5.1 Расчетный способ
- •5.2 Метод наименьших квадратов
- •Влияние ионной силы на кинетику ионных реакций
- •1 Приготовление раствора индикатора
- •2 Приготовление щелочных растворов соли с различной ионной силой
- •3 Измерение оптической плотности исследуемых растворов индикатора с электролитом
- •4 Математическая обработка результатов измерений
- •4.1 Расчет констант скорости реакции
- •4.2 Расчет ионной силы раствора
- •4.3 Расчет значения параметра а уравнения Дебая – Хюккеля
- •Равновесия в растворах
- •Выполнение измерений
- •1 Приготовление растворов
- •1.1 Основной раствор индикатора
- •1.2 Растворы индикатора, имеющие различное значение рН
- •3 Математическая обработка результатов измерений
- •3.1 Определение числа поглощающих частиц в растворе по числу изобестических точек
- •3.2 Оценка значения константы диссоциации органического реагента
- •Работа 15 Определение рН образоваНия гидроксида металла и его произведения растворимости
- •1 Определение значения рНо
- •1.1 Измерение рН растворов
- •2 Математическая обработка результатов измерений
- •2.1 Определение пр по значению рНо
- •Литература
- •167982, Г. Сыктывкар, ул. Коммунистическая, д. 28
3.2 Расчет константы скорости реакции
В соответствии с
принятыми обозначениями уравнение для
константы скорости реакции второго
порядка при условии
![]() имеет вид:
имеет вид:
![]() .
(90)
.
(90)
Для каждого момента времени рассчитывают константу скорости реакции. Если в начале реакции скорость значимо отличается от следующих значений, при расчете средней скорости реакции ее не учитывают.
4 Математическая обработка результатов исследования системы, в которой с(R1COOR2) = с(NaOH)
4.1 Расчет молярной концентрации исходных веществ и продуктов реакции
Обозначение всех физических величин такое же, как в п. 3.1.
В исследуемой системе a = b.
Равенство молярных концентраций эфира и гидроксида натрия доказано, если добавленная в систему серная кислота не израсходована на избыток гидроксида натрия (выполнено соотношение количеств кислоты и основания приt=).
Рассчитывают молярные концентрации всех участников реакции (таблица 7.3), исходя из следующих соотношений:
(91)
(92)
(93)
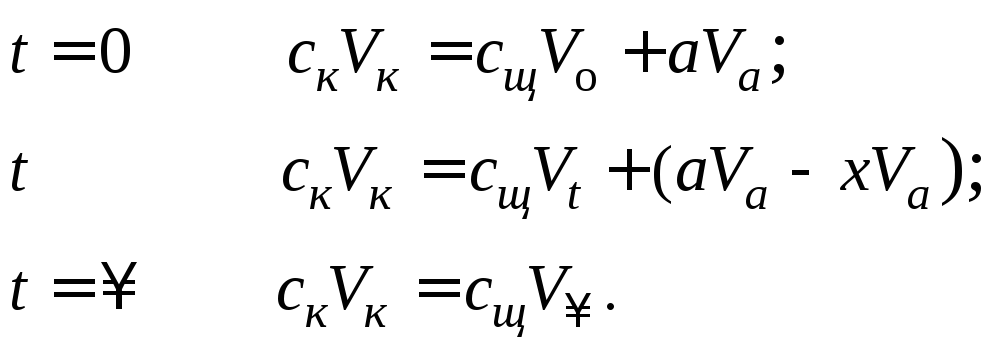
Если при t = равенство количеств кислоты и гидроксида натрия в титранте не наблюдается, то возможны две причины:
1) исходная система приготовлена неправильно, один из продуктов реакции взят в избытке. В этом случае математическую обработку результатов исследования проводят согласно п. 3;
2) реакция не прошла до конца.
Изображают зависимости молярных концентраций участников реакции от времени.
Таблица 7.3 – Молярные концентрации сложного эфира, щелочи,
ацетата натрия и этилового спирта
|
Вре-мя |
Объем титранта |
Молярные концентрации с(Х), моль/дм3 |
Константа скорости реакции, с-1моль-1дм3 | |||||
|
t, с |
Vщ, см3 |
R1COOR2 |
NaOH |
R1COONa |
R2OH |
k |
|
|
4.2 Расчет константы скорости реакции
При условии a = b уравнение для константы скорости реакции второго порядка имеет вид:
![]() .
(94)
.
(94)
Для каждого момента времени рассчитывают константу скорости реакции. Если в начале реакции скорость значимо отличается от следующих значений, при расчете средней скорости реакции ее не учитывают.
Работа 8 определение константы скорости и энергии активации реакции ГидролизА сложного эфира кондуктометрическим методом
Реакция омыления сложного эфира в щелочном растворе протекает по уравнению:
CH3COOC2H5 + NaOH CH3COONa + C2H5OH (95)
с образованием спирта и соли органической кислоты.
В разбавленном водном растворе реакция протекает бимолекулярно и практически до конца. Изменение концентрации реагирующих веществ может быть определено по значению электропроводности раствора.
В процессе реакции ионы гидроксила заменяются анионами соли. Подвижности последних значительно меньше, чем у ионов гидроксила, в результате чего электропроводность раствора по мере прохождения реакции уменьшается.
Удельная электропроводность раствора (), обозначаемая буквой «каппа» – величина, обратная удельному сопротивлению раствора (Rуд):
![]() .
(96)
.
(96)
Так как удельное сопротивление выражают в Ом см, то удельную электропроводность – в Ом-1см-1.
В СИ для удельной электропроводности введена единица –
Смсм-1 (сименс на сантиметр). В основных единицах СИ
См м-2кг-1с3А2.
Ленц ввел величину – эквивалентная электропроводность ():
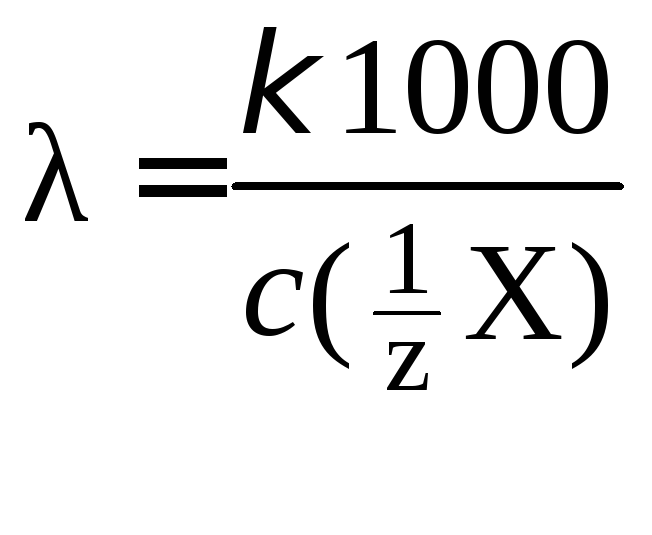 ,
(97)
,
(97)
где ![]() – молярная
концентрация эквивалента вещества в
растворе, моль/дм3.
– молярная
концентрация эквивалента вещества в
растворе, моль/дм3.
Следовательно, выражают в см2Ом-1моль-1 или в Смсм2моль-1.
Электропроводность растворов сильных электролитов обусловлена движением ионов, поэтому введена величина – эквивалентная электропроводность или подвижность ионов.
Согласно теории Дебая-Онзагера, подвижность одновалентных ионов в разбавленных водных растворах может быть связана с суммарной молярной концентрацией всех ионов в растворе уравнением:
![]() ,
(98)
,
(98)
где ![]() –
подвижность иона при бесконечном
разбавлении, Смсм2моль-1;
–
подвижность иона при бесконечном
разбавлении, Смсм2моль-1;
![]() –суммарная
молярная концентрация всех ионов в
растворе, моль/дм3.
–суммарная
молярная концентрация всех ионов в
растворе, моль/дм3.
Коэффициент А учитывает замедление движения ионов под действием электрического поля за счет движущихся навстречу противоположно заряженных ионов:
 ,
(99)
,
(99)
где z – заряд иона;
eo = 1.60210-16 Кл (Ас) – элементарный заряд;
NA = 6.0221023 моль-1 – постоянная Авогадро;
– вязкость воды, Пас (м-1кгс-1);
о = 8.85410-12 Ф/м (Ф м-2кг-1с4А2) – диэлектрическая проницаемость вакуума;
– диэлектрическая проницаемость воды;
k = 1.38110-23 Дж/К (м2кгс-2K-1);
Т – температура, К.
Подставив все постоянные значения в уравнение (99), получаем выражение для А:
![]() , Смм2моль-1/(моль/
дм3)1/2.
(100)
, Смм2моль-1/(моль/
дм3)1/2.
(100)
которое в условиях эксперимента, устанавливает зависимость А только от диэлектрической проницаемости растворителя – воды, вязкости воды и абсолютной температуры.
Внимание! В таблице 8.1 подвижность иона выражена в Смсм2моль-1, поэтому и значение коэффициента А необходимо выразить в Смсм2моль-1/(моль/ дм3)1/2.
При температуре 25 С А = 60.4 Смсм2моль-1/(моль/ дм3)1/2.
Согласно закону Кольрауша о независимости движения ионов в разбавленном растворе (закону аддитивности эквивалентной электропроводности при бесконечном разбавлении) эквивалентная электропроводность электролитов в растворе равна сумме подвижностей ионов:
![]() .
(101)
.
(101)
Современные кондуктометры позволяют измерить удельную электропроводность раствора ( , См/см), которая связана с эквивалентной, обусловленной несколькими ионами, уравнением:
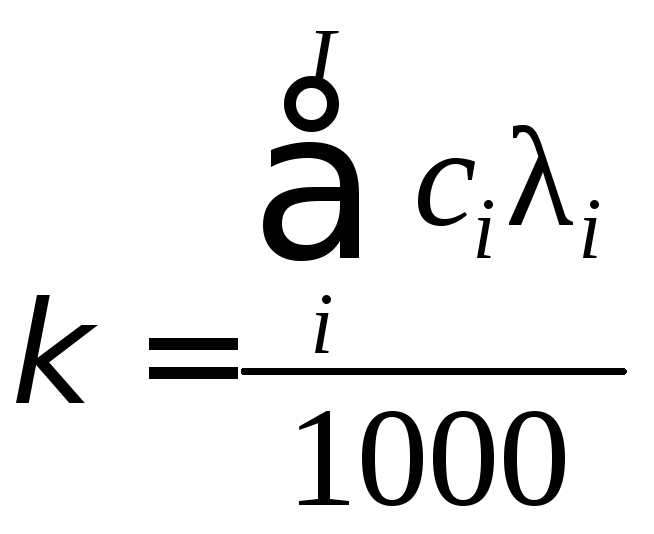 ,
(102)
,
(102)
где ci – молярная концентрация i-того иона, моль/дм3;
i – подвижность иона, Смсм2моль-1.
В исследуемой системе присутствуют ионы: Na+, OH-, CH3COO-.
Обозначим:
а – исходная молярная концентрация гидроксида натрия в исследуемой системе, моль/дм3;
b – исходная молярная концентрация сложного эфира в исследуемой системе, моль/дм3;
x – молярная концентрация ацетата натрия в момент времени t, моль/дм3.
Тогда молярные концентрации ионов равны:
с(Na+) = а, с(OH-) = а-х , с(CH3COO-) = х, (103)
![]() ,
(104)
,
(104)
где С – суммарная молярная концентрация всех ионов в растворе, моль/дм3.
Из уравнений (101, 102) следует:
Для начала реакции (t = 0):
![]() (105)
(105)
В момент времени t:
![]()
Решая систему уравнений (105, 106) получим:
![]() (107)
(107)
Внимание!
![]() – удельную электропроводность раствора
в начальный и промежуточный момент
времени выражают в Смсм-1;
– удельную электропроводность раствора
в начальный и промежуточный момент
времени выражают в Смсм-1;
![]() –
подвижность ионов выражают в Смсм2моль-1.
–
подвижность ионов выражают в Смсм2моль-1.
В таблице 8.1 приведены значения подвижностей ионов при температуре Т = 25 С.
Подвижность ионов при другой температуре рассчитывают по формуле:
![]() ,
(108)
,
(108)
где – коэффициент, зависящий от природы иона (таблица 8.1).
Таблица 8.1– Подвижности ионов при температуре Т = 25 С
|
Ион |
Подвижность ионов |
Коэффициент |
|
|
| |
|
Na+ |
50.1 |
0.0024 |
|
OH- |
198.3 |
0.0180 |
|
HCOO- |
54.6 |
0,0200 |
|
CH3COO- |
40.9 |
0.0206 |
|
CH3CH2COO- |
32.6 |
0.0200 |
|
CH3CH2CH2COO- |
35.8 |
0.0200 |
В соответствии с
принятыми обозначениями уравнение для
константы скорости реакции второго
порядка при условии
![]() имеет вид:
имеет вид:
![]() .
(109)
.
(109)
Выполнение измерений
