
- •Е. В. Ванчикова, м. А. Рязанов,
- •В. В. Сталюгин
- •Практические работы
- •По физической химии
- •Содержание
- •Числа переноса ионов Электролиз и числа переноса
- •Работа 1 определение чисел переноса ионов в растворе серной кислоты выполнение измерений
- •1 Подготовка медного кулонометра
- •1.1 Подготовка катода
- •2 Приготовление растворов
- •3 Электролиз водного раствора серной кислоты
- •4 Определение количества эквивалентов кислоты в анодном и катодном пространстве
- •4.1 Титрование растворов серной кислоты
- •4.2 Расчет изменения количества кислоты в растворах
- •5 Оценка значения числа переноса сульфат-ионов
- •Работа 2 определение чисел переноса ионов
- •3 Электролиз водного раствора гидроксида натрия
- •4 Определение количества эквивалентов гидроксида натрия в анодном и катодном пространстве
- •4.1 Титрование растворов гидроксида натрия
- •4.2 Расчет изменения количества гидроксида натрия в растворах
- •5 Оценка значения числа переноса ионов натрия
- •Поляризация молекул и молекулярная рефракция
- •1 Законы поляризации молекул
- •2 Рефракция
- •2.1 Аддитивность рефракции
- •2.2 Рефракция растворов
- •3 Показатель преломления
- •4 Молекулярная рефракция раствора
- •5 Дисперсия молярной рефракции
- •Работа 3 опредение рефракции органических соединений выполнение измерений
- •4.2 Измерение показателя преломления вещества
- •4.3 Расчет молекулярной рефракции вещества
- •Работа 4 Определение молекулярной рефракции растворов и оценка эффективного радиуса молекулы растворенного вещества
- •Выполнение измерений
- •1 Приготовление растворов
- •2 Измерение плотности растворов
- •3 Измерение показателя преломления растворов
- •4 Математическая обработка результатов измерений
- •Работа 5 Анализ смеси углеводородов по относительной дисперсии молекулярной рефракции
- •1 Приготовление растворов и измерение показателя преломления
- •2 Оценка значений коэффициентов градуировочной функции
- •3 Определение массовой доли ароматического углеводорода
- •Кинетика гомогенных химических реакций
- •1 Определение молярной концентрации ионов железа (III)
- •2 Определение частного порядка реакции по отношению к ионам железа (III)
- •2.1 Приготовление растворов
- •2.2 Исследование кинетики реакции
- •3 Определение частного порядка по отношению к йодид-ионам
- •3.1 Приготовление растворов
- •3.2 Исследование кинетики реакции
- •3.3 Расчет частного порядка реакции по отношению к йодид-ионам
- •14 Определение порядка реакции окисления йодид-ионов ионами железа (III)
- •Работа 7 Гидролиз сложного эфира в щелочном растворе
- •1 Приготовление раствора гидроксида натрия
- •2 Подготовка вспомогательных средств
- •3 Изучение кинетики реакции
- •3 Математическая обработка результатов исследования системы, в которой с(r1coor2) с(NaOh)
- •3.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •3.2 Расчет константы скорости реакции
- •4.1 Расчет молярной концентрации исходных веществ и продуктов реакции
- •4.2 Расчет константы скорости реакции
- •Работа 8 определение константы скорости и энергии активации реакции ГидролизА сложного эфира кондуктометрическим методом
- •1 Оценка значения характеристики ячейки кондуктометра
- •1 Измерение
- •3 Измерение электропроводности исследуемой системы
- •5 Расчет равновесных концентраций компонентов смеси и константы скорости реакции
- •Кинетика гомогенных каталитических химических реакций Работа 9 Определение константы скорости и энергии активации реакции гидролиза сложного эфира в присутствии кислоты
- •Выполнение измерений
- •1 Приготовление раствора сильной кислоты
- •2 Определение молярной концентрации эфира в исследуемой системе
- •3 Определение константы скорости реакции гидролиза сложного эфира при т 30 с
- •4 Определение константы скорости реакции гидролиза сложного эфира при т 45 с
- •4 Оценка энергии активации реакции гидролиза сложного эфира в водном растворе
- •Работа 10 Изучение кинетики реакции гидролиза сахарозы (тростникового сахара)
- •1 Поляризация излучения
- •2 Зависимость угла вращения плоскости поляризации поляризованного излучения от молярной концентрации оптически активного соединения
- •3 Поляриметр
- •1 Определение нулевого положения анализатора
- •2 Приготовление растворов сахарозы и измерение угла вращения
- •2.1 Приготовление и исследование водного раствора сахарозы
- •2.1 Приготовление и исследование кислого раствора сахарозы
- •3 Математическая обработка результатов измерений
- •4 Каталитическая активность кислот
- •Работа 11 Изучение скорости разложения мурексида. Определение константы диссоциации слабой кислоты
- •1 Изучение оптимальных условий измерения оптической плотности растворов
- •1.3 Приготовление рабочего раствора индикатора
- •2 Изучение кинетики разложения мурексида в присутствии сильной кислоты
- •2.1 Приготовление растворов сильной кислоты
- •2.2 Кинетические измерения для реакции разложения мурексида
- •2.3 Расчет константы скорости реакции
- •2.3.2 Метод наименьших квадратов
- •2.4 Оценка значений ko, kH
- •3 Изучение кинетики разложения мурексида в присутствии слабой кислоты
- •3.1 Приготовление растворов слабой кислоты
- •3.2 Кинетические измерения
- •4 Оценка значения константы диссоциации слабой кислоты
- •Работа 12 Йодирование ацетона в кислой среде
- •Выполнение измерений
- •1 Вспомогательные растворы
- •2 Приготовление реакционной смеси
- •3 Определение молярной концентрации эквивалента кислоты в растворе
- •4 Определение молярных концентраций ацетона и йодацетона
- •5 Расчет константы скорости реакции
- •5.1 Расчетный способ
- •5.2 Метод наименьших квадратов
- •Влияние ионной силы на кинетику ионных реакций
- •1 Приготовление раствора индикатора
- •2 Приготовление щелочных растворов соли с различной ионной силой
- •3 Измерение оптической плотности исследуемых растворов индикатора с электролитом
- •4 Математическая обработка результатов измерений
- •4.1 Расчет констант скорости реакции
- •4.2 Расчет ионной силы раствора
- •4.3 Расчет значения параметра а уравнения Дебая – Хюккеля
- •Равновесия в растворах
- •Выполнение измерений
- •1 Приготовление растворов
- •1.1 Основной раствор индикатора
- •1.2 Растворы индикатора, имеющие различное значение рН
- •3 Математическая обработка результатов измерений
- •3.1 Определение числа поглощающих частиц в растворе по числу изобестических точек
- •3.2 Оценка значения константы диссоциации органического реагента
- •Работа 15 Определение рН образоваНия гидроксида металла и его произведения растворимости
- •1 Определение значения рНо
- •1.1 Измерение рН растворов
- •2 Математическая обработка результатов измерений
- •2.1 Определение пр по значению рНо
- •Литература
- •167982, Г. Сыктывкар, ул. Коммунистическая, д. 28
Работа 10 Изучение кинетики реакции гидролиза сахарозы (тростникового сахара)
Реакция гидролиза сахарозы протекает с образованием глюкозы и фруктозы:
C12H22O11 + H2O C6H12O6 + C6H12O6 (124)
сахароза глюкоза фруктоза

глюкоза фруктоза
Реакция бимолекулярная. Поскольку молярная концентрация воды в водном растворе во много раз больше чем сахарозы, то ее изменение в процессе реакции будет незначимым по сравнению с изменением концентрации сахарозы. Поэтому скорость реакции гидролиза сахарозы будет пропорциональна практически только молярной концентрации сахарозы и кинетическим уравнением реакции будет уравнение реакции первого порядка.
Обозначим:
a – молярная концентрация сахарозы в реагирующей смеси в момент времени t = 0, моль/дм3;
х – молярная концентрация глюкозы или фруктозы в последующие моменты времени t, моль/дм3.
Тогда кинетическое уравнение реакции:
![]() ,
(125)
,
(125)
где k – константа скорости реакции, с-1;
t – время протекания реакции, с.
Реакция гидролиза сахарозы в водном растворе практически не идет. Её катализируют ионами водорода, добавляя в раствор сахарозы раствор сильной минеральной кислоты. Реакция очень удобна для изучения, так как сама сахароза и продукты гидролиза обладают асимметрическим атомом углерода и являются оптически активными. Поэтому за ходом данной реакции легко следить при помощи прибора – поляриметра (или сахариметра), принцип работы которого основан на применении поляризованного света.
1 Поляризация излучения
Излучение, имеющее длину волны от 350 до 900 нм (видимая область спектра) называют светом.
При распространении световой волны вектор напряженности электромагнитного поля обычно колеблется по всевозможным направлениям, перпендикулярным к линии распространения светового луча. Однако при определенных условиях направления этих колебаний становятся параллельными друг другу – в этом случае говорят, что свет плоско поляризован. Согласно электромагнитной теории распространения света магнитное возмущение происходит в плоскости поляризации, а электрическое возмущение – под прямым углом к магнитному. Для упрощения схемы рассмотрения колебаний в поляризованном луче совместим все параллельные плоскости в одну. Если луч естественного (неполяризованного) света пропустить через кристалл исландского шпата по направлению его кристаллографической оси, то он расщепляется на два луча, причем оба становятся плоско поляризованными, а плоскости их поляризации взаимно перпендикулярны. Каждый из этих лучей может быть снова раздвоен при прохождении через кристалл исландского шпата и так далее.
При определении показателя преломления этого кристалла изучали прохождение через него излучения возбужденного атома натрия (натриевая линия D). Для каждого из двух лучей было найдено, что для одного из них (называемого обыкновенным лучом) показатель преломления имеет постоянное значение, равное 1.658, а для другого (называемого необыкновенным лучом) показатель преломления изменяется в диапазоне от 1.486 до 1.658 в зависимости от направления, по которому луч распространяется в кристалле.
Оба луча (обыкновенный и необыкновенный) можно отделить друг от друга при помощи призмы Николя. Эту призму, для краткости называемую просто николем, изготавливают следующим образом: ромбический кристалл исландского шпата распиливают по плоскости, проходящей через вершины его тупых углов и делящей кристалл на две симметричные части; затем плоскости полируют и склеивают опять в одно целое при помощи канадского бальзама.
На рисунке 10.1 изображена плоскость сечения кристалла ABCD. Прямая линия AO показывает направление оптической оси кристалла; луч PQ при входе в кристалл у поверхности AD преломляется; преломленный луч оказывается наклоненным к оптической оси под углом около 75 , причем необыкновенный луч испытывает меньшее отклонение вследствие меньшего показателя преломления и проходит по направлению PQRS. Так как обыкновенный луч имеет больший показатель преломления, то он отклоняется по направлению QX и встречается с плоскостью AC под большим углом, чем необыкновенный луч.
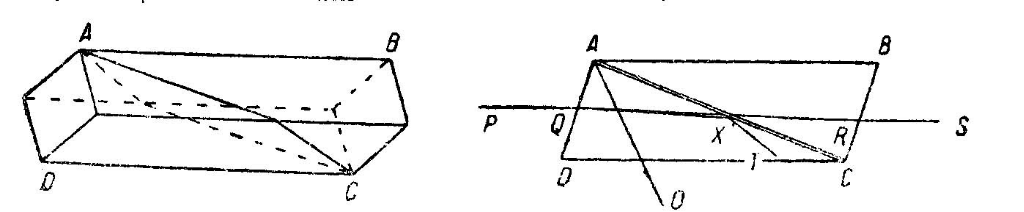 Рисунок 10.1 –
Схема прохождения света через призму
Николя.
Рисунок 10.1 –
Схема прохождения света через призму
Николя.
Таким образом, николь разделяет на две части падающий на него свет, а вышедший через грань BC луч оказывается плоско поляризованным. Если этот луч падает на второй николь, поставленный также как и первый, то поляризованный луч пройдет через него. Если же второй николь повернут на 90 , то поляризованный свет претерпевает полное внутреннее отражение и выходит через боковую грань; в результате указанный луч не пройдет через второй николь. При повороте второго николя на угол меньший 90 плоско поляризованный луч разделяется вторым николем на два луча, и только один из них пройдет через призму. Таким образом, при повороте второго николя в любом направлении на 180 интенсивность света, прошедшего через эту призму, уменьшается от максимального значения до нуля, а затем снова возрастает от нуля до прежнего значения.
Если николи перекрещены, то есть они взаимно ориентированы так, что через второй николь свет не проходит, то при введении определенных веществ между двумя николями часть излучения проходит через второй николь. Вещества, обладающие указанным свойством, называют оптически активными и говорят, что они вращают плоскость поляризации. В подобных случаях первый николь, из которого выходит поляризованный луч, называется поляризатором, а второй николь, позволяющий определить поляризован ли падающий на него свет – анализатором.
При введении между скрещенными николями оптически активного вещества свет может быть снова потушен путем поворота анализатора на небольшой угол. В одних случаях этот поворот приходится производить вправо, а в других влево. Соответственно, этим поворотам вращение плоскости поляризации называют правым или левым. Если свет потухает при вращении анализатора вправо на 15 , то тот же эффект может наблюдаться в результате вращения анализатора влево на 165 ; однако при определении направления вращения имеется всегда в виду меньший из двух углов поворота.
Значение угла вращения плоскости поляризации зависит от природы вещества, от толщины взятого слоя, от длины волны примененного света, от температуры, а в случае растворов – дополнительно от концентрации растворенного вещества и от природы растворителя.
