
- •Оглавление
- •Введение
- •Лабораторная работа № 3
- •1. Теоретическая часть
- •1.1. Давление насыщенного пара индивидуальных жидкостей
- •3. Контрольные вопросы
- •Лабораторная работа № 4 Диаграммы плавкости двухкомпонентных систем
- •1.2.1. Диаграмма плавкости двухкомпонентных систем
- •1.2.2. Диаграмма плавкости двухкомпонентных систем при
- •1.2.3. Диаграмма плавкости двухкомпонентных систем с устойчивым
- •Химическим соединением
- •1.2.4. Диаграмма плавкости двухкомпонентных систем с
- •1.2 Правило рычага
- •Зависимость температур начала и окончания кристаллизации от состава систем
- •3. Контрольные вопросы
- •Лабораторная работа № 7 Закон распределения
- •1. Теоретическая часть
- •1.1. Закон распределения
- •2. Экспериментальная часть
- •2.1. Содержание работы
- •2.3. Экстракция уксусной кислоты из водного раствора органическим
- •3. Контрольные вопросы
- •Лабораторная работа №8 Изучение взаимной растворимости жидкостей в трехкомпонентной системе
- •1. Теоретическая часть
- •1.1 Изображение равновесий в трехкомпонентных
- •2. Экспериментальная часть
- •2.1 Содержание работы
- •2.2. Методика проведения эксперимента и обработка результатов
- •3. Контрольные вопросы
- •Лабораторная работа №10 Химическая кинетика
- •1. Теоретическая часть
- •1.1. Скорость химической реакции
- •Если в системе протекает химическая реакция
- •1.2 Классификация реакций. Порядок реакций
- •Например, реакция
- •1.2.2. Односторонние реакции второго порядка
- •1.3. Влияние температуры на скорость реакции
- •2.1. Механизм реакции и ее кинетическое уравнение
- •2.2. Содержание работы
- •2.2.2. Порядок выполнения работы
- •2.2.3 Обработка результатов эксперимента
- •3. Контрольные вопросы
- •Лабораторная работа № 12 Электрическая проводимость растворов электролитов
- •1. Теоретическая часть
- •1.1. Электрическая проводимость растворов электролитов
- •1.2. Особенности электрической проводимости сильных электролитов
- •2. Экспериментальная часть
- •2.1 Содержание работы
- •2.2.1. Относительный метод определения удельной электрической проводимости
- •Электрохимические характеристики сильного электролита в водном растворе
- •3. Контрольные вопросы
- •Удельная электрическая проводимость водных растворов хлорида калия kCl (Ом-1∙см-1)
- •Предельная эквивалентная электрическая проводимость ионов при 250с и температурные коэффициенты *
- •Лабораторная работа № 14 Гальванические элементы
- •1. Теоретическая часть
- •1.3. Уравнение Нернста для расчета потенциалов электродов
- •1.4. Уравнение Нернста для расчета электродвижущей силы
- •1.5. Термодинамика гальванического элемента
- •1.6. Классификация электродов
- •1.6.1. Электроды первого рода
- •1.6.2. Электроды второго рода
- •1.6.3. Газовые электроды
- •1.6.4. Окислительно-восстановительные электроды
- •1.6.5. Ионно-селективные электроды
- •2. Экспериментальная часть
- •2.1. Содержание работы
- •2.2. Порядок выполнения работы
- •2.2.1. Определение потенциалов отдельных электродов
- •2.2.2. Определение эдс гальванических элементов
- •3. Контрольные вопросы
- •Стандартные электродные потенциалы некоторых электродов
- •Средние ионные коэффициенты активности γ± растворов сильных электролитов
- •Правила техники безопасности
- •Список Литературы
- •Практикум по дисциплине "физическая химия"
- •400131 Волгоград, просп. Им. В. И. Ленина, 28.
- •400131 Волгоград, ул. Советская, 35.
Зависимость температур начала и окончания кристаллизации от состава систем
|
№ смеси |
Состав смеси, % |
Температура начала кристаллизации, оС |
Температура окончания кристаллизации (температура кристаллизации эвтектики), оС | |
|
|
| |||
|
1 |
|
|
|
|
|
…….. |
|
|
|
|
|
8 |
|
|
|
|
По полученным данным строится диаграмма плавкости. Построение диаграммы производится на основе изложенного в данном методическом указании материала (глава 1.2 и раздел 1.2.1).
Предусмотрен вариант выполнения лабораторной работы № 4 с применением записи кривых охлаждения на компьютере. В этом случае осуществляется одновременный нагрев до полного расплавления систем указанного состава, помещенных в специальный блок, а затем одновременное охлаждение сосудов с веществами, помещенных в блок, в емкости с охлаждающей смесью. Инструкция выполнения лабораторной работы в этом случае выдается студентам дополнительно.
3. Контрольные вопросы
Что такое гетерогенные системы?
Что такое фазовые превращения?
Понятие о химическом потенциале.
Условия фазовых равновесий.
Что называется фазой, компонентом, числом степеней свободы?
Как определяется число независимых компонентов?
Правило фаз Гиббса.
Что такое диаграммы фазовых состояний?
В чем состоят принцип непрерывности и принцип соответствия, используемые при анализе диаграмм фазового состояния?
Что такое кривые охлаждения? Как их получают и какую информацию можно получить с их помощью?
Построение диаграмм плавкости. Типы диаграмм плавкости .
Какие линии на диаграмме плавкости называются линиями ликвидуса и солидуса? Что они выражают?
Что такое эвтектика?
Анализ диаграмм плавкости, представленных в методическом указании.
Применение правила фаз Гиббса при анализе диаграмм плавкости.
Применение правила рычага.
Лабораторная работа № 7 Закон распределения
Цель работы: изучение закона распределения вещества между двумя несмешивающимися жидкостями. Определение коэффициента распределения уксусной кислоты между водой и органическими растворителями.
1. Теоретическая часть
1.1. Закон распределения
В системах, состоящих из двух фаз, вещества распределяются определенным образом. Если к системе из двух взаимно нерастворимых или ограниченно растворимых жидкостей добавить компонент i так, чтобы не образовалась новая фаза, то он в соответствии со своей растворимостью распределится между жидкостями, и в системе установится равновесие. Условием равновесия при распределении вещества между двумя фазами является равенство химических потенциалов этого вещества в одной и другой фазе:
i(I) = i(II), (7.1)
где i(I) и i(II) – химические потенциалы компонента i в первом и втором растворителях.
Химический потенциал компонента i (i) при следующих условиях: P = const, T = const, – это энергия Гиббса (G), приходящаяся на 1 моль индивидуального i-го вещества в сложной однородной смеси. Он определяется как частная производная от энергии Гиббса по количеству i-го вещества при p, Т = const и постоянном количестве остальных индивидуальных веществ в системе:
![]()
 (7.2)
(7.2)
Разность величин i определяет направление химических реакций, фазовых превращений, диффузии веществ из одной фазы в другую.
Рассмотрим распределение компонента i между двумя несмешивающимися или ограниченно смешивающимися жидкостями.
Химический потенциал компонента в растворе определяется соотношением:
i=i0 + RT ln ai, (7.3)
где ai – термодинамическая активность компонента в растворе;
iо – стандартный химический потенциал (при ai = 1).
Термодинамическая активность представляет собой такую величину, через которую химический потенциал компонента реального раствора выражается также, как и величины i в идеальных растворах через концентрацию. Активность компонента в растворе связана с его концентрацией (ci) уравнением:
![]() , (7.4)
, (7.4)
где i – коэффициент активности компонента в растворе, характеризующий степень отклонения свойств реальных растворов вследствие взаимодействия составляющих их компонентов от свойств идеальных растворов.
Подстановка величины термодинамической активности вместо концентрации в уравнения, установленные для идеальных растворов, делает эти уравнения пригодными для описания свойств реальных растворов. Для идеальных растворов (разбавленных и совершенных) = 1, и активность совпадает с концентрацией.
После подстановки в равенство (7.1) выражений для химического потенциала распределяемого компонента в первом и во втором растворах получим:
![]() (7.5)
(7.5)
где i0(I), i0(II) – стандартные химические потенциалы компонента в первом и втором растворах;
ai(I), ai(II) – активности компонента i в первом и втором растворах.
Отсюда
 . (7.6)
. (7.6)
При постоянной температуре все члены в правой части уравнения постоянны. Следовательно,
 (7.7)
(7.7)
где io – разность стандартных потенциалов распределяемого вещества в первом и втором растворах, зависящая от природы всех трех компонентов.
Из соотношения (7.7) следует:
 (7.8)
(7.8)
или
 (7.9)
(7.9)
Уравнение (7.9) является выражением закона распределения: компонент, добавленный к системе, состоящей из двух других взаимно нерастворимых или ограниченно растворимых жидкостей, распределяется между ними в определенном, постоянном при данной температуре отношении. Величина Ко называется термодинамической константой распределения. Уравнение (7.9) показывает, что термодинамическая константа распределения не зависит от активностей распределяемого вещества в обоих растворителях, так как при изменении активности компонента в одном растворе изменится активность этого компонента и в другом растворе системы, а их отношение при данной температуре сохранится.
Уравнение закона распределения с учетом выражения для активностей компонента (7.4) можно записать в иной форме:
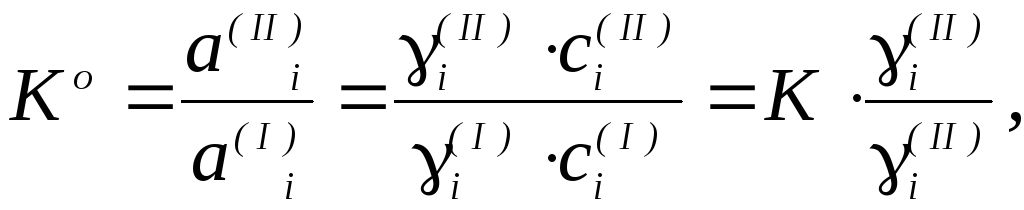 (7.10)
(7.10)
где
![]() – коэффициент распределения.
(7.11)
– коэффициент распределения.
(7.11)
Коэффициентом распределения называется отношение общей концентрации вещества в одной жидкой фазе к его концентрации во второй жидкой фазе в условиях равновесия.
Так как коэффициенты активности зависят от концентрации компонентов в растворе, а величина Ко постоянна для данной системы при Т = const, то коэффициент распределения меняется с изменением концентраций распределяемого вещества в двух равновесных жидких фазах. Для разбавленных растворов (сi(I) 0, сi(II) 0) коэффициенты активности i(II) 1 и i(I) 1,
тогда:
 . (7.12)
. (7.12)
В этом случае коэффициент распределения не зависит от концентраций распределяемого вещества в растворах.
Коэффициент распределения, а, в общем случае, термодинамическая константа распределения зависят от природы распределяемого вещества, растворителей (фаз) и от температуры (Т).
Если распределяемое вещество ассоциирует или диссоциирует в растворителях, то в случае образования разбавленных растворов закон распределения может быть записан в следующей форме:
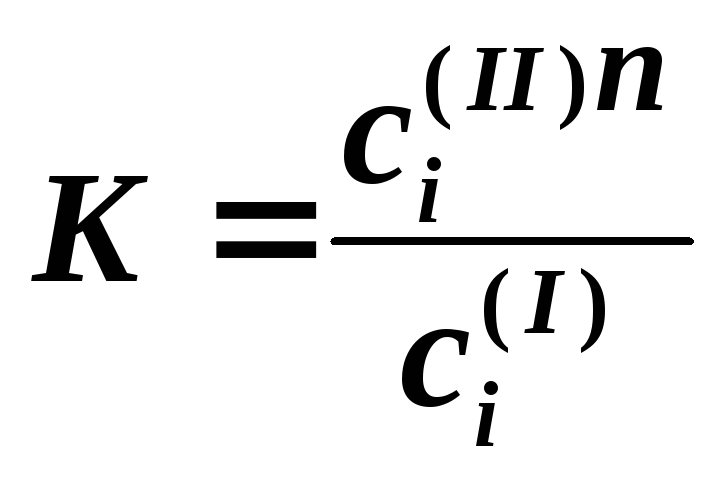 , (7.13)
, (7.13)
где n – величина, постоянная для данной системы при постоянной температуре, определяемая соотношением:
![]() (7.14)
(7.14)
где М1 и М2 – молекулярные массы распределяемого вещества, соответственно, в первом и втором растворителях.
Для разбавленных растворов справедливо соотношение:
 ,
(7.15)
,
(7.15)
где 1 и 2 – степени диссоциации или ассоциации распределенного вещества соответственно, в первой и второй фазах.
Все отклонения от законов идеальных растворов формально учитываются коэффициентами активности. Поэтому, если известны активности распределяемого компонента в двух растворителях, то уравнением (7.9) можно пользоваться также и при наличии диссоциации или ассоциации молекул в растворе.
Закон распределения относится не только к распределению вещества между двумя жидкостями, но имеет более общий характер. Так, известный закон Генри является частным случаем рассматриваемого закона и описывает распределение вещества между газом и жидкостью:
![]() (7.16)
(7.16)
где КГ – константа Генри;
Р – парциальное давление газа над жидкостью;
с – концентрация газа в насыщенном растворе (растворимость).
Закон справедлив и в случае распределения вещества между контактирующими твердой и жидкой фазами при наступлении состояния равновесия. В последнем случае закон распределения имеет вид:
 (7.17)
(7.17)
где сiтв и сiж – концентрации распределяемого вещества в твердой и жидкой фазах при равновесии.
Зависимость константы распределения от температуры, как и для любых других констант равновесия в случае процесса при Р = const описывается уравнением изобары Вант-Гоффа:
![]() (7.18)
(7.18)
где Н – изменение энтальпии (теплового эффекта) при переходе растворенного вещества из одной фазы в другую.
При Н > 0 (эндотермический процесс) с увеличением Т константа распределения возрастает; при Н < 0 (экзотермический процесс) с увеличением Т константа распределения уменьшается.
Закон распределения был сформулирован и разработан В. Нернстом, А. А. Яковкиным, Н. А. Шиловым.
Закон распределения имеет важное теоретическое и практическое значение. С использованием этого закона можно определять степень диссоциации и ассоциации растворенного вещества в том или ином растворителе; активности и коэффициенты активности веществ; константы равновесия химических реакций, протекающих в одной из фаз, и другие величины. Этот закон обосновывает один из важнейших препаративных и технологических процессов – экстракцию.
Экстракция
Экстракция – извлечение растворенного вещества из раствора при помощи другого растворителя (экстрагента), практически не смешивающегося с исходным раствором.
Экстракция широко применяется в лабораториях и производстве для выделения в более концентрированном состоянии какой-либо составной части раствора или для удаления нежелательной составной части (очистки) исходного раствора. Экстракция может быть однократной или многоступенчатой (с применением на каждой ступени свежей порции растворителя – экстрагента). При одноступенчатой экстракции исходный раствор, содержащий извлекаемое вещество, перемешивается до наступления равновесия с экстрагентом. После отстаивания экстрагент с извлеченным веществом (экстракт) отделяется от раствора с оставшимся количеством растворенного вещества (рафината).
На основании закона распределения можно рассчитать количество вещества gn, которое остается в растворе после n экстракций одинаковым объемом экстрагента. Если пренебречь изменениями объемов несмешивающихся растворов, то при установлении равновесия для первой ступени экстракции для разбавленных растворов при отсутствии диссоциации или ассоциации имеем:
![]() (7.19)
(7.19)
где go – количество извлекаемого вещества в исходном растворе;
g1 – количество извлекаемого вещества, оставшегося в растворе (рафинате) после однократной экстракции;
(go–g1) – количество вещества, перешедшее в экстрагент при равновесии;
V1 – объем раствора, из которого извлекается вещество;
V2 – объем экстрагента.
Из выражения (7.19) количество вещества, оставшегося в исходном растворе после однократной экстракции, может быть рассчитано по формуле:
![]() . (7.20)
. (7.20)
Можно показать, что количество вещества, оставшегося в растворе после n экстракций составляет:
 . (7.21)
. (7.21)
При однократном экстрагировании одним общим объемом nV2 в растворе в соответствии с формулой (7.20) остается следующее количество вещества:
![]() .
(7.22)
.
(7.22)
Анализ уравнений (7.21) и (7.22) показывает, что многократное экстрагирование порциями растворителя более эффективно, чем однократное экстрагирование общим объемом экстрагента – растворителя. Это связано с тем, что при каждой новой экстракции раствор с извлекаемым веществом приводится в контакт со свежей порцией экстрагента. В химической технологии многократную экстракцию заменяют экстракцией в противотоке, что обеспечивает эффективное извлечение веществ из растворов.
При жидкостной экстракции коэффициентом распределения условились называть отношения концентрации вещества в экстракте к его концентрации в рафинате. Величины коэффициентов распределения приводятся в справочниках.
Закон распределения имеет большое значение для анализа процессов, проходящих в условиях соприкосновения несмешивающихся фаз. Расплавы металлов и шлаков представляют собой несмешивающиеся жидкости, между которыми распределяются различные растворяющиеся в них элементы и соединения. Распределение происходит в соответствии с коэффициентами распределения компонентов, зависящими от качественного и количественного состава систем. Шлак по отношению к металлическому расплаву выступает в роли экстрагента, извлекающего из металла такие вредные примеси как сера и фосфор. Это используется для рафинирования (очистки) металлов. Одним из наиболее эффективных методов глубокой очистки металлов является зонная плавка. Метод основан на явлении распределения примеси между контактирующими в процессе плавления твердым металлом и его расплавом, приводящим к переходу примесей в жидкую фазу и получению в результате специальной технологии высокочистых металлов.
Метод экстракции широко используется не только в химической и металлургической промышленности, но и в фармацевтической промышленности, в атомной технологии и радиохимии, в аналитической химии. Применение экстракции позволяет в ряде случаев улучшить экологические характеристики производственных процессов.
