
- •Оглавление
- •Введение
- •Лабораторная работа № 3
- •1. Теоретическая часть
- •1.1. Давление насыщенного пара индивидуальных жидкостей
- •3. Контрольные вопросы
- •Лабораторная работа № 4 Диаграммы плавкости двухкомпонентных систем
- •1.2.1. Диаграмма плавкости двухкомпонентных систем
- •1.2.2. Диаграмма плавкости двухкомпонентных систем при
- •1.2.3. Диаграмма плавкости двухкомпонентных систем с устойчивым
- •Химическим соединением
- •1.2.4. Диаграмма плавкости двухкомпонентных систем с
- •1.2 Правило рычага
- •Зависимость температур начала и окончания кристаллизации от состава систем
- •3. Контрольные вопросы
- •Лабораторная работа № 7 Закон распределения
- •1. Теоретическая часть
- •1.1. Закон распределения
- •2. Экспериментальная часть
- •2.1. Содержание работы
- •2.3. Экстракция уксусной кислоты из водного раствора органическим
- •3. Контрольные вопросы
- •Лабораторная работа №8 Изучение взаимной растворимости жидкостей в трехкомпонентной системе
- •1. Теоретическая часть
- •1.1 Изображение равновесий в трехкомпонентных
- •2. Экспериментальная часть
- •2.1 Содержание работы
- •2.2. Методика проведения эксперимента и обработка результатов
- •3. Контрольные вопросы
- •Лабораторная работа №10 Химическая кинетика
- •1. Теоретическая часть
- •1.1. Скорость химической реакции
- •Если в системе протекает химическая реакция
- •1.2 Классификация реакций. Порядок реакций
- •Например, реакция
- •1.2.2. Односторонние реакции второго порядка
- •1.3. Влияние температуры на скорость реакции
- •2.1. Механизм реакции и ее кинетическое уравнение
- •2.2. Содержание работы
- •2.2.2. Порядок выполнения работы
- •2.2.3 Обработка результатов эксперимента
- •3. Контрольные вопросы
- •Лабораторная работа № 12 Электрическая проводимость растворов электролитов
- •1. Теоретическая часть
- •1.1. Электрическая проводимость растворов электролитов
- •1.2. Особенности электрической проводимости сильных электролитов
- •2. Экспериментальная часть
- •2.1 Содержание работы
- •2.2.1. Относительный метод определения удельной электрической проводимости
- •Электрохимические характеристики сильного электролита в водном растворе
- •3. Контрольные вопросы
- •Удельная электрическая проводимость водных растворов хлорида калия kCl (Ом-1∙см-1)
- •Предельная эквивалентная электрическая проводимость ионов при 250с и температурные коэффициенты *
- •Лабораторная работа № 14 Гальванические элементы
- •1. Теоретическая часть
- •1.3. Уравнение Нернста для расчета потенциалов электродов
- •1.4. Уравнение Нернста для расчета электродвижущей силы
- •1.5. Термодинамика гальванического элемента
- •1.6. Классификация электродов
- •1.6.1. Электроды первого рода
- •1.6.2. Электроды второго рода
- •1.6.3. Газовые электроды
- •1.6.4. Окислительно-восстановительные электроды
- •1.6.5. Ионно-селективные электроды
- •2. Экспериментальная часть
- •2.1. Содержание работы
- •2.2. Порядок выполнения работы
- •2.2.1. Определение потенциалов отдельных электродов
- •2.2.2. Определение эдс гальванических элементов
- •3. Контрольные вопросы
- •Стандартные электродные потенциалы некоторых электродов
- •Средние ионные коэффициенты активности γ± растворов сильных электролитов
- •Правила техники безопасности
- •Список Литературы
- •Практикум по дисциплине "физическая химия"
- •400131 Волгоград, просп. Им. В. И. Ленина, 28.
- •400131 Волгоград, ул. Советская, 35.
Химическим соединением
Соответствующий ей состав характеризует состав химического соединения АxBy. Для этой точки состав расплава совпадает с составом кристаллов, выделяющихся при охлаждении системы. Чем выше положение максимума на диаграмме, тем устойчивее образующееся химическое соединение. По обе стороны максимума находятся две эвтектики. Диаграмму плавкости в данном случае можно рассматривать как состоящую из двух самостоятельных диаграмм для следующих систем: компонент А – химическое соединение AxBy и компонент В – химическое соединение AxBy. В каждой системе имеется своя эвтектика с соответствующей температурой ее кристаллизации, что отражено на диаграмме. На областях диаграммы, представленной на рис. 4.4, указаны фазы, которые находятся в равновесии при соответствующих составах систем и температурах.
1.2.4. Диаграмма плавкости двухкомпонентных систем с
неустойчивым химическим соединением при неограниченной
растворимости компонентов в жидком состоянии и отсутствии
растворимости в твердом состоянии
При образовании компонентами А и В химического соединения AxBy, плавящегося с разложением (инконгруэнтно), на линии ликвидуса диаграммы плавкости (рис.4.5) возникает перегиб, отмеченный точкой Р.
Инконгруэнтно плавящееся химическое соединение AxBy устойчиво только ниже температуры ТP. Поэтому при повышении температуры выше ТP это твердое соединение распадается с образованием двух фаз, в данном случае: кристаллов компонента В и расплава соответствующего состава. Точка перегиба Р называется перитектической, и ей соответствует равновесие:
расплав + ВТВ. ↔ AxBy ТВ.. (4.7)

Рис. 4.5. Диаграмма плавкости с инконгруэнтно
плавящимся химическим соединением
В отличие от эвтектической точки, в которой одновременно выпадают две твердые фазы, в перитектической точке одна твердая фаза (соединение AxBy) выпадает, а другая (выпавшие ранее кристаллы вещества В) растворяется. Система в этой точке и на всей перитектической прямой РТР нонвариантная S = 2 – 3 + 1 = 0). Пунктирной линией (со скрытым максимумом) на диаграмме показано возможное положение сингулярной области.
На представленной в качестве примера диаграмме для рассматриваемого случая (рис. 4.5) указаны фазы, которые находятся в равновесии при соответствующих составах систем и температурах.
1.2 Правило рычага
С помощью диаграмм фазового состояния можно определять не только составы и виды равновесных фаз, но и количественные соотношения между ними. Это делается с помощью правила рычага: отношение количества одной фазы к количеству другой фазы, находящейся с ней в равновесии, равно обратному отношению отрезков на коноде, разделенной точкой, характеризующей общий состав системы.
Рассмотрим применение правила рычага для гетерогенных (двухфазных) систем, диаграммы которых представлены на рис. 4.6.
Фигуративной точке М (рис. 4.6а) соответствуют две фазы, находящиеся в равновесии: кристаллы А (точка Т1) и расплав состава, соответствующего точке N. В соответствии с правилом рычага:
масса кристаллов А MN
–––––––––––––––––– = –––– . (4.8)
масса расплава T1M
Фигуративной точке Р (рис. 4.6в) соответствуют две фазы, находящиеся в равновесии: расплав состава, соответствующего точке С, и кристаллы состава, соответствующего точке D. Находим соотношение между этими фазами по правилу рычага:
масса кристаллов РС
––––––––––––––––– = –––– (4.9)
масса расплава РD
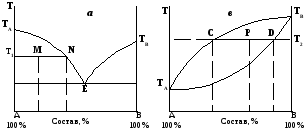
Рис.4.6. Диаграммы плавкости двухкомпонентных систем.
Применение правила рычага
Знание рассчитанного соотношения между фазами позволяет найти при известном составе равновесных фаз количество каждого компонента в равновесных системах.
2. Экспериментальная часть
В настоящей лабораторной работе исследуется одна из двухкомпонентных неизоморфных систем: нафталин – фенол или нафталин – дифениламин (по заданию преподавателя), для которых характерны диаграммы с эвтектикой. Определение температур начала и окончания кристаллизации индивидуальных веществ и их смесей определяют с помощью кривых охлаждения, получаемых в координатах температура – время. Кривые охлаждения получают следующим образом. В штативе на лабораторном столе находятся пронумерованные герметично закрытые стеклянные пробирки с исследуемыми смесями известного состава (указывается в таблице, прилагаемой к лабораторной установке). При комнатной температуре индивидуальные вещества и двухкомпонентные системы находятся в твердом агрегатном состоянии. Для снятия кривых охлаждения пробирки с веществами нагревают до полного расплавления (образования однофазной прозрачной системы) в водяной бане. Затем пробирки с расплавами охлаждают с постоянной скоростью. При этом осуществляется контроль за температурой охлаждаемых образцов с помощью термопар, помещенных в пробирки. Сигнал с термопары подается на вход потенциометра с устройством, позволяющим непосредственно записывать зависимость температуры охлаждаемых образцов от времени на диаграммной ленте. Термопары подключаются к потенциометру с помощью специального переключателя, установленного на лабораторном столе.
Перед началом работы необходимо включить потенциометр в сеть и поставить тумблер “прибор” в положение “включено”. Затем в стакан с водой, нагретой на электрической плитке, помещают пробирку с исследуемой смесью. Уровень воды в стакане должен быть таким, чтобы пробирка была погружена на 2/3 своей высоты. Необходимо следить за тем, чтобы вода не попадала в пробирки с веществами. Переключателем, установленном на лабораторном столе, подключают термопару соответствующей пробирки к потенциометру (номер пробирки и номер позиции указателя на переключателе должны совпадать). При этом указатель температуры на потенциометре покажет температуру исследуемой системы (в оС). Когда содержимое пробирки расплавится, и температура расплава повысится еще на 5–10оС, включают на потенциометре для записи кривой охлаждения тумблер с указателем “диаграмма” и вынимают пробирку из стакана с горячей водой. Горячую пробирку сначала помещают в штатив, охлаждая на воздухе, а затем опускают в стакан с охлажденной до 8–10оС водой (смесь готовится из воды с добавлением кусочков льда).
Запись кривых охлаждения для индивидуальных веществ следует продолжать до тех пор, пока температура системы не станет на 10–15 оС ниже температуры их кристаллизации, а для смесей – до фиксирования температуры окончания кристаллизации эвтектики (15–20 оС). При записи кривых охлаждения необходимо следить за тем, чтобы перфорация диаграммной ленты попадала в зубцы ведущего барабана, а в перо самописца поступали чернила. Кривая на диаграммной ленте должна помечаться соответствующей цифрой. Необходимо следить за температурой и уровнем воды в стакане с охлаждающей смесью. При необходимости в стакан добавляется лед, а излишек воды сливается. После снятия кривой охлаждения пробирку с исследованной смесью ставят в штатив и приступают к изучению кристаллизации других систем. Для расплавления в стакан с горячей водой не рекомендуется помещать более двух пробирок. При работе с пробирками необходимо соблюдать осторожность, стараясь не нарушить их герметичность и контакт термопар с потенциометром.
После окончания записи кривых охлаждения смесей, указанных преподавателем, диаграммную ленту отрывают и, определив температуры начала и окончания кристаллизации исследованных систем, вносят их в таблицу результатов. Ниже приводится форма таблицы результатов (табл. 4.1).
Таблица 4.1
