
- •Оглавление
- •Введение
- •Лабораторная работа № 3
- •1. Теоретическая часть
- •1.1. Давление насыщенного пара индивидуальных жидкостей
- •3. Контрольные вопросы
- •Лабораторная работа № 4 Диаграммы плавкости двухкомпонентных систем
- •1.2.1. Диаграмма плавкости двухкомпонентных систем
- •1.2.2. Диаграмма плавкости двухкомпонентных систем при
- •1.2.3. Диаграмма плавкости двухкомпонентных систем с устойчивым
- •Химическим соединением
- •1.2.4. Диаграмма плавкости двухкомпонентных систем с
- •1.2 Правило рычага
- •Зависимость температур начала и окончания кристаллизации от состава систем
- •3. Контрольные вопросы
- •Лабораторная работа № 7 Закон распределения
- •1. Теоретическая часть
- •1.1. Закон распределения
- •2. Экспериментальная часть
- •2.1. Содержание работы
- •2.3. Экстракция уксусной кислоты из водного раствора органическим
- •3. Контрольные вопросы
- •Лабораторная работа №8 Изучение взаимной растворимости жидкостей в трехкомпонентной системе
- •1. Теоретическая часть
- •1.1 Изображение равновесий в трехкомпонентных
- •2. Экспериментальная часть
- •2.1 Содержание работы
- •2.2. Методика проведения эксперимента и обработка результатов
- •3. Контрольные вопросы
- •Лабораторная работа №10 Химическая кинетика
- •1. Теоретическая часть
- •1.1. Скорость химической реакции
- •Если в системе протекает химическая реакция
- •1.2 Классификация реакций. Порядок реакций
- •Например, реакция
- •1.2.2. Односторонние реакции второго порядка
- •1.3. Влияние температуры на скорость реакции
- •2.1. Механизм реакции и ее кинетическое уравнение
- •2.2. Содержание работы
- •2.2.2. Порядок выполнения работы
- •2.2.3 Обработка результатов эксперимента
- •3. Контрольные вопросы
- •Лабораторная работа № 12 Электрическая проводимость растворов электролитов
- •1. Теоретическая часть
- •1.1. Электрическая проводимость растворов электролитов
- •1.2. Особенности электрической проводимости сильных электролитов
- •2. Экспериментальная часть
- •2.1 Содержание работы
- •2.2.1. Относительный метод определения удельной электрической проводимости
- •Электрохимические характеристики сильного электролита в водном растворе
- •3. Контрольные вопросы
- •Удельная электрическая проводимость водных растворов хлорида калия kCl (Ом-1∙см-1)
- •Предельная эквивалентная электрическая проводимость ионов при 250с и температурные коэффициенты *
- •Лабораторная работа № 14 Гальванические элементы
- •1. Теоретическая часть
- •1.3. Уравнение Нернста для расчета потенциалов электродов
- •1.4. Уравнение Нернста для расчета электродвижущей силы
- •1.5. Термодинамика гальванического элемента
- •1.6. Классификация электродов
- •1.6.1. Электроды первого рода
- •1.6.2. Электроды второго рода
- •1.6.3. Газовые электроды
- •1.6.4. Окислительно-восстановительные электроды
- •1.6.5. Ионно-селективные электроды
- •2. Экспериментальная часть
- •2.1. Содержание работы
- •2.2. Порядок выполнения работы
- •2.2.1. Определение потенциалов отдельных электродов
- •2.2.2. Определение эдс гальванических элементов
- •3. Контрольные вопросы
- •Стандартные электродные потенциалы некоторых электродов
- •Средние ионные коэффициенты активности γ± растворов сильных электролитов
- •Правила техники безопасности
- •Список Литературы
- •Практикум по дисциплине "физическая химия"
- •400131 Волгоград, просп. Им. В. И. Ленина, 28.
- •400131 Волгоград, ул. Советская, 35.
Лабораторная работа № 3
Изучение равновесия жидкость–пар в однокомпонентной системе
Цель работы:изучение влияния давления на температуру кипения и расчет теплоты испарения индивидуальных жидкостей.
1. Теоретическая часть
Равновесия в гетерогенных системах, в которых не происходит химического взаимодействия между компонентами, а протекают лишь процессы перехода компонентов из одной фазы в другую (или другие), называются фазовыми равновесиями.
В однокомпонентных системах различают следующие фазовые переходы:
жидкость ↔ пар (испарение и конденсация);
тв. вещество ↔ пар (возгонка и сублимация);
тв. вещество ↔ жидкость (плавление и кристаллизация);
тв. вещество ↔ тв. вещество (полиморфные превращения).
В настоящей лабораторной работе рассматривается процесс испарения жидкостей.
1.1. Давление насыщенного пара индивидуальных жидкостей
Переход жидкости в пар возможен, если кинетическая энергия молекул больше энергии межмолекулярного притяжения в жидкости. Жидкости, в которых межмолекулярное взаимодействие невелико, обладают большой способностью к испарению. Жидкости, в которых проявляются сильные межмолекулярные взаимодействия (полярные) обладают пониженной способностью к испарению. Наряду с процессом испарения происходит и обратный процесс – конденсация. При равенстве скоростей этих процессов в системе возникает динамическое равновесие между жидкостью и паром.
Насыщенным паром называется пар, находящийся в динамическом равновесии с жидкостью.
Давлением насыщенного пара (Р) называется давление, которое оказывает пар, находящийся в равновесии с жидкостью, на поверхность жидкости и стенки сосуда.
Давление насыщенного пара характеризует способность жидкости к испарению и является одним из важнейших свойств жидкости. Оно зависит от природы жидкости и температуры и не зависит от объема пара и количества жидкости. На давление пара помимо перечисленных факторов оказывает влияние также форма (кривизна) поверхности жидкости и наличие на ней электрического заряда. Давление насыщенного пара для каждого вещества является величиной постоянной при данной температуре. При повышении температуры давление насыщенного пара жидкостей возрастает вследствие увеличения кинетической энергии молекул. Температура, при которой давление насыщенного пара жидкостей сравнивается с внешним давлением, а переход молекул из жидкости в пар осуществляется не только с поверхности жидкости, но и по всему объему, называется температурой кипения.
Таким образом, над кипящей жидкостью присутствует насыщенный пар, давление которого равно внешнему давлению, а температура кипения жидкостей будет определяться природой жидкости и внешним давлением.
Двухфазное равновесие (f = 2) в однокомпонентной системе (K = 1) характеризуется одной термодинамической степенью свободы (S = 1). Такой вывод следует из правила фаз Гиббса
S = K – f + 2 = 1 – 2 + 2 = 1. (3.1)
Это означает, что из двух термодинамических параметров (температуры Т и давления Р), определяющих состояние равновесия между двумя сосуществующими фазами, произвольно изменять можно лишь один (либо Т, либо Р). При этом второй параметр будет закономерно изменяться, подчиняясь некоторой математической зависимости. Таким образом, переменные Р и Т выступают в данном случае как функция и аргумент. Взаимосвязь этих переменных может быть представлена графически – в виде кривой в координатах Р – Т, называемой фазовой диаграммой, или аналитически – в виде соответствующего уравнения. На рис. 3.1. в качестве примера приведена диаграмма состояния воды.
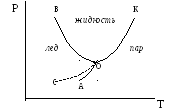
Рис. 3.1. Диаграмма состояния воды при невысоких давлениях:
кривые АО – возгонки–сублимации; ОК – испарения–конденсации; ОВ – плавления–кристаллизации; О – тройная точка, отвечающая равновесию трех фаз
Наиболее общим уравнением, связывающим Р и Т при равновесии между двумя фазами, является вытекающее из второго закона термодинамики уравнение Клапейрона – Клаузиуса.
Уравнение Клапейрона – Клаузиуса. Расчет теплоты испарения
Для равновесного состояния между жидкостью и паром уравнение Клапейрона – Клаузиуса может быть получено следующим образом.
Согласно второму закону термодинамики, если система находится в равновесии, то при данных условиях (Р, Т) работа не совершается:
Ap = 0; Gж – Gп = 0; Gж = Gп , (3.2)
то есть свободные энергии Гиббса индивидуального вещества в жидком и парообразном состоянии равны (условие равновесия).
Если изменение внешнего параметра произойдет на бесконечно малую величину – dT, то и изобарно-изотермические потенциалы изменятся на бесконечно малую величину:
dGж = dGп . (3.3)
Изобарно-изотермический потенциал представляет собой свободную энергию системы и является функцией давления и температуры:
dG = VdP – SdT, (3.4)
поэтому с его помощью можно установить количественную зависимость между давлением насыщенного пара и температурой.
После подстановки соответствующих значений dG в уравнение (3.3) имеем в состоянии равновесия:
VжdP – SжdT = VпdP – SпdT, (3.5)
откуда
![]() (3.6)
(3.6)
где (Sп – Sж) и (Vп – Vж) – изменение соответственно энтропии и объема системы при переходе вещества из жидкого в парообразное состояние.
Фазовое превращение в данном случае рассматривается как изотермический процесс, поэтому изменение энтропии в соответствии со вторым законом термодинамики определяется для процесса испарения следующим соотношением:
![]() ,
(3.7)
,
(3.7)
где ∆Нисп – теплота испарения (изменение энтальпии при испарении) – количество теплоты, необходимое для перевода жидкости в пар,
Т – температура кипения.
Подставив выражение (3.7) в уравнение (3.6) получим:
![]() (3.8)
(3.8)
где Vисп.=Vп–Vж – изменение объема вещества при испарении.
Величины Vисп и Нисп должны характеризовать одно и тоже количество вещества, и, чаще всего, их относят к 1 молю индивидуального вещества.
Уравнение
(3.8) называется уравнением Клапейрона
– Клаузиуса для процесса испарения.
Оно описывает взаимосвязь давления
насыщенного пара и температуры при
любом фазовом переходе, а для процесса
кипения – взаимосвязь внешнего давления
и температуры кипения жидкостей. Так
как Нисп
> 0,
а объем при испарении возрастает (Vисп=
Vп
– Vж
> 0), то
производная
![]() и, следовательно, с увеличением температуры
давление насыщенного пара возрастает
(кривая ОК на рис. 3.1).
и, следовательно, с увеличением температуры
давление насыщенного пара возрастает
(кривая ОК на рис. 3.1).
Уравнение (3.8) выведено для процесса испарения, однако оно является общим для всех фазовых переходов. В этом случае оно имеет вид:
![]() (3.9)
(3.9)
где Нфаз.п. и Vфаз.п. – изменения энтальпии и объема при соответствующих фазовых переходах.
Для процесса испарения уравнение Клапейрона – Клаузиуса можно преобразовать, приняв следующие приближения:
1. Поскольку объем пара Vп намного больше объема такого же количества жидкости Vж, (например, для воды мольный объем в парообразном состоянии при нормальных условиях Vп = 22400 см3, а мольный объем в жидком состоянии Vж = 18 см3), то без большой погрешности можно пренебречь величиной Vж, и принять, что Vисп = Vп.
2. При не слишком высоких давлениях и температурах (вдали от критических) можно применить уравнение состояния для идеальных газов и к реальным системам. Тогда для 1 моля газа:
Vисп=
Vп=![]() (3.10)
(3.10)
где R=8,314 Дж/мольК – универсальная газовая постоянная.
Подставив (3.10) в (3.8) получим:
![]() (3.11)
(3.11)
которое после преобразования:
![]() (3.12)
(3.12)
принимает вид:
![]() (3.13)
(3.13)
где Нисп – теплота испарения 1 моля вещества, Дж/моль.
Аналогичное уравнение может быть получено и для процесса возгонки.
Для расчетов применяется интегральная форма уравнения Клапейрона – Клаузиуса. В точных расчетах учитывается, что теплота испарения зависит от температуры: с повышением температуры теплота испарения понижается. При критической температуре теплота испарения равна нулю. Однако при температурах, далеких от критической, изменения Нисп с температурой не очень велики. В небольшом интервале температур Нисп можно считать постоянной.
Интегрирование уравнения Клапейрона – Клаузиуса (3.13) в пределах от Т1 до Т2, которым соответствуют давления Р1 и Р2, при постоянном значении Нисппозволяет получить уравнение (3.15):
 , (3.14)
, (3.14)
![]() (3.15)
(3.15)
Уравнение (3.15) может быть использовано для расчета Нисп, если известны давления насыщенного пара при двух температурах:
Нисп= (3.16)
(3.16)
или
Нисп=![]()
 (3.17)
(3.17)
Из уравнения (3.15) можно по известной теплоте испарения и данных о давлении насыщенного пара при одной температуре рассчитывать давление насыщенного пара при другой температуре или температуру кипения при заданном внешнем давлении.
При неопределенном интегрировании уравнения Клапейрона – Клаузиуса получим:
![]() .
(3.18)
.
(3.18)
Обозначим
величину
![]() ,
а константу интегрирования В. Тогда
,
а константу интегрирования В. Тогда
![]() .
(3.19)
.
(3.19)
Уравнение (3.19) позволяет вычислить давление насыщенного пара над жидкостью при любой температуре, если известны константы А и В. Константы А и В определяют на основе экспериментальных данных аналитическим или графическим методом.
Аналитический метод заключается в подстановке соответствующих пар значений Р и Т в уравнение (3.19). Получаем систему уравнений:
 (3.20)
(3.20)
совместное решение которых позволяет найти А и В.
Уравнение (3.19) отвечает линейной зависимости (рис. 3.2):
![]()
Поэтому константы А и В линейного уравнения могут быть определены графически на основе построения данной зависимости.



Рис. 3.2. Зависимость ln P от 1/T при испарении
Тангенс угла наклона прямой равен константе А:
А = tg
=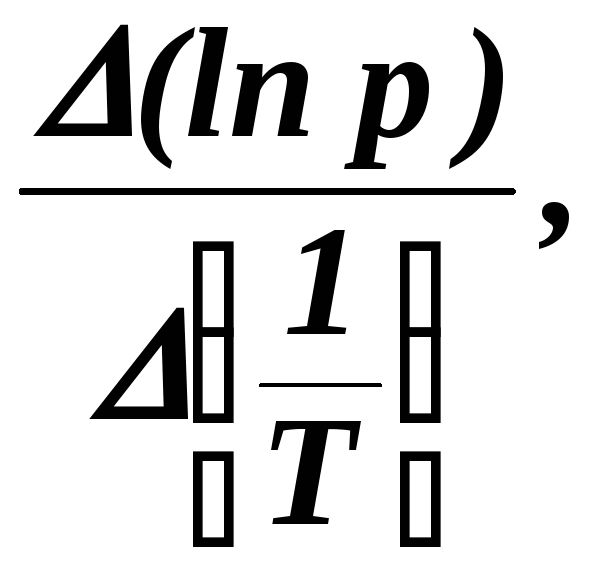 (3.21)
(3.21)
а отрезок, отсекаемый на оси ординат, равен постоянной интегрирования В (рис. 3.2). Графический метод позволяет усреднить полученные экспериментальные данные.
Найденное значение константы А может быть использовано для расчета теплоты испарения:
Нисп.= RA = R tg (3.22)
Оценка полярности исследуемой жидкости
В соответствии с правилом, установленным Трутоном, мольная теплота испарения неполярных жидкостей (Дж/моль) связана с их температурой кипения при атмосферном давлении Токип ( К) соотношением:
![]() ,
(3.23)
,
(3.23)
то есть мольные энтропии испарения неполярных жидкостей при атмосферном давлении в точках кипения постоянны. Это правило не выполняется в случае полярных (ассоциированных) жидкостей (вода, аммиак, спирты), для них величина Sисп. всегда имеет более высокое значение. Поэтому теплота испарения полярной жидкости всегда выше теплоты испарения, вычисленной по правилу Трутона, в связи с тем, что на разрушение ассоциатов затрачивается дополнительное количество энергии.
Оценку полярности жидкости (полярная или неполярная) можно получить, если сравнить теплоту испарения, вычисленную по правилу Трутона:
Hисп.=89,12 Токип. (3.24)
с экспериментально найденной величиной по уравнению Клапейрона – Клаузиуса.
Экспериментальная часть
Содержание работы
Определение температур кипения жидкости при различных давлениях.
Построение графиков зависимостей P=f(T), ln P=f(1/T).
Расчет теплоты испарения жидкостей.
Оценка полярности жидкостей.
Определение температур кипения жидкости при
различных давлениях
Кипение происходит при той температуре, при которой давление насыщенного пара равняется внешнему давлению. Измерение температур кипения при разных давлениях дает зависимость давления насыщенного пара от температуры. Схема установки для определения температур кипения жидкости при различном давлении приведена на рис. 3.3.
Н2О к
вакуумному насосу 1 3 2 4 5 6 7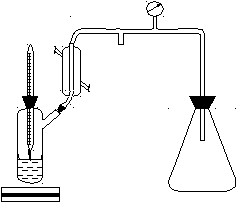




Рис. 3. 3. Схема установки для определения температур кипения
жидкости при различных давлениях
В стеклянный сосуд 2 через боковое отверстие, предназначенное для подключения обратного холодильника, залить исследуемую жидкость таким образом, чтобы ртутный резервуар термометра едва касался поверхности жидкости. Для устранения местных перегревов и облегчения образования парообразной фазы в жидкость предварительно помещают несколько кусочков фарфора.
ВНИМАНИЕ. Пробку с термометром 3 из сосуда не вынимать.
Затем сосуд закрепляют в штативе, подключают обратный водяной холодильник 4 и подают в него воду для конденсации пара и возвращения его в сосуд 2. При помощи насоса Комовского, мягко вращая рукоятку по часовой стрелке, создают максимальное разряжение, заданное преподавателем.
Понижение давления в системе измеряют по вакууметру 6. Цена деления прибора равна Рбар/100 [мм.рт.ст.] (Рбар – барометрическое атмосферное давление, определяемое по барометру, 1 мм.рт.ст.= 133,322 Па). Разряжение в системе рассчитывают умножением цены деления на количество делений (п) по шкале вакууметра
![]() .
(3.25)
.
(3.25)
Склянка 7 представляет собой добавочную емкость, позволяющую регулировать наполнение системы воздухом через кран 5. Проверяют герметичность системы. Система считается герметичной, если за 10–15 мин. давление при закрытом кране 5 изменится не более, чем на 1–2 деления по шкале вакууметра. Включают нагреватель 1 и устанавливают сосуд с исследуемой жидкостью над поверхностью нагревателя. Дождавшись равномерного кипения жидкости и прекращения подъема температуры, отмечают температуру кипения и показание вакууметра. Кипение жидкости должно быть спокойным. В случае слишком бурного кипения необходимо уменьшить интенсивность нагревания.
Переход к следующему состоянию равновесия жидкость–пар осуществляется повышением в системе внешнего давления. Для этого с помощью крана 5 впускают такое количество воздуха, чтобы давление повысилось на 30–80 мм.рт.ст. (5–10 делений по шкале вакууметра – по заданию преподавателя). Кипение в этот момент прекратится, и начнется подъем температуры. Вслед за этим будет увеличиваться давление пара, пока не сравняется с внешним давлением в системе. Жидкость вновь закипает. Проводят вторичное измерение температуры и давления. Переходя от одного состояния системы к другому, проводят последовательные измерения давления и температуры кипения (8–12 раз) до тех пор, пока давление в системе не станет равным атмосферному. Вакууметр 6 показывает насколько ниже давление в системе по сравнению с атмосферным. Следовательно, давление, при котором жидкость закипает – Р равно разности между барометрическим (атмосферным) давлением Рбар и разряжением в системе Р, определяемое с помощью вакууметра:
Р = Рбар–Р. (3.26)
Это внешнее давление в системе и будет давлением насыщенного пара жидкости при температуре кипения.
Отсчеты по термометру следует делать с точностью до 0,5 С, давление по вакууметру и барометру измеряют с точностью 0,5 мм.рт.ст.
Результаты измерений сводят в табл. 3.1.
Таблица 3.1
|
№№ пп/п |
Показания термометра |
Показания вакууметра |
Барометрическое давление Рбар, мм. рт. ст. |
Давление в системе (давление насыщенного пара при Ткип). | |||||
|
оt, оС |
ОТ, К |
11/T |
число делений n |
P, мм. рт. ст.
|
Р=Pбар–Р, мм. рт. ст. |
Р, Па |
ln P | ||
|
|
Жидкость № | ||||||||
На основании полученных данных необходимо:
1) построить графики зависимости Р = f(T) и ln Р = f(1/T);
2) вычислить теплоту испарения (Нисп) исследуемой жидкости по уравнению (3.16). Для этого выбрать на прямой, построенной в координатах ln Р = f(1/T), две точки и соответствующие им координаты (ln Р1; 1/T1) и (ln Р2; 1/T2) подставить в уравнение (3.16);
3) используя зависимость ln Р = f(1/T), найти графическим путем значение Hисп (3.21); тангенс угла наклона прямой определить как отношение изменения логарифма давления к изменению обратной температуры (3.20);
4) рассчитать теплоту испарения, используя правило Трутона (3.23).
Полученное по уравнению (3.23) значение теплоты испарения может не совпадать с рассчитанными по пунктам 2 и 3 теплотами испарения, поскольку правило Трутона применимо только для неполярных жидкостей. Сопоставляя теплоты испарения, вычисленные различными способами, дать оценку полярности исследуемой жидкости.
Результаты вычислений теплоты испарения занести в табл. 3.2.
Таблица 3.2
|
Вид уравнения для расчета теплоты испарения |
Нисп, Джмоль-1 | |
|
жидкость № ___ | ||
|
|
| |
|
Из графических построений Нисп =Rtg |
| |
|
Нисп =89,12 Tокип |
| |
|
Оценка полярности жидкости (качественная) |
| |

