
- •Правила техники безопасности
- •1.2.2. Диаграмма плавкости двухкомпонентных систем при неограниченной растворимости компонентов в жидком и твердом состоянии, компоненты не образуют химических соединений
- •А б
- •1.2.3. Диаграмма плавкости двухкомпонентных систем с устойчивым химическим соединением при неограниченной растворимости компонентов в жидком состоянии и отсутствии растворимости в твердом состоянии
- •Зависимость температур начала и окончания кристаллизации от состава систем
- •3. Контрольные вопросы
- •Список рекомендуемой литературы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ
УНИВЕРСИТЕТ
Кафедра аналитической, физической химии и физико-химии полимеров
ДИАГРАММЫ ПЛАВКОСТИ ДВУХКОМПОНЕНТНЫХ СИСТЕМ
Методические указания к лабораторной работе № 4
по физической химии
Волгоград 2005
УДК 541.123.2 (075.5)
ДИАГРАММЫ ПЛАВКОСТИ ДВУХКОМПОНЕНТНЫХ СИСТЕМ:
Методические указания к лабораторной работе № 4 по физической химии/ Сост. Г.Д. Бахтина, А.Б. Кочнов, А.И. Павлючко; Волгоград. гос. техн. ун-т. – Волгоград, 2005. – с.
Рассматривается метод построения диаграмм плавкости двухкомпонентных систем по кривым охлаждения. Излагается правило фаз Гиббса. Приводится методика анализа диаграмм плавкости различного вида с применением правила фаз Гиббса.
Предназначены для студентов, обучающихся по направлениям 5508, 5505.
Ил. 6. Табл. 1. Библиогр.: 3 назв.
Рецензент: Ж.Н. Малышева
Печатается по решению редакционно-издательского совета
Волгоградского государственного технического университета
© Волгоградский
государственный
технический
университет, 2005
Правила техники безопасности
Осторожно обращайтесь с приборами и установкой. При небрежном отношении прибор может быть выведен из строя. В случае каких-либо неисправностей в работе установки сообщите преподавателю или лаборанту. Не пытайтесь самостоятельно их устранить.
Осторожно обращайтесь с термопарами. Не вынимайте их из смеси. Термопары установлены так, чтобы наблюдаемые температуры отвечали процессам, протекающим при охлаждении смеси.
Бережно относитесь к стеклянным пробиркам, в которых помещены изучаемые смеси. Помещенные в них вещества ядовиты и вызывают ожоги. Следите, чтобы уровень воды в стаканах с горячей водой и охлаждающей смесью, в которые помещаются пробирки, был ниже пробок на 1-2 см.
Доложите преподавателю о полученных результатах, рабочее место по окончании работы приведите в порядок и сдайте лаборанту.
Цель работы: Ознакомление с основными положениями термического анализа при исследовании фазовых равновесий в двухкомпонентных системах, принципами построения диаграмм плавкости и их анализа, в том числе, с применением правила фаз Гиббса; экспериментальное определение температур начала и окончания кристаллизации двухкомпонентных систем по кривым охлаждения; построение диаграммы плавкости в координатах температура кристаллизации (плавления) – состав и ее анализ.
Теоретическая часть
Основные понятия и определения
Фазовыми превращенияминазываются процессы превращения одной фазы в другую без протекания химических реакций. Система, состоящая из нескольких фаз, называетсягетерогенной, а равновесие, устанавливающееся в такой системе, - гетерогенным или фазовым. Основной характеристикой фазового превращения являетсятемпература фазового превращения– это температура, при которой фазы находятся в равновесии. Она зависит от давления.
Фазовое равновесие в гетерогенных системах характеризуется определенными условиями равновесия: равенством температур (T) во всех фазах системы, равенством давлений (Рi) и химических потенциалов каждого компонента (μi) во всех фазах: ТI = TII = … = TФ ;
РiI = РiII = … = РiФ ; ( 1 )
μiI = μiII = … = μiФ.
Верхний индекс показывает номер фазы, а нижний – компонент.
Химическим потенциалом компонента (μi) называется часть свободной энергии системы, приходящейся на один моль данного вещества. Химический потенциал компонента определяется при Р = const и T = const как частная производная от энергии Гиббса G (G = H – T•S) по количеству i –го вещества ni (в молях) при постоянном количестве остальных индивидуальных веществ в системе:
μi = ( ∂ G / ∂ ni ) Р,T, n1,n2,…nj ( 2 )
Химический потенциал i– го компонента равен приращению энергии Гиббса при добавлении одного моля этого компонента к большому объему системы (то есть состав системы при этом практически не меняется) при постоянных температуре, давлении и количестве других компонентов. Химический потенциал чистого вещества равен энергии Гиббса одного моля этого вещества:μi = Gi . Разность химических потенциалов определяет направление перехода вещества из одной фазы в другую. Химический потенциал служит движущей силой при переходе массы вещества из одной части системы в другую, что приводит к установлению равновесия, характеризующегося равенством химических потенциалов каждого компонента во всех частях системы.
Для физико-химического анализа равновесий в сложных системах, состоящих из многих фаз и веществ, применяется правило фаз. Ниже даны определения понятий, используемых в правиле фаз.
Фазой называется однородная часть гетерогенной системы, одинаковая по составу, химическим и физическим свойствам и отделенная от других частей поверхностью раздела, на которой термодинамические свойства меняются скачкообразно. Например, система, в которой одновременно сосуществуют жидкая вода, пар и лед, состоит из трех фаз. Количество фаз обозначается как f.
Термодинамическую систему могут образовывать одно или более веществ. Вещества, которые могут быть выделены из системы и существовать вне её, называются компонентами (составными частями) системы. Например, в водном растворе уксусной кислоты имеются ионы CH3COO – и H+, молекулы CH3COOH и H2O. Составными частями этой системы можно считать только CH3COOH и H2O, так как ионы не могут быть выделены из раствора и существовать изолированно. При протекании в системах химических реакций количества составных частей зависят друг от друга, и состав фаз можно определить, зная концентрации не всех составных частей, а определенного числа компонентов. Для описания системы в этом случае вводится понятие числа независимых компонентов.
Число независимых компонентов (K) – это наименьшее число компонентов, достаточное для образования всех фаз системы, оно равно разности между числом индивидуальных веществ в системе и числом независимых уравнений, связывающих эти вещества. К таким уравнениям относятся уравнения для констант равновесия химических реакций, протекающих в системе; растворимости при условии насыщения раствора и другие.
В качестве примера рассмотрим систему, составными частями которой являются три индивидуальных вещества: газообразные водород H2, йод I2 и йодистый водород HI. Между этими веществами возможна реакция образования или разложения HI:
H2 + I2 ↔ 2 HI. ( 3 )
При наступлении равновесия при данной температуре данная химическая реакция характеризуется строго определенной величиной константы равновесия Кс:
[HI]2
Kc = -------------- . ( 4 )
[H2] • [ I2]
Вследствие этого состав равновесной системы будет точно определен, если известны концентрации любых двух (а не трех) составных частей. Число независимых компонентов К= 3 – 1 = 2.
Числом степеней свободы - вариантностью (S) называется число независимых переменных, которое можно независимо и одновременно менять в определенных пределах, не изменяя числа и природы фаз. Это число независимых параметров (температура, давление, концентрации компонентов), значения которых полностью определяют фазовое состояние системы при равновесии. Например, ненасыщенный раствор какой-либо соли имеет три степени свободы: температура, давление и концентрация соли, которые можно изменять в том или ином интервале, сохраняя раствор однофазным. Однако, если раствор достигает насыщения и выпадает новая фаза – твердая, то число степеней свободы уменьшается до двух, так как каждой температуре соответствует определенная величина растворимости соли. По числу степеней свободы системы бывают нонвариант-ными (S = 0), моно- (S = 1), бивариантными (S = 2) и т.д.
Правило фаз устанавливает связь между количеством фаз, числом независимых компонентов в системе и числом степеней свободы.
Рассмотрим равновесную термодинамическую систему, состоящую из Ф фаз, каждая из которых содержит К компонентов. Примем в качестве параметров, определяющих состояние системы, давление, температуру и концентрации компонентов, выраженные в массовых или мольных долях или процентах. Число независимых параметров состояния, то есть число степеней свободы, равно разности между общим числом параметров, определяющих состояние равновесной системы (П), и числом уравнений, связывающих эти параметры (У):
S = П – У. (5)
Число параметров, одинаковых во всех фазах систем, равно 2 (давление Р и температура T).Для характеристики состава одной фазы достаточно задать (К-1) концентраций, так как концентрация любого из компонентов данной фазы будет определена, если известны концентрации остальных компонентов. Для характеристики состава всех фаз необходимо знать Ф • (К – 1 ) концентраций. Тогда общее число параметров, определяющих состояние равновесной системы:
П = Ф • (К – 1 ) + 2. (6)
Так как при Р = const и T = const химические потенциалы компонентов являются функциями их концентраций, например, в идеальном растворе μi = μiо + RT ln Ni, то число уравнений, связывающих концентрации компонентов равновесной системы, можно определить из равенства химических потенциалов каждого компонента во всех фазах:
для компонента 1 μ1I = μ1II = … = μ1Ф; всего
для компонента 2 μ2I = μ2II = … = μ2Ф; К равенств (7)
…………………………………………………. (по числу компонентов) для компонента К μКI = μКII = … = μКФ.
______________________
(Ф – 1) - число уравнений,
связывающих концентрации одного компонента
Число уравнений, связывающих концентрации всех компонентов:
У = К • (Ф - 1). (8)
Тогда число степеней свободы
S = Ф • (К – 1 ) + 2 - К • (Ф - 1); или
S = К – Ф + 2. (9)
Полученное уравнение (9) называется правилом фаз Гиббса или законом равновесия фаз, который формулируется следующим образом: число степеней свободы равновесной термодинамической системы, на которую из внешних факторов оказывают влияние только давление и температура, равно числу независимых компонентов системы минус число фаз плюс 2. Если из внешних факторов на систему оказывает влияние только давление (T = const) или температура (Р = const), число степеней свободы уменьшается на единицу и уравнение правила фаз принимает вид:
S = К – Ф + 1. (10)
В общем случае, когда на систему действуют n различных факторов (электрическое, магнитное поле и др.)
S = К – Ф + n. (11)
Максимальное число фаз в равновесной системе находится при S = 0, так как число степеней свободы не может быть отрицательной величиной.
Построение диаграмм плавкости
В основе физико-химического анализа лежит изучение зависимости физических свойств систем от внешних параметров или от их состава. Найденные опытным путем зависимости изображаются графически в виде диаграмм фазового состояния. Анализ диаграмм состояния позволяет определить число фаз, границы их существования, характер взаимодействия компонентов, наличие вновь образующихся соединений и их состав. При этом анализ осуществляется без выделения индивидуальных компонентов из изучаемых систем.
Исследование диаграмм основано на принципах непрерывности и соответствия, введенных Курнаковым Н.С. Согласно принципу непрерывности при непрерывном изменении параметров, определяющих состояние системы (давление, температура, концентрация), свойства ее отдельных фаз изменяются также непрерывно до тех пор, пока не изменится число или характер ее фаз. При появлении новых или исчезновении существующих фаз свойства системы изменяются скачкообразно. Согласно принципу соответствия каждой фазе или каждому комплексу равновесных фаз на диаграмме соответствует определенный геометрический образ.
В настоящей лабораторной работе рассматриваются диаграммы плавкости двухкомпонентных систем, которые представляют собой графические зависимости температур кристаллизации (температур плавления) от химического состава систем, полученные в условиях постоянства давления.
Построение диаграмм плавкости проводится на основе термического анализа расплавов различного состава путем изучения кривых охлаждения, представляющих собой графические зависимости температур охлаждаемых расплавленных образцов от времени (рис. 1).
Так как кристаллизация сопровождается тепловым экзотермическим эффектом (теплота выделяется), замедляющим процесс охлаждения, на кривых охлаждения расплавов различного состава наблюдаются перегибы, площадки, пики, соответствующие началу и окончанию кристаллизации. В случае равновесного охлаждения при постоянном составе жидкой фазы (чистые вещества или смеси эвтектического состава) на кривых при кристаллизации компонентов наблюдаются площадки (температура фазового перехода постоянна) – кривые 1 (кристаллизуется чистое вещество) и 3 (эвтектический состав) на рис. 1. Расплавы неэвтектического состава кристаллизуются в некотором интервале температур, так как при кристаллизации состав жидкой фазы меняется.

Рис. 1. Кривые охлаждения расплавов.
В этом случае на кривых охлаждения появляется перегиб, соответствующий началу кристаллизации. После завершения кристаллизации и прекращения тепловыделения ход кривой охлаждения восстанавливается, что приводит к возникновению на ней нового перегиба (кривая 2 на рис. 1). Появление пиков на кривых охлаждения происходит вследствие переохлаждения систем с последующим образованием центров зарождения кристаллов. Происходящее затем повышение температуры связано с выделением теплоты кристаллизации (кривая 4 на рис. 1). В этом случае за температуру начала и окончания кристаллизации принимают температуры, соответствующие возникающим максимумам на кривых охлаждения (точки m′ и e′, соответственно).
Из основного закона равновесия фаз Гиббса следует, что для двухкомпонентной системы при Р = const в соответствии с уравнением (4) число степеней свободы составит:
S = 2 – f + 1 = 3 – f. (12)
Следовательно, в данном случае число равновесных фаз не может быть больше f = 3 (при S = 0), а число степеней свободы не может быть больше S = 2 (при f = 1). Переменными являются температура и состав фаз. Для выделения твердой фазы из расплава, то есть для образования двухфазной системы (f = 2) необходимо изменять либо температуру, либо концентрации компонентов (S = 1).
При построении диаграмм плавкости двухкомпонентных систем составы системы задаются на оси абсцисс, а температуры начала и окончания кристаллизации систем соответствующих составов – на оси ординат. При этом начало и конец отрезка оси абсцисс соответствуют чистым компонентам, промежуточные точки оси абсцисс отвечают составам двухкомпонентных систем (рис. 2÷6). Точки, соответствующие температурам начала кристаллизации расплавов, соединяются линией, которая носит название линии ликвидуса. При соединении точек на диаграмме, характеризующих окончание кристаллизации, получают ещё одну линию – линию солидуса. Линии ликвидуса и солидуса разделяют область диаграммы на участки, соответствующие определенным фазовым состояниям.
Вид (тип) диаграмм плавкости зависит не только от числа компонентов, но и от их взаимной растворимости в твердом и жидком состоянии, а также от их способности к образованию устойчивых и неустойчивых химических соединений. К основным типам диаграмм плавкости относятся диаграммы с эвтектикой, с ограниченной и неограниченной растворимостью в твердой и жидкой фазах, с конгруэнтно (без разложения) и инконгруэнтно (с разложением) плавящимися химическими соединениями.
Точка на диаграмме, показывающая значение параметров, характеризующих данное равновесное состояние системы, называется фигуративной.
Ниже рассматриваются основные типы диаграмм плавкости двухкомпонентных систем.
1.2.1. Диаграмма плавкости двухкомпонентных систем при неограниченной растворимости компонентов в жидком состоянии и отсутствии растворимости в твердом состоянии, компоненты не образуют химических соединений
При отсутствии растворимости компонентов в твердом состоянии (компоненты неизоморфны) и образования химических соединений добавление одного компонента к другому всегда приводит к уменьшению температуры кристаллизации исходной системы. Пример построения диаграммы по кривым охлаждения для данного случая представлен на рис. 2.
а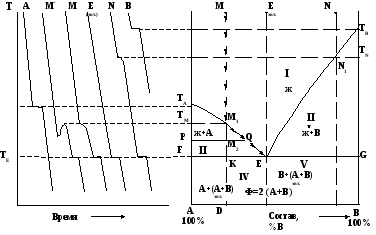 б
б
Рис. 2. Кривые охлаждения (а) и, построенная на их основе, диаграмма плавкости двухкомпонентной системы при неограниченной растворимости в жидком состоянии и отсутствии растворимости в твердом состоянии, компоненты не образуют химических соединений (б).
а : А, B – кривые охлаждения чистых компонентов А и B; M, N – кривые охлаждения промежуточных составов, соответствующих точкам М и N, соответственно; М’ – кривая охлаждения промежуточного состава, соответствующего точке М для случая переохлаждения расплава; Е – кривая охлаждения расплава эвтектического состава.
При охлаждении такой двухкомпонентной системы последовательность кристаллизации компонентов из жидкой фазы при охлаждении зависит от насыщенности расплава тем или иным компонентом (от взаимной растворимости компонентов). Линия ТАЕТВ изображает зависимость температуры начала кристаллизации от состава системы (линия ликвидуса). Она состоит из двух ветвей. Линия ТАЕ соответствует равновесию расплава с кристаллами вещества А. Линия ТВЕ соответствует равновесию расплава с кристаллами вещества В.
Выше линии ТАЕТВ на диаграмме располагается область, соответствующая существованию жидкого расплава (область I). Для этой области число степеней свободы S = 2 – 1 + 1 = 2, то есть в пределах поля можно изменять температуру и состав системы без изменения числа и вида фаз.
Область II – соответствует двухфазному состоянию системы, состоящей в этом случае из кристаллов вещества А и расплава.
Область III – соответствует двухфазному состоянию системы, состоящей в этом случае из кристаллов вещества В и расплава.
Для двухфазных состояний S = 2 – 2 + 1 = 1. Это означает, что существует взаимно однозначное соответствие температур начала кристаллизации и составов систем, то есть каждому составу расплава соответствует своя температура начала кристаллизации, и наоборот.
Точка Е на диаграмме – точка пересечений двух ветвей линии ликвидуса характеризует температуру кристаллизации и состав эвтектики. Для эвтектического состава при температуре кристаллизации эвтектики расплав насыщен обоими компонентами, и происходит их одновременная кристаллизация при постоянном соотношении компонентов в жидкой фазе (расплаве) и в твердом состоянии. В этом случае в системе в равновесии находятся три фазы (расплав, кристаллы А и кристаллы В). S = 2 – 3 + 1 = 0, то есть система нонвариантная, и изменение любого параметра (состава, температуры) приведет к изменению числа фаз. Таким образом, эвтектикой называется смесь кристаллов, которые одновременно выпадают из жидкости соответствующего состава (эвтектического) вследствие равновесного процесса:
расплав А-В ↔ кристаллы А + кристаллы В. (13)
Эвтектический состав полностью затвердевает при постоянной температуре подобно чистому компоненту (кривая охлаждения Е на рис. 1). В связи с тем, что кристаллы А и В при кристаллизации выпадают одновременно, у них нет условий для роста. Поэтому эвтектическая смесь имеет мелкокристаллическое строение, что определяет ряд ее свойств, в том числе, механическую прочность.
Линия FG изображает зависимость температуры окончания кристаллизации при охлаждении (или начала плавления при нагревании) от состава (линия солидуса).
Ниже линии солидуса находится фазовое поле твердого состояния системы (IV + V), отвечающее сосуществованию двух твердых фаз (кристаллы А и кристаллы В). Область IV соответствует крупным кристаллам вещества А, которые сначала выпадали в твердом состоянии индивидуально, и эвтектики, представляющей собой механическую смесь мелких кристаллов веществ А и В. Область V соответствует крупным кристаллам вещества В, которые сначала выпадали в твердом состоянии индивидуально, и эвтектики.
Диаграммы позволяют провести анализ процесса кристаллизации расплавов. Например, при охлаждении расплава состава, заданного точкой М, фигуративная точка системы в целом движется вниз по прямой МD. В точке её пересечения с линией ликвидуса (точка М1) определяется температура начала кристаллизации компонента А (ТМ). По мере кристаллизации компонента А жидкость (расплав) обогащается компонентом В. Так как при кристаллизации состав жидкой фазы изменяется, то происходит и снижение температуры кристаллизации расплава. Состояние расплава (температура и состав) при кристаллизации изменяется по линии ликвидуса до температуры ТЕ и соответствующего ей эвтектического состава. Например, при достижении системой состояния, характеризуемого фигуративной точкой М2, в равновесии будут находится кристаллы А (точка P) и расплав, соответствующий точке Q. Прямые, соединяющие точки, соответствующие фазам, находящимся в равновесии, называются конодами. Для данного примера – это прямая PQ. При температуре TE концентрация компонента В настолько увеличивается, что расплав становится насыщенным и этим компонентом. Поэтому происходит его выделение из расплава наряду с компонентом А при соотношении, соответствующем эвтектическому (точка Е). После окончания кристаллизации всей системы при температуре ТЕ дальнейшее охлаждение будет приводить к снижению температуры системы в твердом состоянии, и фигуративная точка будет двигаться по линии КD.
Аналогично происходит процесс кристаллизации расплава, заданного точкой N. Однако первым компонентом, выпадающим из расплава при охлаждении за счет насыщения раствора будет компонент В, а состав жидкой фазы вследствие её обогащения компонентом А при кристаллизации будет изменяться по ветви линии ликвидуса N1E до температуры TE, при которой состав расплава становится эвтектическим, и из него наряду с компонентом В будет кристаллизоваться компонент А. Таким образом, кристаллизация всех расплавов системы А-В при отсутствии взаимной растворимости компонентов в твердом состоянии заканчивается при температуре ТЕ. Это объясняется тем, что при охлаждении расплава любого состава до этой температуры жидкая фаза имеет один и тот же состав, отвечающий эвтектике.
