
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РФ
ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
КАФЕДРА “АНАЛИТИЧЕСКАЯ, ФИЗИЧЕСКАЯ ХИМИЯ И
ФИЗИКО-ХИМИЯ ПОЛИМЕРОВ”
ЗАКОН РАСПРЕДЕЛЕНИЯ
Методические указания к лабораторной работе № 7
по физической химии
РПК
“Политехник”
Волгоград 2007
УДК 541.123.4 (075.5)
ЗАКОН РАСПРЕДЕЛЕНИЯ:
Методические указания к лабораторной работе № 7 по физической химии/ Сост. Г.Д. Бахтина, А.Г. Кокшаров; Волгоград. гос. техн. ун-т. – Волгоград, 2007. – с. 20.
Излагается закон распределения вещества между двумя фазами, приводятся различные формы закона, дается понятие термодинамической константы распределения и коэффициента распределения. Рассматривается процесс экстракции и дается обоснование его эффективности. Описывается методика определения коэффициента распределения уксусной кислоты между водной и органической фазой.
Предназначены для студентов, обучающихся по направлениям 550800, 551800, 550500.
Ил.2. Табл. 1. Библиогр.: 3 назв.
Рецензент: Ж.Н. Малышева
Печатается по решению редакционно-издательского совета
Волгоградского государственного технического университета
© Волгоградский
государственный
технический
университет, 2007
Правила техники безопасности
Перед выполнением лабораторной работы необходимо изучить методику ее проведения и получить разрешение преподавателя на ее выполнение.
Выполнение работы осуществляется на специально оборудованном рабочем месте. Хождение по лаборатории, не связанное с проведением эксперимента, запрещается.
Осторожно обращайтесь с реактивами и стеклянной посудой. В случае каких-либо неисправностей сообщите о них преподавателю или лаборанту. Не пытайтесь самостоятельно их устранить.
Отбор заданных объемов растворов при выполнении анализа производится пипетками с использованием резиновых груш.
При попадании на тело или одежду растворов кислоты или щелочи их необходимо смыть большим количеством воды.
При встряхивании колб, в которых производят экстракцию, необходимо быть особенно осторожными, не допуская разбрызгивания реактивов. При этом придерживают пробки и периодически открывают сосуды для предотвращения выбивания пробок.
Использованные органические растворы после работы необходимо сливать в специальную емкость, предназначенную для слива органических веществ.
По окончании работы необходимо доложить преподавателю о полученных результатах, вымыть посуду, привести в порядок рабочее место и сдать его лаборанту.
Цель работы: Изучение закона распределения вещества между двумя фазами, экспериментальное определение коэффициента распределения уксусной кислоты между водой и органическим растворителем.
1. Теоретическая часть
1.1. Закон распределения
В системах, состоящих из двух фаз, вещества распределяются определенным образом. Если к системе из двух взаимно нерастворимых или ограниченно растворимых жидкостей добавить компонент i так, чтобы не образовалась новая фаза, то он в соответствии со своей растворимостью распределится между жидкостями, и в системе установится равновесие. Условием равновесия при распределении вещества между двумя фазами является равенство химических потенциалов этого вещества в одной и другой фазе:
i(I) = i(II), (1)
где i(I) и i(II) – химические потенциалы компонента i в первом и втором растворителях.
Химический потенциал компонента i (i) при следующих условиях: P = const, T = const, – это энергия Гиббса (G), приходящаяся на 1 моль индивидуального i-го вещества в сложной однородной смеси. Он определяется как частная производная от энергии Гиббса по количеству i-го вещества при p,Т = const и постоянном количестве остальных индивидуальных веществ в системе:
![]()
![]() (2)
(2)
Разность величин i (∆i) определяет направление химических реакций, фазовых превращений, диффузии веществ из одной фазы в другую.
Рассмотрим распределение компонента i между двумя несмешивающимися или ограниченно смешивающимися жидкостями.
Химический потенциал компонента в растворе определяется соотношением:
i=i0 + RT ln ai, (3)
где аi – термодинамическая активность компонента в растворе;
iо – стандартный химический потенциал (при аi = 1).
Термодинамическая активность – это величина, которую используют для описания свойств реальных растворов, то есть тех, в которых существует взаимодействие между компонентами, вместо концентрации. Подстановка величины термодинамической активности вместо концентрации в уравнения, установленные для идеальных растворов, делает эти уравнения пригодными для описания свойств реальных растворов.Активность компонента в растворе связана с его концентрацией (ci) уравнением:
![]() ,
(4)
,
(4)
где i – коэффициент активности компонента в растворе, характеризующий степень отклонения свойств реальных растворов от свойств идеальных растворов вследствие взаимодействия составляющих их компонентов.
Для идеальных растворов (разбавленных и совершенных) = 1, и активность совпадает с концентрацией.
После подстановки в равенство (1) выражений для химического потенциала распределяемого компонента в первом и во втором растворах получим:
![]() (5)
(5)
где i0(I), i0(II) – стандартные химические потенциалы компонента в первом и втором растворах (при активностях ai(I) = 1, ai(II) = 1, соответственно); ai(I), ai(II) – активности компонента i в первом и втором растворах.
Отсюда
 .
(6)
.
(6)
При постоянной температуре все члены в правой части уравнения постоянны. Следовательно,
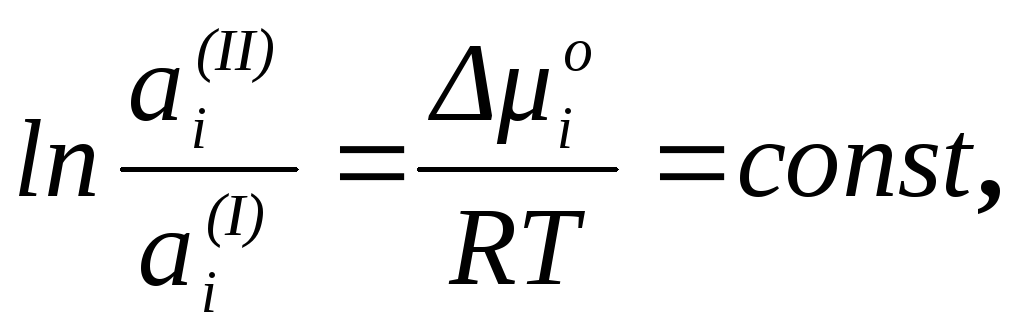 (7)
(7)
где io – разность стандартных потенциалов распределяемого вещества в первом и втором растворах, зависящая от природы всех трех компонентов.
Из соотношения (7) следует:
 (8)
(8)
или
 (9)
(9)
Уравнение (9) является выражением закона распределения: компонент, добавленный к системе, состоящей из двух других взаимно нерастворимых или ограниченно растворимых жидкостей, распределяется между ними в определенном, постоянном при данной температуре отношении. Величина Ко называется термодинамической константой распределения. Уравнение (9) показывает, что термодинамическая константа распределения не зависит от активностей распределяемого вещества в обоих растворителях, так как при изменении активности компонента в одном растворе изменится активность этого компонента и в другом растворе системы, а их отношение при данной температуре сохранится.
Уравнение закона распределения с учетом выражения для активностей компонента (4) можно записать в иной форме:

, (10) где К – коэффициент распределения:
 .
(11)
.
(11)
Коэффициентом распределения называется отношение концентрации вещества в одной жидкой фазе к его концентрации во второй жидкой фазе в условиях равновесия. Так как коэффициенты активности зависят от концентрации компонентов в растворе, а величина Ко постоянна для данной системы при Т = const, то коэффициент распределения меняется с изменением концентраций распределяемого вещества в двух равновесных жидких фазах. Для разбавленных растворов (сi(I) 0, сi(II) 0) коэффициенты активности i(II) 1 и i(I) 1,
тогда:
 .
(12)
.
(12)
В этом случае коэффициент распределения не зависит от концентраций распределяемого вещества в растворах.
Коэффициент распределения, а, в общем случае, термодинамическая константа распределения зависят от природы распределяемого вещества, природы растворителей (фаз) и от температуры (Т).
Если распределяемое вещество ассоциирует или диссоциирует в растворителях, то в случае образования разбавленных растворов закон распределения может быть записан в следующей форме:
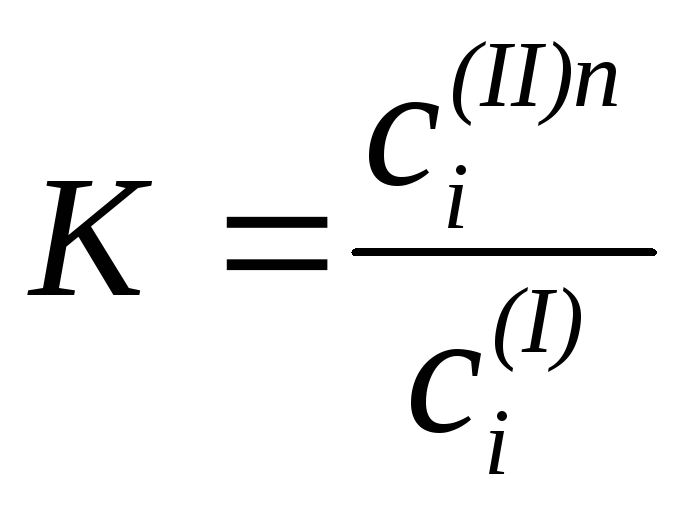 , (13)
, (13)
где n - величина, постоянная для данной системы при постоянной температуре, определяемая соотношением:
![]() (14)
(14)
где М1 и М2 - молекулярные массы распределяемого вещества, соответственно, в первом и втором растворителях.
Для разбавленных растворов справедливо соотношение:
 ,
(15)
,
(15)
где 1 и 2 – степени диссоциации или ассоциации распределенного вещества, соответственно, в первой и второй фазах.
Все отклонения от законов идеальных растворов формально учитываются коэффициентами активности. Поэтому, если известны активности распределяемого компонента в двух растворителях, то уравнением (9) можно пользоваться также и при наличии диссоциации или ассоциации молекул в растворе.
Закон распределения относится не только к распределению вещества между двумя жидкостями, но имеет более общий характер. Так, известный закон Генри является частным случаем рассматриваемого закона и описывает распределение вещества между газом и жидкостью:
![]() (16)
(16)
где КГ – константа Генри; Р – парциальное давление газа над жидкостью;
с – концентрация газа в насыщенном растворе (растворимость).
Закон справедлив и в случае распределения вещества между контактирующими твердой и жидкой фазами при наступлении состояния равновесия. В последнем случае закон распределения имеет вид:
 (17)
(17)
где Ciтв и Ciж - концентрации распределяемого вещества в твердой и жидкой фазах при равновесии.
Зависимость константы распределения от температуры, как и для любых других констант равновесия в случае процесса при Р=const описывается уравнением изобары Вант-Гоффа:
![]() (18)
(18)
где Н – изменение энтальпии (теплового эффекта) при переходе растворенного вещества из одной фазы в другую.
При Н > 0 (эндотермический процесс) с увеличением Т константа распределения возрастает; при Н < 0 (экзотермический процесс) с увеличением Т константа распределения уменьшается.
Закон распределения имеет важное теоретическое и практическое значение. С использованием этого закона можно определять степень диссоциации и ассоциации растворенного вещества в том или ином растворителе; активности и коэффициенты активности веществ; константы равновесия химических реакций, протекающих в одной из фаз, и другие величины. Этот закон обосновывает один из важнейших препаративных и технологических процессов – экстракцию.
Экстракция
Экстракция – извлечение растворенного вещества из раствора при помощи другого растворителя (экстрагента), практически не сме-шивающегося с исходным раствором.
Экстракция широко применяется в лабораториях и производстве для выделения в более концентрированном состоянии какой-либо составной части раствора или для удаления нежелательной составной части (очистки) исходного раствора. Экстракция может быть однократной или многоступенчатой (с применением на каждой ступени свежей порции растворителя – экстрагента). Схема одноступенчатой экстракции приведена на рис.

Рис. Схема экстракции
При одноступенчатой экстракции исходный раствор, содержащий извлекаемое вещество, перемешивается до наступления равновесия с экстрагентом. После отстаивания экстрагент с извлеченным веществом (экстракт) отделяется от раствора с оставшимся количеством растворенного вещества (рафината).
На основании закона распределения можно рассчитать количество вещества gn, которое остается в растворе после n экстракций одинаковым объемом экстрагента. Если пренебречь изменениями объемов несмешивающихся растворов, то при установлении равновесия для первой ступени экстракции для разбавленных растворов при отсутствии диссоциации или ассоциации имеем:
![]() (19)
(19)
где go – количество извлекаемого вещества в исходном растворе;
g1 – количество извлекаемого вещества, оставшегося в растворе (рафинате) после однократной экстракции;
(go-g1) – количество вещества, перешедшее в экстрагент при равновесии;
V1 – объем раствора, из которого извлекается вещество;
V2 –объем экстрагента.
Из выражения (19) количество вещества, оставшегося в исходном растворе после однократной экстракции, может быть рассчитано по формуле:
![]() (20)
(20)
Для второй ступени экстракции таким же объемом V2 свежей порцией растворителя при равновесии между экстрактом и рафинатом можно записать
![]() (21)
(21)
где с′1 и с′2 – концентрации распределяемого вещества в экстракте и рафинате после второй ступени экстракции в состоянии равновесия;
g2 – количество вещества, оставшегося в рафинате после второй ступени экстракции,
отсюда
![]() (22)
(22)
Учитывая выражение (20) для величины g1, получим
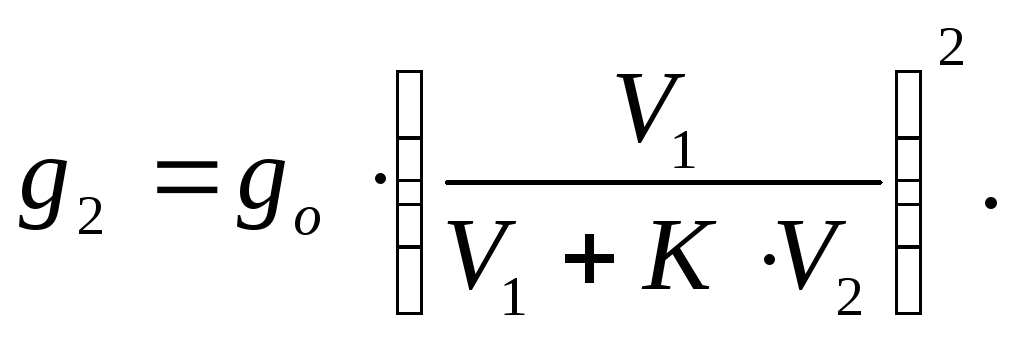 (23)
(23)
Можно показать, что количество вещества, оставшегося в растворе после n экстракций, составляет:
 (24)
(24)
Из полученного уравнения следует, что большей эффективности экстракции (меньшему gn) соответствуют больший объем экстрагента V2, больший коэффициент распределения К и увеличение числа экстракций n (n определяет показатель степени дроби, которая меньше 1).
Общее количество вещества, извлеченного при экстрагировании (gЭ):
gЭ = go – gn , (25)
или
 (26)
(26)
При однократном экстрагировании одним общим объемом nV2 в растворе в соответствии с формулой (20) остается следующее количество вещества:
![]() (27)
(27)
Анализ уравнений (21) и (22) показывает, что многократное экстрагирование порциями растворителя более эффективно, чем однократное экстрагирование общим объемом экстрагента – растворителя. Это связано с тем, что при каждой новой экстракции раствор с извлекаемым веществом приводится в контакт со свежей порцией экстрагента. В химической технологии многократную экстракцию заменяют экстракцией в противотоке, что обеспечивает эффективное извлечение веществ из растворов.
При жидкостной экстракции коэффициентом распределения условились называть отношения концентрации вещества в экстракте к его концентрации в рафинате. При перемене индексации несмешивающихся растворов уравнения (22-27) будут иметь другой вид. Величины коэффициентов распределения приводятся в справочниках.
Наиболее часто встречается извлечение веществ из водных растворов с помощью органических растворителей, мало растворимых в воде. Если в водном растворе экстрагируемое вещество частично диссоциирует, то перед экстракцией его диссоциацию подавляют добавлением электролита с одноименным ионом. Увеличение содержания недиссоциированных молекул в водной фазе способствует переходу вещества в органическую фазу. Для увеличения полноты извлечения экстрагируемого вещества из водной фазы также понижают его растворимость в воде, прибавляя к водному раствору соли (высаливание).
Закон распределения имеет большое значение для анализа процессов, проходящих в условиях соприкосновения несмешивающихся фаз. Расплавы металлов и шлаков представляют собой несмешивающиеся жидкости, между которыми распределяются различные растворяющиеся в них элементы и соединения. Распределение происходит в соответствии с коэффициентами распределения компонентов, зависящими от качественного и количественного состава систем. Шлак по отношению к металлическому расплаву выступает в роли экстрагента, извлекающего из металла такие вредные примеси как сера и фосфор. Это используется для рафинирования (очистки) металлов. Одним из наиболее эффективных методов глубокой очистки металлов является зонная плавка. Метод основан на явлении распределения примеси между контактирующими в процессе плавления твердым металлом и его расплавом, приводящим к переходу примесей в жидкую фазу и получению в результате специальной технологии высокочистых металлов.
Метод экстракции широко используется не только в химической и металлургической промышленности, но и в фармацевтической промышленности, в атомной технологии и радиохимии, в аналитической химии. Применение экстракции позволяет в ряде случае улучшить экологические характеристики производственных процессов.
