
Джерела нагрівання та
.pdf
В.М. Коперсак Теорія процесів зварювання-1. Джерела зварювального нагрівання та теплові процеси при зварюванні
Тепер врахуємо той факт, що зварювальні процеси відбуваються практично завжди при зовнішньому постійному нормальному атмосфер-
ному тиску (Р » 101325 Па), також те, що робота іонізації атома є добуток заряду електрона на потенціал іонізації: Ai = e0Ui , а відношення e0 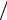 k ≈ 11604 . Підставляючи всі ці цифри у рівняння Сага, отримаємо зру-
k ≈ 11604 . Підставляючи всі ці цифри у рівняння Сага, отримаємо зру-
чний для практичних обчислень, але придатний тільки для стандартних умов нормального атмосферного тиску, вираз:
|
x |
2 |
= 3,29 ´10-7 |
|
5 |
|
- |
11604×U i |
|
|
|
|
|
|
|
|
|
||||
|
× a2 ×T 2 |
× e |
|
T |
|
|||||
|
|
|
|
|
|
|||||
|
|
|
|
|
||||||
1 - x2 |
|
|
|
|
|
|
|
|||
Для випадку, коли ступінь іонізації газу невелика £ (7…10)%, можна вважати знаменник лівої частини наведеного виразу приблизно рівним одиниці: 1 - x2 » 1. Це дає змогу для наближених розрахунків, обмежених
низькими значеннями ступеню |
іонізації |
(для |
|
|
вільної дуги), додатково |
||||||||||||||||||||
|
|
|
|
|
|
|
5 |
|
|
- |
Ai |
|
|
|
|
|
|
|
|
|
|
|
|||
спростити рівняння Сага: |
x2 × Р = a2 × B ×T 2 × e |
kT . |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
− |
Ai |
|||||||||
Звідси легко знаходиться ступінь іонізації: |
|
|
|
x = |
1 |
× a2 × B ×T |
|
× e |
|
, |
|||||||||||||||
|
|
|
2 |
kT |
|||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Р |
|
|
|
|
|||
|
B1 = |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
позначивши постійну: |
B одержимо: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
1 |
|
5 |
|
|
- |
|
Ai |
|
|
|
|
||||||||||||
|
x = a × P- |
|
× B ×T |
|
× e |
|
|
|
|
|
|
||||||||||||||
|
2 |
4 |
2kT |
|
|
|
|
||||||||||||||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
З останнім рівнянням можна виконати всі ті ж самі цифрові маніпуляції, що й в попередньому випадку, тоді для нормального атмосферного тиску і для температури процесу, виміряної по абсолютній шкалі (Кельвіна), приблизне значення ступеню іонізації слабоіонізованої ( x <10% ) плазми дуги допустимо обчислювати із залежності:
5 |
|
- |
5802×U i |
|
x = 5,74 ´10-4 a ×T |
4 |
× e |
T |
|
81

В.М. Коперсак Теорія процесів зварювання-1. Джерела зварювального нагрівання та теплові процеси при зварюванні
Слід зауважити, що британський фізик Мег Над Шах (Сагá)був астрофізиком і свою теорію побудував для слабоіонізованої сильно розрідже-
ної ( P <1×10−5 Па) міжзоряної плазми, яка до того ж існує при дуже низь-
ких температурах {Т ≈ (20…30) К, (−250… −240°С)}. В зв’язку з цим в теорії Сага не враховуються електростатичні взаємодії між зарядженими частками, внутрішні ступені свободи руху часток, та деякі інші фактори, які в електричній дузі, при нормальному тиску і високій температурі, при кількісно і якісно зовсім інших значеннях величини вільного пробігу часток, частоті зіткнень, направленості руху заряджених часток під дією зовнішнього електричного поля, можуть відігравати значну роль.
Тому прикладні розрахунки за формулами Сага нерідко мають досить значні розбіжності з практичними результатами.
Метод обчислення ступеню іонізації В.І. Дятлова
Інший метод наближених розрахунків ступеню іонізації розжареної плазми дуги запропонував свого часу (1961р.) відомий український вчений
вгалузі теорії процесів зварювання В.І. Дятлов.
Вметоді Дятлова, як і в попередньому випадку, процес іонізації подається хімічною реакцією, але в методі Дятлова ця реакція оголошується зворотною ізобарно-ізотермічною, тобто такою, що протікає при постій-
ному тиску і постійній температурі:
a ¬¾¾¾¾® i + e0 ,
T , p = const
де: a – атом, i – іон, e0 – електрон.
Газ, для якого визначається ступінь іонізації, приймається ідеальним. Тоді для такої умовної реакції, як і для всякої іншої, можна записати константу рівноваги для умов постійного тиску K p , як співвідношення парціа-
льних тисків компонентів, згідно з законом діючих мас:
82

В.М. Коперсак Теорія процесів зварювання-1. Джерела зварювального нагрівання та теплові процеси при зварюванні
Кр = pi × pe , pa
де: pa – парціальний тиск нейтральних атомів, pi – парціальний тиск іонів,
pe – парціальний тиск електронів.
Раніше було показано, що парціальні тиски компонентів газової суміші пропорційні молярним долям (молярній концентрації) відповідних компонентів і тиску газової суміші (закон Дальтона). Там же (див. вище) були для даного випадку обчислені відповідні концентрації: іонів (i ), електро-
нів ( e0 ), нейтральних атомів ( a ).
Застосуємо ці відомості й тепер для обчислення парціальних тисків компонентів суміші іонів, електронів та нейтральних атомів:
pi = |
|
x |
× Р, |
pe = |
|
x |
× Р , |
pa = |
1− x |
× Р , |
|
|
|
|
|
||||||
1 |
+ x |
1 |
+ x |
1+ x |
||||||
де: x – ступінь іонізації газу; |
P – тиск газу (зовнішній тиск). |
|||||||||
Ці значення парціальних тисків підставимо у вираз константи рівноваги,
|
|
|
x2 |
|
отримаємо: |
K p = |
|
|
× Р |
|
|
|||
|
1 |
- x2 |
||
Зварювальна дуга існує, як правило, при нормальному зовнішньому |
||||
тиску, тиск в дузі приймається рівним зовнішньому, а останній можна домовитись вважати рівним одиниці, виражаючи парціальні тиски в долях цієї одиниці: Pзовн =1, відповідно, сума парціальних тисків компонентів буде рівна одиниці: pi + pe + pa =1.
Тоді вираз константи рівноваги ( K P ) процесу іонізації, представлено-
го як хімічна реакція, для умов постійного тиску дещо спрощується:
K p = |
|
x2 |
|
- x2 |
|
1 |
||
83

В.М. Коперсак Теорія процесів зварювання-1. Джерела зварювального нагрівання та теплові процеси при зварюванні
З іншого боку, константу рівноваги будь-якої зворотної хімічної реакції, яка відбувається в умовах постійного тиску і постійної температури (ізобарно-ізотермічний процес) можна знайти з рівняння ізотерми хімічної
реакції Вант-Гоффа: |
ln K p = - |
GТ |
||
RT |
||||
|
|
|
||
де: T – |
температура, при якій відбувається реакція; |
|||
R – |
універсальна газова постійна, R = 8,31451 Дж/(моль×К); |
|||
GT – зміна ізобарного потенціалу хімічної реакції при заданій температурі T .
Тобто, ступінь іонізації і термодинамічні показники процесу іонізації, представленого як хімічна реакція, пов’язує залежність:
|
x2 |
|
DG |
|
ln |
|
= - |
Т |
|
1- x2 |
RT |
|||
У випадку, який розглядається тут, |
GT означає зміну ізобарного по- |
|||
тенціалу в результаті процесу іонізації. Для обчислення цієї величини скористаємось відомою з Термодинаміки формулою Уліха, яка дає змогу обчислювати прирости ізобарного потенціалу хімічних реакцій, при умові незалежності від температури теплоємкості реагентів (C p = const ):
DGT = DH 2980 - T × DS2980 - T × DC 0p × M 0
де: DH 2980 - ентальпія іонізації при стандартних термодинамічних умовах ( P =101325 Па, T = 298,16 К);
DS2980 – ентропія іонізації при стандартних термодинамічних умовах;
DC0p – зміна теплоємкості в результаті іонізації, теж при стандартних термодинамічних умовах.
T – температура, при якій відбувається процес іонізації; M 0 – спеціальний множник, який враховує температуру:
84

В.М. Коперсак Теорія процесів зварювання-1. Джерела зварювального нагрівання та теплові процеси при зварюванні
|
|
T |
1 |
|
1 |
T |
|
T |
|
298,16 |
|
|
M 0 = |
|
∫ |
dT - |
∫dT = ln |
+ |
-1; |
||||||
T |
|
298,16 |
|
|||||||||
|
|
298 |
T |
298 |
|
|
T |
|||||
|
|
|
|
|
|
|
|
|||||
Необхідні для роботи з формулою Уліха прирости термодинамічних функцій: ентальпії DH 2980 , ентропії DS2980 та теплоємкості DC0p обчислю-
ються як сума кінцевих (по рівнянню реакції) значень відповідних функцій за винятком (мінус) суми початкових їх значень, тобто:
DH 2980 = Hi0 + He0 - H a0 ; DS2980 = Si0 + Se0 - Sa0 ;
C 0p = (C 0p )i + (C 0p )e − (C 0p )a
Тут позначено: i – іони, e0 – електрони, a – нейтральні атоми.
Тепер приймемо, що за термодинамічними характеристиками атом мало відрізняється від іона, утвореного з цього ж атома відніманням від нього лише одного валентного електрона. Тобто - будемо вважати, що значення термодинамічних функцій іонів практично співпадають в цьому випадку зі значеннями термодинамічних функцій атомів:
DHio » DH ao ; |
DSio » DSao ; |
(C op ) |
≈ (C op ) |
; |
|
|
i |
a |
|
В такому разі виявляється, що зміни ентальпії, ентропії та теплоємкості в результаті іонізації, представленої як хімічна реакція, є енергетичні зміни тільки в стані електронів:
DH 2980 |
= DH e0 ; |
DS2980 = DSe0 ; |
C |
0p = (C |
0p ) |
; |
|
|
|
|
|
e |
|
В світлі цих суджень зміну ізобарного потенціалу виразить залеж- |
||||||
ність: |
DG = DH e0 - T × DSe0 - T × (C |
0p ) |
× M 0 |
|
|
|
|
|
|
e |
|
|
|
За таких передумов кінцеве рівняння для обчислень ступеню іонізації газу (x) за методом В.І. Дятлова, при стандартному зовнішньому атмосферному тиску ( Pатм =101325 Па), приймає вигляд:
85

В.М. Коперсак Теорія процесів зварювання-1. Джерела зварювального нагрівання та теплові процеси при зварюванні
|
|
x2 |
DHe0 -T × D Se -T × D(C 0p )e × M 0 |
|
|
|
|
||
|
ln |
|
= - |
|
|
|
|
|
|
1 - x2 |
R ×T |
|
|
|
|
||||
Всі компоненти цього рівняння були докладно розглянуті вище. |
|
|
|
||||||
Зміни термодинамічних функцій стану електронів ( DHe0 ; DSe0 ; |
(C |
0p ) |
), |
||||||
|
|
|
|
|
|
|
|
e |
|
в свою чергу, неважко обчислити наступним чином:
а) приріст ентальпії електронів в процесі іонізації DHe0 може бути до-
сягнутий тільки за рахунок роботи іонізації. Якщо на відрив одного електрона від атома витрачається робота іонізації A i = e0 ×Ui (де,
нагадаємо, e0 – заряд електрона, Ui – потенціал іонізації), то на іоні-
зацію одного моля газу витратиться енергії у стільки разів більше, скільки атомів газу є в одному молі. Але ця кількість давно і точно відома – це є число Авогадро: N0 = 6,022 ´10−23 для стандартних термодинамічних умов.
Отже, зміна ентальпії буде: DH e0 = е0 ×U i × N 0 ;
б) приріст ентропії процесу іонізації DSe0 в стандартних термодинамі-
чних умовах є, як це виявилось раніше, ентропія вільних електронів, так званого «електронного газу», а це – таблична величина:
DSe0 = Se = 20,64 Дж/(моль×К);
в) зміна теплоємкості в результаті іонізації виявляється при цих припущеннях теплоємкістю вільних електронів, «електронного газу»
(C0p )e . Вище було оголошено газ, який іонізується, ідеальним, але
в цьому випадку властивості ідеального газу притаманні й одному з компонентів цієї системи – вільним електронам. Як відомо, теплоємкість ідеального газу в процесах, які відбуваються при по-
86

В.М. Коперсак Теорія процесів зварювання-1. Джерела зварювального нагрівання та теплові процеси при зварюванні
стійному тиску, складає |
5 |
R , де: R - універсальна газова постій- |
||||
|
||||||
|
|
2 |
|
|||
на. Отже: (C |
0p ) |
= |
5 |
R . |
|
|
|
|
|||||
|
e |
2 |
|
|
|
|
Рівняння Дятлова можна зробити зручнішим для практичних застосувань, якщо підставити в нього всі наведені вище постійні і табличні величини. Після підстановок рівняння набуде вигляду:
|
|
|
x2 |
11604 ×U |
i |
|
|
|
|
ln |
|
|
= - |
|
+ 2,5M 0 + 2,482 |
; |
|
|
|
T |
|
|||||
|
1 |
- x2 |
|
|
|
|||
де: x – ступінь іонізації; |
Ui – потенціал іонізації; |
|||||||
T – температура (абсолютна, К);
M 0 - залежний від температури множник:
M 0 = ln |
T |
+ |
298,16 |
- 1 |
298,16 |
|
|||
|
|
T |
||
Іонізація суміші газів
Всі викладені вище теоретичні висновки відносяться до процесу іонізації чистої речовини в газоподібному стані з відомим, або наперед заданим потенціалом іонізації Ui . Суміш двох, або кількох газів іонізується ін-
акше, ніж кожна з цих речовин окремо, тому що вільні електрони («електронний газ»), які утворюються в результаті іонізації, будуть спільним для всіх складових газової суміші.
Ступінь іонізації суміші ( хсм) можна подати як середньозважену ве-
личину ступенів іонізації кожного окремого компоненту: хсм = Σ хiCi ,
ΣCi
де: xi – ступінь іонізації кожного (i -того) компоненту;
Ci – концентрація кожного (i -того) компоненту;
i – по кількості компонентів, які можуть іонізуватись.
87

В.М. Коперсак Теорія процесів зварювання-1. Джерела зварювального нагрівання та теплові процеси при зварюванні
В суміші, яка іонізується, завжди присутні ще й вільні електрони («електронний газ»), але вони іонізуватись не можуть, тому ∑Ci ¹ 1. На-
приклад, для суміші випарів заліза ( Fe ) та калію ( K ) це буде мати вигляд:
|
|
|
= xFe × CFe + xK ×CK |
|
x |
см |
|||
|
|
|
CFe + CK |
|
|
|
|
|
|
Концентрації учасників процесу CFe , CK слід вираховувати окремо,
залежно від ступеню іонізації кожного компонента, бо ступінь іонізації визначає кількість електронів в суміші газів. Потрібно складати систему взаємозв’язаних рівнянь і, таким чином, задача стає важкою для практичної реалізації.
Крім того, прямі виміри (спектральний аналіз світіння стовпа дуги) показали, що реальні значення ступеню іонізації суміші газоподібних компонентів не відповідають простому правилу адитивності, наведеному вище. Теорія пояснює це тим, що електрони, які, як продукт іонізації, завжди присутні в такій суміші, не іонізуються, але своєю присутністю ніби розбавляють газовий розчин із суміші інших компонентів і, таким чином, утруднюють взаємодії між ними. Поява надлишку електронів приводить до зсуву рівноваги реакцій іонізації вліво. Причому, цей зсув тим більший, чим більший потенціал іонізації компонента. Тобто, чим більший потенціал іонізації компонента суміші, тим менш охоче розстається він з електронами і навпаки: чим менший потенціал іонізації компонента суміші, тим легше віддає він свої електрони в процесі іонізації.
Теоретичне обґрунтування цього феномена виконала російська дослідниця іонізованої плазми О.П.Семенова (1946 р.), яка для характеристики іонізації суміші газів запропонувала спеціальний показник ефективний потенціал іонізації (Uеф), який розраховується із залежності:
88

В.М. Коперсак Теорія процесів зварювання-1. Джерела зварювального нагрівання та теплові процеси при зварюванні
|
|
|
|
|
|
− |
e0 (U i )1 |
|
|
|
|
− |
e0 (U i )2 |
|
|
|
− |
e0 |
(U i |
)n |
|
|
|
|
|
N |
|
|
N |
2 |
|
|
|
N |
n |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
e U |
еф |
= −kTln |
|
1 |
e |
|
kT |
+ |
|
e |
|
kT |
+ ... + |
|
e |
|
kT |
|
|
||
|
|
|
|
|
|
|
|
|
|||||||||||||
0 |
|
|
|
|
|
|
N |
|
|
|
N |
|
|
|
|||||||
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
де: N1, N 2 ,..., Nn − концентрації компонентів суміші газів;
(Ui )1 , (Ui )2 ,..., (Ui )n − потенціали іонізації компонентів;
N = N1 + N2 + ... + Nn − загальна (сумарна) концентрація тих ком-
понентів суміші, які можуть іонізуватись.
Ефективним потенціалом іонізації суміші газів називається поте-
нціал іонізації такого уявного газу, ступінь іонізації якого при заданій температурі і тиску дорівнює ступеню іонізації реальної суміші газів при тих же умовах.
Запропоноване О.П.Семеновою, вишукане за формою рівняння, виявилось недостатньо сумісним з результатами практичних вимірювань. Через це для розрахунків характеристик зварювальної дуги, особливо для випадків невисоких ступенів іонізації (7…10 % − вільна дуга), В.В.Фролов вирішив обернену задачу: знаючи (або правильніше, задаючи) ступінь іонізації суміші газів, він знайшов потенціал іонізації і присвоїв його деякому уявному газові. Потім, користуючись спрощеною формою рівняння Сага для малих ступенів іонізації і нехтуючи приростами парціальних тисків pi
компонентів за рахунок їх іонних та електронних складових, В.В.Фролов знайшов суми ступенів іонізації i − тих компонентів, віднесені до відповідних концентрацій, що дало йому змогу запропонувати просту і ефективну залежність, відому нині, як формула Фролова:
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
2 k T |
i =n |
|
|
|
е |
(U |
i |
) |
|
|
||
|
|
|
|||||||||||
Uеф = - |
|
× ln ∑ |
|
2 |
|
- |
0 |
|
i |
|
|
|
|
|
pi |
2kT |
|
|
|
||||||||
е |
× exp |
|
|
||||||||||
|
0 |
i =1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
де: U еф– ефективний потенціал іонізації суміші газів;
89

В.М. Коперсак Теорія процесів зварювання-1. Джерела зварювального нагрівання та теплові процеси при зварюванні
T – температура (абсолютна, за шкалою К);
pi – відносний парціальний тиск i −того компоненту;
(Ui )i – потенціал іонізації i −того компоненту; n – кількість компонентів в суміші;
k – постійна Больцмана;
e0 – заряд електрона (тут, як і завжди в такого роду розрахунках,
використовується абсолютна величина заряду).
Для довідки: відношення 2 k 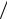 е0 ≈1
е0 ≈1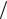 5800 і таке його значення часто зустрічається в практичних застосуваннях формули Фролова.
5800 і таке його значення часто зустрічається в практичних застосуваннях формули Фролова.
Наприклад, для суміші аргону і парів алюмінію, яка може створюватись в дуговому проміжку при зварюванні в аргоні алюмінію і його сплавів, розрахунки показують таку (див. рис.) залежність ефективного потенціалу іонізації цієї суміші від концентрації випаруваного алюмінію в ній.
Можна легко бачити, що ефективний потенціал іонізації швидко зменшується при додаванні в суміш досить малих концентрацій легкоіонізованого компонента (яким в даному випадку виступає алюміній).
Звідси можна зробити важливий висновок: іонізація суміші кількох газів відбувається за рахунок масової іонізації атомів компонента з найменшим потенціалом іонізації.
Таким чином, властивості дуги в значній мірі визначає саме той компонент, який найлегше іонізується.
Перенесення струму в стовпі зварювальної дуги
Ефективність іонізації, а, отже, і стабільність горіння дуги визначається компонентом з найнижчим потенціалом іонізації. Саме цей компонент, за рахунок більшого ступеню іонізації, постачає в дугу головні носії елект-
90
