- •1. Загальні правила роботи в лабораторії
- •2. Запобіжні засоби і перша допомога при нещасних випадках
- •3. Основний лабораторний хімічний посуд
- •4. Зборка приладів
- •5. Миття і сушка хімічного посуду
- •5. Використання літератури і правила складання звіту
- •1. Нагрівання
- •2. Охолоджування
- •3. Вимірювання і регулювання температури
- •4. Подрібнення і перемішування
- •5. Розчинення і Властивості деяких органічних розчинників
- •6. Сушка і основні осушувачі
- •7. Фільтрування
- •1. Кристалізація
- •2. Возгонка (сублімація)
- •3. Екстракція
- •4. Перегонка
- •5. Хроматографія
- •1. Температура плавлення
- •2. Температура кипіння
- •3. Відносна густина
- •4. Показник заломлення
- •5. Молекулярна маса
- •1. Якісний аналіз
- •2. Фізико-хімічні методи встановлення структури речовини
- •3. Ідентифікація невідомої речовини
- •1. Відновлення воднем і реакції гідрУвання
- •2. Одержання металів, їх сплавів і деяких неметалів
- •Питомі теплові ефекти (q) відновлення оксидів алюмінієм
- •3. Одержання металів і деяких неметалів відновленням водних розчинів солей
- •4. Хлорування металів, неметалів і оксидів
- •5. Бромування металів і неметалів
- •6. Йодування металів, неметалів і оксидів
- •7. Одержання сульфідів, селенідів і телуридів
- •8. Нітрування. Одержання нітридів
- •9. Одержання карбідів
- •10. Термічне розкладання речовин з метою одержання оксидів
- •11. Зневоднення крісталогідратів
- •12. Одержання солей
- •1. НітрУвання
- •2. Нітрозування
- •3. Сульфування
- •4. Галогенування
- •5. Алкілювання
- •6. Ацилювання
- •7. ДіазоТуВаНня і Реакції діазосполук
- •8. АзоспОлуЧення
- •9. Відновлення
- •10. Окислення
- •11. Амінування
- •12. Гидроксилювання
- •13. Конденсація
- •14. Полімеризація і поліконденсація
5. Розчинення і Властивості деяких органічних розчинників
Розчинення – це процес утворення розчину (прозора гомогенна рідина) в результаті змішування якої-небудь речовини (газ, рідина, тверде тіло) з іншою рідиною, розчинником. Основною умовою цього процесу є відсутність хімічної взаємодії між речовиною, що розчиняється і розчинником, отже, після видалення розчинника, розчинена речовина повинна залишитися незмінною.
Процес розчинення твердих і рідких речовин завжди пов'язаний з витратою енергії, тобто з поглинанням тепла; це пояснюється тим, що молекули речовини розподіляються в більшому об'ємі. При розчиненні газів відбувається зворотне явище – виділення тепла; воно пов'язане із зменшенням об'єму, в якому розподіляються молекули газу. Проте при розчиненні твердих і рідких речовин часто спостерігається виділення тепла, яке вказує, що теплота гідратації даної твердої речовини більша, ніж теплота розчинення відповідного гідрату.
Швидкість розчинення твердої речовини залежить від розмірів її частинок. Чим дрібніші окремі частинки речовини, тим більше поверхня контактів між рідкою і твердою фазами і, отже, тим швидше відбувається розчинення. Проте бувають випадки, коли тонкоподрібнена речовина при висипанні у воду не змочується і плаває на поверхні води; в таких випадках порошок спочатку обливають невеликою кількістю чистого спирту, а потім вже висипають його у воду. Зрозуміло, що застосовувати спирт можна лише в тому випадку, якщо він хімічно не діє на речовину або її розчин.
Часто розчинність твердої речовини можна підвищити, якщо розчин нагрівати. Але при цьому потрібно врахувати, що деякі солі не підкоряються цьому правилу – розчинність їх або знижується з підвищенням температури, або підвищується дуже незначно.
Майже всі газоподібні речовини здатні в тій чи іншій мірі розчинятися у воді або органічних розчинниках. Так, наприклад, аміак і хлороводень дуже добре поглинаються водою, а кисень і водень володіють меншою розчинністю у воді. Розчинність газів у рідинах, як правило, зменшується з підвищенням температури або зниженням тиску. Тому для видалення розчиненого газу рідину нагрівають або вукуумують.
Процес розчинення в хімічній лабораторії використовують для багатьох цілей: для отримання гомогенного (однорідного) середовища, тобто для створення більш сприятливих умов, що забезпечують найбільшу поверхню зіткнення реагуючих речовин; для відділення речовин одна від одної і очищення продуктів реакції шляхом перекристалізації; для зміни швидкості або напряму реакції; для проведення реакції за відсутності води й ін.
Розрізняють водні і неводні розчини. До водних відносяться розчини більшості солей, лугів, кислот; до неводних належать розчини в органічних розчинниках, наприклад в спиртах і ефірах, ацетоні й ін.
Розчинники широко застосовуються для розчинення хімічних рідких і твердих речовин, наприклад масел, жирів, смол і т.п. Крім того, вони використовуються для розчинення неорганічних речовин і в практиці аналітичної хімії для титрування неводних. Як правило, в лабораторній практиці використовуються чисті органічні розчинники, які одержують шляхом очищення дешевих технічних продуктів.
Дуже багато розчинників вогненебезпечні і отруйні. Тому при роботі з ними завжди слід дотримувати всі запобіжні засоби.
Етиловий спирт. Етиловий 95,6%-ний спирт-ректифікат має температуру кипіння 78 °С і є постійно киплячою азеотропною сумішшю, що містить 4,4% води. Для багатьох цілей необхідний 100 або 99,9%-ний етиловий спирт або так званий абсолютний, вперше був отриманий російським академіком Ловіцем.
Вода, що міститься в етиловому спирті-ректифікаті, не може бути видалена простою перегонкою. В лабораторії зневоднення спирту можна проводити при нагріванні з осушуючими речовинами, такими як оксид кальцію або безводний сульфат міді (ii). Одержання зневодненого 99,5%-ного етилового спирту за допомогою оксиду кальцію і безводного сульфату міді проводиться в колбі зі зворотним холодильником, із хлоркальцієвою трубкою для захисту спирту від попадання вологи з повітря. Товарний оксид кальцію, у вигляді шматків розміром з лісовий горіх, перед використанням прожарюють в електричній печі протягом 1 – 2 год. Негайно, після охолоджування, переносять оксид кальцію в банку, що добре закривається.
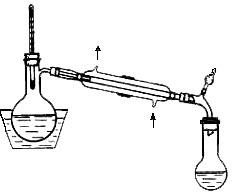
Круглодонну колбу місткістю 1 л заповнюють 500 мл 95,6%-ного етилового спирту і 125 г свіжопрожареного оксиду кальцію. Суміш кип'ятять на водяній бані протягом 6 год, а потім залишають на ніч: за цей час шматки оксиду кальцію переважно перетворюються на порошкоподібний гідроксид кальцію. Після охолоджування спирт відганяють, на приладі для перегонки висушених низькокиплячих розчинників, приймачем служить склянка, в якій зберігатиметься абсолютний спирт (рис. 25). Перегонку спирту спочатку ведуть на слабокиплячій водяній бані, до якої додають трохи повареної солі, а потім – на киплячій, причому перші 15 мл дистиляту відкидають. Перегонка йде досить повільно і значна кількість спирту утримується твердим залишком. Така обробка дозволяє довести міцність спирту до 99,5%, що достатньо для більшості робіт.
При застосуванні для зневоднення спирту сульфату міді (II) поступають таким чином. Кристалогідрат CuSO4·5H2O нагрівають при перемішуванні в нікелевій або фарфоровій чашці до 220 °С доти, поки він не перетвориться на білий порошок. Отриманий зневоднений сульфат міді після охолоджування додають до спирту в кількості 200 – 250 г на 1 л спирту. Суміш кип'ятять із зворотним холодильником і хлоркальцієвою трубкою протягом 6 год. і залишають стояти на ніч, а наступного дня відганяють (рис. 25). Таку обробку повторюють ще раз. Для зневоднення спирту непридатний хлористий кальцій і сірчана кислота, оскільки хлористий кальцій утворює зі спиртом кристалогідрат, а сірчана кислота – ефіри.
|
|
|
Рис 25. Прилад для перегонки висушених низькокиплячих розчинників |
Для одержання безводного абсолютного етилового спирту можна застосовувати магній, натрій; у даний час широко застосовується абсолютування спирту методом азеотропної суміші з бензолом.
Метиловий спирт. Синтетичний метиловий спирт з температурою кипіння 64,7 °С придатний для більшості робіт. Як правило, він містить 1 – 2% води, сліди ацетону (до 0,1%) і формальдегіду.
Зручний спосіб видалення ацетону полягає в наступному: суміш 500 мл метилового спирту, 25 мл фурфуролу і 60 мл 30% водного розчину гідроксиду натрію нагрівають зі зворотним холодильником 6 – 12 год., при цьому утворюється смола, яка містить дифурфуральацетон й висококиплячі речовини.
Потім метиловий спирт відганяють з дефлегматором або на колонці, відкидаючи перші 15 – 20 мл, в яких містяться сліди формальдегіду.
При роботі з метиловим спиртом необхідно дотримувати всі міри обережності, оскільки він дуже легко загорається і утворює з повітрям вибухонебезпечні суміші. Крім того, слід пам'ятати, що метиловий спирт дуже токсичний: тривале вдихання його пари викликає пошкодження зору, перебої в роботі серця, втрату свідомості, а прийом всередину навіть невеликих кількостей приводить до сліпоти і смерті.
Діетиловий ефір. Товарний діетиловий ефір з температурою кипіння 34,6 °С містить невелику кількість води і етилового спирту При тривалому зберіганні на світлі і при доступі повітря ефір поволі окислюється з утворенням альдегідів, кислот і нестійких, вибухонебезпечних перекисних сполук: гідроперекису оксіетилу, перекису етилу і т.д.
Слід знати, що всі прості ефіри (особливо диізопропіловий) утворюють перекиси. Часто в лабораторіях відбуваються сильні вибухи, викликані перегонкою неочищеного ефіру. Тому перш ніж почати роботу з ефіром, слід обов'язково перевірити його на наявність перекисних сполук.
Присутність перекисів можна виявити, струшуючи декілька мл ефіру з рівною кількістю 2%-ного розчину йодиду калію (або йодиду натрію), що підкислений декількома краплями соляної або сірчаної кислоти. Поява, через деякий час, бурого кольору ефірного шару вказує на присутність перекисів.
Інший спосіб виявлення перекисів полягає в наступному: розчиняють 1 мл дихромату натрію в 1 мл води, додають краплю розбавленої сірчаної кислоти, пробу ефіру і збовтують. Синій колір ефірного шару указує на наявність перекисних сполук.
Видалення перекисів з ефіру можна проводити декількома способами. Найпростіший спосіб – струшування ефіру з порошкоподібним гідроксидом калію (на 1 л ефіру 70 г КОН). Інший спосіб – промивання ефіру розчином сульфатом заліза. Для промивання 1 л ефіру достатньо 10 – 20 мл розчину, що складається з 60. г кристалічного сульфату заліза, 6 мл концентрованої сірчаної кислоти і 110 мл води. Перекиси можна також видаляти, струшуючи 1 л ефіру з 20 – 25 мл насиченого на холоді розчину сульфіту натрію в 50 мл води. Після відстоювання ефір відділяють і промивають 0,5% розчином перманганату калію для перетворення ацетальдегіду в оцтову кислоту. Виділений ефір потім промивають 5% розчином гідроксиду натрію, водою і сушать протягом доби, вводячи 150 – 200 г гранульованого хлористого кальцію на 1 л ефіру. Потім хлористий кальцій фільтрують через складчастий фільтр, а ефір збирають в склянку темного кольору з корковою пробкою, стежачи при цьому за тим, щоб всі пальники поблизу були погашені.
Для отримання абсолютного ефіру в склянку з висушеним ефіром додають тонко нарізаний металевий натрій – на 1 л ефіру 5 г натрію. Склянку щільно закривають корковою пробкою зі вставленою в неї хлоркальцієвою трубкою. Після 24 год. стояння вносять ще 2,5 г натрію і через 12 год. ефір переливають в склянку з темного скла з якісною корковою пробкою. Для запобігання ефіру від утворення перекисів до нього додають невелику кількість дифеніламіну або фосфорний ангідрид або поміщають декілька шматків мідного дроту.
Діетиловий ефір є розчинником, що надзвичайно легко загорається, тому необхідно стежити за тим, щоб на відстані не менше 3 м від місця роботи з ефіром не було вогню. Наливати ефір потрібно за допомогою невеликої воронки з широкою відвідною трубкою; переганяти ефір необхідно на водяній бані в приладі для перегонки низькокиплячих безводних розчинників (рис. 25).
Петролейний ефір. Петролейний ефір – це фракція нафти, яка кипить при 40 – 70 °С. Він містить ненасичені і ароматичні вуглеводні; очищають його струшуванням протягом 20 хв. з двома або трьома порціями концентрованої сірчаної кислоти (на 1 л петролейного ефіру 100 мл кислоти). Після відділення нижнього кислотного шару ефір промивають в ділильній воронці декількома порціями концентрованого розчину перманганату калію в 10%-ній сірчаній кислоті до незникаючого фіолетового забарвлення водного шару. Потім петролейний ефір промивають водою, 10% розчином гідроксиду натрію, знову водою, сушать безводним хлористим кальцієм, і як діетиловий ефір переганяють (рис. 25) на водяній бані з закритим електрообігрівом. Зберігають отриманий ефір над металевим натрієм.
Петролейний ефір утворює з повітрям вибухонебезпечні суміші і має низьку температуру спалаху, отже, необхідно дотримуватися особливої обережності при роботі з ним. Пари петролейного ефіру можуть викликати отруєння.
Ацетон. Чистий ацетон з температурою кипіння 56,2 °С можна виділити з технічного ацетону, який містить воду, метиловий спирт і оцтову кислоту. Для очищення і отримання абсолютного ацетону можна застосувати декілька способів. Один з них полягає в нагріванні ацетону з порошкоподібним перманганатом калію. Технічний ацетон (1 л) поміщають в колбу, забезпечену зворотним холодильником, вносять туди порціями 6 – 7 г розтертого в порошок перманганату калію і кип'ятять на водяній бані протягом 5 – 6 год. до незникаючого забарвлення рідини. Потім замінюють зворотний холодильник низхідним і відганяють ацетон, який вже звільнений від метилового спирту, але ще містить воду. Для висушування закривають зворотний холодильник хлоркальцієвою трубкою, вносять у колбу безводний хлористий кальцій (120 г на 1л ацетону) і кип'ятять на водяній бані протягом 4 – 5 год. Після охолоджування швидко переливають ацетон на свіжий хлористий кальцій і знову кип'ятять його 4 – 5 год. Після цього замінюють зворотний холодильник низхідним (рис. 25) і відганяють ацетон в охолоджуваний льодом приймач з коричневого скла.
Інший спосіб очищення ацетону полягає в отриманні сполук ацетону з йодним натрієм (NaJ·3СН3СОСН3), які при нагріванні розкладається з виділенням ацетону. В колбу, забезпечену зворотному холодильником, поміщають 100 г чистого тонко розтертого йодиду натрію, вносять 400 мл ацетону і кип'ятять на водяній бані до повного розчинення осаду. Потім охолоджують розчин до –8 °С сумішшю льоду і солі, кристали, що виділилися, фільтрують на воронці Бюхнера, переносять у перегонну колбу, сполучену з низхідним холодильником, і при слабому нагріванні переганяють ацетон у приймач, охолоджуваний льодом.