- •1. Загальні правила роботи в лабораторії
- •2. Запобіжні засоби і перша допомога при нещасних випадках
- •3. Основний лабораторний хімічний посуд
- •4. Зборка приладів
- •5. Миття і сушка хімічного посуду
- •5. Використання літератури і правила складання звіту
- •1. Нагрівання
- •2. Охолоджування
- •3. Вимірювання і регулювання температури
- •4. Подрібнення і перемішування
- •5. Розчинення і Властивості деяких органічних розчинників
- •6. Сушка і основні осушувачі
- •7. Фільтрування
- •1. Кристалізація
- •2. Возгонка (сублімація)
- •3. Екстракція
- •4. Перегонка
- •5. Хроматографія
- •1. Температура плавлення
- •2. Температура кипіння
- •3. Відносна густина
- •4. Показник заломлення
- •5. Молекулярна маса
- •1. Якісний аналіз
- •2. Фізико-хімічні методи встановлення структури речовини
- •3. Ідентифікація невідомої речовини
- •1. Відновлення воднем і реакції гідрУвання
- •2. Одержання металів, їх сплавів і деяких неметалів
- •Питомі теплові ефекти (q) відновлення оксидів алюмінієм
- •3. Одержання металів і деяких неметалів відновленням водних розчинів солей
- •4. Хлорування металів, неметалів і оксидів
- •5. Бромування металів і неметалів
- •6. Йодування металів, неметалів і оксидів
- •7. Одержання сульфідів, селенідів і телуридів
- •8. Нітрування. Одержання нітридів
- •9. Одержання карбідів
- •10. Термічне розкладання речовин з метою одержання оксидів
- •11. Зневоднення крісталогідратів
- •12. Одержання солей
- •1. НітрУвання
- •2. Нітрозування
- •3. Сульфування
- •4. Галогенування
- •5. Алкілювання
- •6. Ацилювання
- •7. ДіазоТуВаНня і Реакції діазосполук
- •8. АзоспОлуЧення
- •9. Відновлення
- •10. Окислення
- •11. Амінування
- •12. Гидроксилювання
- •13. Конденсація
- •14. Полімеризація і поліконденсація
4. Хлорування металів, неметалів і оксидів
Хлорування металів і неметалів хлором. При виборі конструкції установки для хлорування необхідно враховувати: фізичні і хімічні властивості вихідної речовини і одержуваного хлориду; чистоту хлору; кількість одержуваного хлориду.
Реакції хлорування протікають при нагріванні і з виділенням значних кількостей теплоти. Тому, якщо хлор подають у реактор з рівномірною швидкістю і в потрібній кількості, процес протікає автотермічно і підігрівати речовину потрібно тільки на початку реакції. Багато вихідних речовин (сірка, селен, цинк, кадмій, алюміній) плавляться, тому їх слід поміщати в реактор для хлорування в лодочках. Якщо ж речовина поміщається без лодочки, то потрібно забезпечити горизонтальне положення реактора, щоб розплавлена речовина не стікала.
Одержувані хлориди при температурі хлорування можуть випаровуватися або знаходитися в твердому або рідкому стані, що впливає на швидкість реакції. При випаровуванні хлоридів (наприклад, FeCl3, A1C13, GeCl4, SnCl4, S2Cl2) вони струменем хлору виносяться з реакційного простору і конденсуються на більш холодних стінках приладу. Якщо ж хлорид утворюється в твердому (СоС12, NiCl2 і т.д.) або рідкому стані (МnС12), то він покриватиме поверхню хлорованої речовини і уповільнюватиме реакцію хлорування.
При тиску в 15 Па випаровування хлоридів йде з невеликою швидкістю, їх повільну сублімацію можна вести і за цих умов. При 150 Па сублімація йде зі значною швидкістю. Якщо потрібно, щоб одержання і випаровування йшло одночасно, то реакцію слід вести при температурах, коли тиск пари рівний або близький до 1013 Па. В цьому випадку над хлорованою речовиною можна пропускати сильний струмінь хлору. Випаровування хлоридів дозволяє відділяти продукт реакції від вихідної речовини. Хлорування можна вести і при більш низьких температурах. Наприклад, хлорид двовалентного марганцю кипить при 1231°С, а при 844°С, тиск його пари рівний 13 Па. Дослід показує, що якщо хлорування марганцю у вигляді шматочків у 2 – 4 мм проводити при 700 – 800°С, то через 1 – 2 год. він повністю перетворюється на хлорид, хоча марганець під час процесу покритий шаром розплавленого хлориду.
Оксидні плівки, що є на поверхні металів, у більшості випадків хлоруванню не піддаються. Отже, вони можуть забруднювати одержуваний хлорид, якщо він не переганяється з реакційного простору. До того ж вони уповільнюють процес хлорування. За наявності в хлорі кисню і пари води ці домішки можуть вступати в реакції з хлорованою речовиною і утворювати оксиди. В цих випадках хлорування речовин, які володіють великою спорідненістю до кисню (кремній, бор, хром) і утворюючих щільні оксидні плівки, сильно сповільнюється. В той же час, якщо хлор ідеально чистий і речовини не містять оксидних плівок, хлорування протікає при кімнатній температурі. Наприклад, при розмелюванні кремнію і бору в атмосфері чистого хлору хлориди легко утворюються і без нагрівання.
Залежно від властивостей вихідних і кінцевих речовин для хлорування застосовують різні установки. Хлорування речовин, що утворюють рідкі і легкокиплячі хлориди (фосфор, сірка, селен, телур, олово і т. д.), проводять у приладі зображеному на рисунку 75.
|
|
|
Рис. 75. Одержання легкокиплячих хлоридів: 1 – лічильник пухирців з концентрованою сірчаною кислотою; 2 – хлорована речовина; 3 – трубка з тугоплавкого скла; 4 – холодильник; 5 – приймач; 6 – хлоркальцієва трубка. |
Речовину для хлорування в кількості 5 – 10 г поміщають у трубку з тугоплавкого скла, витісняють хлором повітря і підігрівають трубку газовим пальником до початку реакції, що помітно по виділенню теплоти і утворенню своєрідного туману. Розміри приладу і особливо розміри холодильника і приймача вибирають відповідно до наважки речовини. При невеликих наважках ці частини установки повинні бути невеликими, оскільки деяка кількість продукту втрачається на стінках холодильника і приймача. Бажано окремі частини приладу сполучати на шліфах. В крайньому випадку гумові переходи між окремими частинами приладу повинні бути по можливості коротшими, оскільки хлор і особливо хлориди діють на каучук.
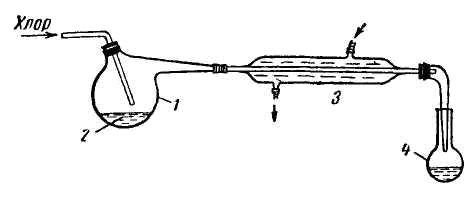
Для одержання легкокиплячих хлоридів, наприклад хлоридів олова, сірки, використовується установка, наведена на рисунку 76. У реторту поміщають речовину (сірку, гранульоване олово і т.д.) і при невеликому нагріванні пропускають хлор. Пари хлориду конденсуються в холодильнику і стікають в приймач.
|
|
|
Рис. 76. Одержання легкокиплячих хлоридів хлоруванням легкоплавких металів або неметалів: 1 – реактор; 2 – розплавлені метал або неметал; 3 – холодильник; 4 – приймач. |
Хлориди, які переганяються при 100 – 350°С (FeCl3, AlCl3, CdCl2, ZnCl2), одержують в приладі, зображеному на рисунку 77. Речовину для хлорування 2 поміщають в перше коліно трубки для хлорування 3. Після витіснення з системи повітря хлором речовину в трубці нагрівають газовим пальником і, продовжуючи пропускати хлор, проводять хлорування. Хлорид збирається в другому коліні трубки. Після закінчення хлорування продукт переганяють у слабкому струмені хлору в третє коліно трубки, що дозволяє отримати його в більш чистому вигляді. Для сублімації речовини нагрівають відповідне коліно трубки 4. Необхідно стежити, щоб продукт не накопичувався у вузьких місцях трубки. Потім прилад розбирають, трубку швидко закривають пробками для попередження попадання вологи повітря і продукт запаюють в другому і третьому колінах трубки.
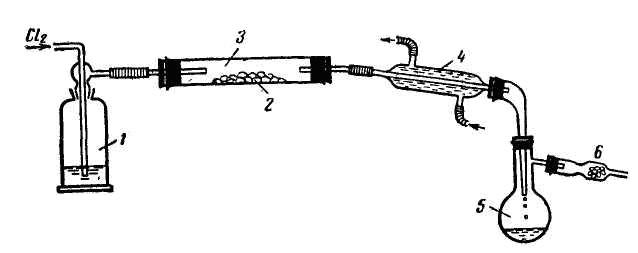
Великі кількості легколетких хлоридів зручно одержувати в приладі, схема якого наведена на рисунку 78. Хлорування проводять у фарфоровій або кварцовій трубці 1, куди поміщають в лодочках 2 речовину 3. Трубку нагрівають електропіччю 4. Одержуваний хлорид струменем хлору виноситься в приймач 5, який виготовляють з реторти. Його корисно охолоджувати холодною водою. Температура контролюється термопарою 6.
|
|
|
Рис. 77. Одержання легколетких хлоридів: 1 – лічильник пухирців з сірчаною кислотою; 2 – хлорована речовина; 3 – трубка для хлорування; 4 – місце запаювання продукту. |
Якщо роботу проводять не під тягою, то сліди хлору, що не прореагував, потрапляють у приміщення. В цьому випадку бажано мати установку, що має на вихідному кінці поглинач. Поглинальну колонку заповнюють битим склом або нарізаними трубками, які змочують розбавленим розчином лугу. Щоб при можливих перервах у подачі хлору вологе повітря не потрапляло в реакційну трубку, в систему включають U-подібну трубку, наповнену хлоридом кальцію.
|
|
|
Рис. 78. Одержання великих кількостей легколетких хлоридів: 1 – фарфорова або кварцова трубка; 2 – лодочки; 3 – хлорована речовина; 4 – електропіч; 5 – приймач хлоридів; 6 – термопара; 7 – охолоджувальна суміш. |
Хлорування металів і неметалів хлороводнем. Хлорування металів і неметалів сухим хлороводнем протікає більш спокійно, ніж з хлором. Оскільки реакції йдуть з виділенням водню
Fe + 2HC1 FeCl2 + Н2
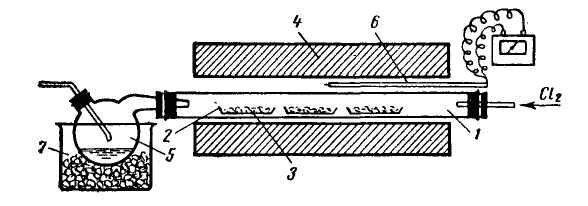
хлориди завжди утворюються в низькому ступені окислення. Тому даний метод зручний для одержання FeCl2, CrCl2, SnCl2, SbCl3 і деяких інших хлоридів. При використанні хлороводню, на відміну від хлору, процес відбувається, як правило, при більш високих температурах. Хлорування проводять у фарфорових або кварцових трубках, куди поміщають лодочку з вихідною речовиною (рис. 79).
|
|
|
Рис. 79. Хлорування оксидів тетрахлоридом вуглецю: 1 – колба з тетрахлоридом вуглецю; 2 – лодочка з хлорованою речовиною; 3 – електропіч; 4 – перегон хлориду. |
Хлорид залишається в лодочці або переганяється і конденсується на холодних стінках трубки. Збирати його в тому і в іншому випадку важко. Для цього після охолодження трубки лодочку швидко виймають металевим гачком, трубку встановлюють вертикально і, підставивши до нижньої її частини приймач (широку пробірку і ін.), швидко проштовхують перегін в приймач металевою лозиною.
Хлорування оксидів. При хлоруванні оксидів встановлюється рівновага, наприклад:
2МеО + 2С12 2MeCl2 + О2.
Оскільки ця реакція гетерогенна, стан рівноваги визначається співвідношенням концентрацій хлору і кисню в газовій фазі:
![]() .
.
Отже, діючи надлишком чистого хлору на оксид, можна видалити зі сфери реакції кисень і змістити процес у бік утворення хлориду. Проте, при такому методі хлорування значна частина хлору витрачатиметься непродуктивно.
Хлориди багатьох елементів при 25°С більш стійкі, ніж оксиди. Дійсно, оксиди лужних і лужноземельних металів під дією хлору дуже легко перетворюються на хлориди. Зворотний же перехід практично майже не відбувається. В стані рівноваги при високих температурах у газовій фазі знаходиться велика кількість кисню і незначна кількість хлору. Оксиди бору, кремнію, берилію, алюмінію, титану та деяких інших елементів хлоруються більш важко. Хлорування цих оксидів проводять за наявності кисневіднімаючого агента, що полегшує зсув рівноваги у бік утворення хлориду. З них найбільш зручно застосовувати вугілля. При хлоруванні оксидів вугілля окислюється головним чином до оксиду вуглецю (II), який з хлором (при його надлишку) утворює фосген. Якщо повільно пропускати хлор через суміш оксиду з надлишком вугілля, то вміст фосгену в газах, що відводяться, зменшиться, а вміст вільного оксиду вуглецю (II) збільшиться. Такі рівноважні реакції з участю вуглецю були вивчені і в деяких випадках, навіть, були визначені їх константи рівноваги. Вугілля зручне для практичного застосування не тільки тому, що при його окисленні утворюються гази, які легко виводяться з сфери реакції, але ще й тому, що в умовах хлорування (на відміну від інших речовин, що віднімають кисень) вуглець практично не хлорується.
Для хлорування застосовують також тетрахлорид вуглецю, фосген і хлориди сірки, тобто речовини; в яких є елемент-відновник, що віднімає під час реакції кисень від оксиду. Мабуть, з вказаних речовин найкращими хлоруючими властивостями володіє тетрахлорид вуглецю. При його взаємодії з міцними оксидами вуглець окислюється до оксиду вуглецю (II), який з надлишком хлору утворює фосген:
SiO2 + 2CCl4 = SiCl4 + 2COCl2; Сr2О3+3ССl4 = 2СrСl3 + 3СОС12.
При хлоруванні менш міцних оксидів вуглець тетрахлориду окислюється, в основному, до оксиду вуглецю (IV), наприклад:
2CuO + CCl4 = 2CuCl2 + CO2.
Домішки оксидів інших елементів, які є у вихідній речовині, також піддаються галогенуванню. При цьому між галогенідами і оксидами встановлюється рівновага, зміщена у бік утворення найбільш стійкого галогеніду або оксиду, наприклад:
2Fe2O3 + 3SiCl4 4FeCl3 + 3SiО2.
Хлоруванню можна піддати також і деякі солі (карбонати, сульфати, нітрати, сульфіди й ін.), але ніяких особливих переваг ці вихідні речовини перед оксидами не мають. В окремих випадках можливі навіть деякі ускладнення; наприклад, при хлоруванні сульфідів утворюються хлориди сірки, що забруднюють продукт.
Для хлорування готують суміш з оксиду і вугілля. Вугілля беруть в деякому надлишку у порівнянні з теоретичним розрахунком, вважаючи, що воно в процесі хлорування окислюватиметься до оксиду вуглецю (II). Суміш оксиду і вугілля розтирають у ступці, заливають густим крохмальним клейстером, перемішують і отриману пасту поміщають тонким шаром (0,5 см) на папір. Після висушування суміші в сушильній шафі її розламують на шматочки і прожарюють в закритому тиглі при 600 – 700°С. Отримані шматочки поміщають у фарфорову або кварцову трубку, що обігрівається електричною піччю, і прожарюють у струмені хлору при 800 – 1100°С залежно від міцності оксиду. Хлор пропускають через трубку із швидкістю одного – двох пухирців за секунду (в промивалці). Хлорування проводять протягом 1 – 1,5 годин. Якщо одержуваний хлорид легко випаровується або при кімнатній температурі – рідина (TiCl4, SnCl4, SiCl4), то хлорування проводять у приладі, зображеному на рисунку 75. Електропіч на рисунку не вказана.
Для хлорування оксидів тетрахлоридом вуглецю використовують прилад зображений на рисунку 79. Оксид поміщають в одній або двох лодочках у фарфорову або кварцову трубку. Тетрахлорид вуглецю наливають у перегонну колбу. Після нагрівання печі до необхідної температури пускають слабкий струмінь хлору (1 – 2 пухирці в лічильнику пухирців). Хлорид, що утворюється, переганяється і, осідає на холодних стінках трубки. Тетрахлорид вуглецю, що не вступив в реакцію і фосген відводяться в тягу. Після закінчення реакції прилад розбирають, лодочку з оксидом, що не прореагував, виймають і перегон хлориду знімають за допомогою скляної палички або залізної лозини в пробірку для запаювання.