- •1. Загальні правила роботи в лабораторії
- •2. Запобіжні засоби і перша допомога при нещасних випадках
- •3. Основний лабораторний хімічний посуд
- •4. Зборка приладів
- •5. Миття і сушка хімічного посуду
- •5. Використання літератури і правила складання звіту
- •1. Нагрівання
- •2. Охолоджування
- •3. Вимірювання і регулювання температури
- •4. Подрібнення і перемішування
- •5. Розчинення і Властивості деяких органічних розчинників
- •6. Сушка і основні осушувачі
- •7. Фільтрування
- •1. Кристалізація
- •2. Возгонка (сублімація)
- •3. Екстракція
- •4. Перегонка
- •5. Хроматографія
- •1. Температура плавлення
- •2. Температура кипіння
- •3. Відносна густина
- •4. Показник заломлення
- •5. Молекулярна маса
- •1. Якісний аналіз
- •2. Фізико-хімічні методи встановлення структури речовини
- •3. Ідентифікація невідомої речовини
- •1. Відновлення воднем і реакції гідрУвання
- •2. Одержання металів, їх сплавів і деяких неметалів
- •Питомі теплові ефекти (q) відновлення оксидів алюмінієм
- •3. Одержання металів і деяких неметалів відновленням водних розчинів солей
- •4. Хлорування металів, неметалів і оксидів
- •5. Бромування металів і неметалів
- •6. Йодування металів, неметалів і оксидів
- •7. Одержання сульфідів, селенідів і телуридів
- •8. Нітрування. Одержання нітридів
- •9. Одержання карбідів
- •10. Термічне розкладання речовин з метою одержання оксидів
- •11. Зневоднення крісталогідратів
- •12. Одержання солей
- •1. НітрУвання
- •2. Нітрозування
- •3. Сульфування
- •4. Галогенування
- •5. Алкілювання
- •6. Ацилювання
- •7. ДіазоТуВаНня і Реакції діазосполук
- •8. АзоспОлуЧення
- •9. Відновлення
- •10. Окислення
- •11. Амінування
- •12. Гидроксилювання
- •13. Конденсація
- •14. Полімеризація і поліконденсація
1. Відновлення воднем і реакції гідрУвання
Одержання металів і деяких неметалів з оксидів. Реакції відновлення воднем найчастіше використовуються для одержання металів і деяких неметалів з їх оксидів.
Відновлення оксидів багатовалентних металів протікає східчасто. Особливо легко відбувається відновлення оксидів елементів з вищим ступенем окислення, наприклад: Fe2O3, CrO3, Со2О3 і т.д. Рівновага реакцій відновлення таких оксидів дуже зміщена у бік утворення низьких оксидів, наприклад:
3Fe2O3+Н2 2Fe3O4 + H2O.
Константи рівноваги подібних реакцій визначаються співвідношенням пари води і водню в газовій фазі:
![]()
і не залежать від співвідношення (кількостей) металу і оксиду в твердій фазі. Константа відновлення вищенаведеної реакції при 600°С дорівнює 109, тобто в стані рівноваги знаходиться велика кількість пари води і сліди водню. Якщо концентрацію водню збільшити, то оксид заліза (II, III) відновлюватиметься до оксиду заліза (II), а потім до металу:
Fe3O4 + H2 3FeO+H2O; FeO + H2 Fe+H2O.
Зі зниженням ступеня окислення, міцність оксидів збільшується, і константа рівноваги відновлення подібних реакцій сильно зменшується.
Можливість одержання металів і неметалів відновленням оксидів воднем визначається міцністю низьких оксидів. Відповідно до теорії А. Байкова про відновлення оксидів вони розглядаються як речовини, що знаходяться в стані термічної дисоціації:
2МеО 2Ме + О2.
Тиск кисню при його рівновазі з оксидами при кімнатній температурі незначний, але з підвищенням температури збільшується. Для таких маломіцних оксидів, як Ag2O, HgO і деяких інших, тиск кисню при термічній дисоціації досягає атмосферного вже при порівняно невеликому нагріванні, і, отже, метал може бути отриманий з оксидів за рахунок їх простої термічної дисоціації. Якщо ж тиск кисню над оксидом незначний навіть при високих температурах, то метал може бути отриманий тільки у тому випадку, коли кисень, який може утворитися за рахунок термічної дисоціації оксиду, безперервно відводиться із зони реакції, наприклад, за рахунок зв’язування воднем, вуглецем або оксидом вуглецю (II).
Воду при високих температурах можна розглядати також, як сполуку, що знаходиться в стані термічної дисоціації:
2Н2О 2Н2 + О2.
Отже, пари води можуть виступати і як окислювач металу. Таким чином, зсув рівноваги реакції
МеО + Н2 Н2О + Ме
визначається міцністю молекул початкового оксиду і міцністю молекул води. Якщо тиск кисню, що утворюється при дисоціації оксиду (СuО, РbО), більший у порівнянні з парціальним тиском кисню, що утворюється з пари води, то рівновага буде зміщена у бік відновлення оксиду. Тому такі оксиди, як оксиди свинцю, міді, легко відновлюються воднем, і майже весь водень йде на їх відновлення. В інших випадках, наприклад при відновленні оксиду заліза (II), константа рівноваги реакції близька до одиниці, і, отже, приблизно тільки половина водню використовується на відновлення. Не дивлячись на те, що рівновага у багатьох випадках зміщена у бік окислення металів, їх оксиди легко відновлюються воднем, оскільки ця реакція гетерогенна і продукти її (пари води) струменем водню виводяться із зони реакцій. Створюються сприятливі умови для зсуву рівноваги у бік відновлення оксидів.
Такі оксиди, як SiO2, MnO, TiO й ін., практично воднем не відновлюються, оскільки для одержання навіть невеликих кількостей металу потрібні величезні кількості абсолютно сухого водню. Наприклад, константа рівноваги реакції відновлення
SiO2+2H2 2H2O+Si
при 1500 С дорівнює 10–65. Тому для одержання, наприклад, 1 г кремнію відновленням його оксиду SiO2 потрібно абсолютно сухого водню 61064 г.
Реакції відновлення оксидів починаються при температурі близько 200 – 400°С, але в більшості випадків вони йдуть з невеликими швидкостями. Одержувані метали, при помірних температурах, часто володіють пірофорністю, тобто спалахують на повітрі. Пояснюється це не тільки великою поверхнею порошкоподібного металу, але також і тим, що пірофорні метали, як правило, мають спотворені кристалічні гратки, які повторюють якоюсь мірою кристалічні гратки вихідного оксиду. Перебудова грат і поверхневе окислення металу призводять до його розігрівання і до самозагорання на повітрі.
Чим вище температура відновлення, тим більш великокристалічним буде порошок одержуваного металу. Якщо температура відновлення близька до температури плавлення, метали утворюються у вигляді щільної губки. В сплавленому вигляді метали утворюються при більш високих температурах, ніж їх температури плавлення. Пояснюється це тим, що на поверхні найдрібніших крапельок металу, що утворюються, є шар адсорбованого водню і оксидів важко відновлюваних металів, які в незначній кількості майже завжди присутні у вигляді домішок у вихідних оксидах.
Таким же способом можна одержувати і сплави. В цьому випадку вихідною речовиною є суміш оксидів. Вибір методу відновлення визначається властивостями вихідного оксиду, а також бажаною формою одержання металу (у вигляді пірофорного порошку, губки або в сплавленому вигляді).
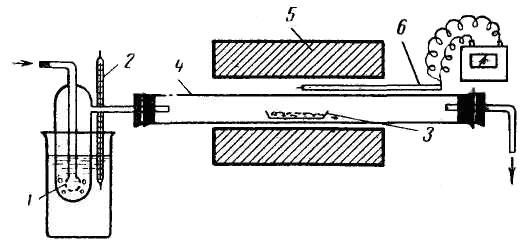
Якщо необхідна температура відновлення вище 600 – 650°С, то реакцію проводять в трубчастих електропечах (рис. 68). Вихідну речовину поміщають у фарфорову або в кварцову лодочку, яку вставляють в реактор 2 (фарфорова або кварцова трубка) і нагрівають у струмені водню до необхідної температури. Кінці трубки закривають гумовими або корковими пробками, в які вставляють з одного кінця трубку, що підводить водень, а з іншого – трубку, що відводить пари води і водень, який не прореагував. Заздалегідь установку перевіряють на герметичність. Для цього кінець газовідвідної трубки занурюють на 4 – 5 см у воду і пропускають водень. Пухирці газу, що виділяються, указують на герметичність приладу. Перед нагріванням трубки повітря з неї потрібно витіснити воднем (проба на чистоту водню). При відновленні оксидів утворюється вода. Тому піч слід розташувати з невеликим нахилом, щоб вода, яка конденсується, не потрапляла на розжарені частини реактора. Для вимірювання температури застосовують термопару 3. Оскільки при відновленні воднем не вимагається дуже точного додержання температурного режиму, термопару або термометр можна помістити зовні трубки, в безпосередній близькості від лодочки.
|
|
|
Рис. 68. Відновлення оксидів воднем: 1 – лодочка з оксидом; 2 – фарфорова або кварцова трубка; 3 – термопара з пірометричним гальванометром. |
При 550 – 600°С і нижче реакцію можна вести не в лодочці, а прямо в скляній трубці або в трубці з перетяжками (рис. 69). У такий реактор за допомогою вузького шпателя або скляної трубки вводять 2 – 3 г оксиду і нагрівають його в струмені водню. Якщо отриманий метал окислюється на повітрі, його слід після закінчення реакції запаяти в тій же трубці. Водень для відновлення одержують або в апараті Кіппа, або в електролізері. Зібраний прилад перед роботою перевіряють на герметичність. Для цього в нього повільно пропускають струмінь водню, а трубку, що відводить водень, занурюють на 3 – 4 см у воду. Якщо водень проходить через шар води, то прилад герметичний. Після перевірки приладу на герметичність через нього пропускають сильний струмінь водню, щоб витіснити повітря. Через деякий час водень, що виходить з трубки, збирають в пробірку (над водою) і випробовують на чистоту, потім трубку нагрівають в струмені водню, пропускаючи його із швидкістю 1 – 2 пухирці в 1 с.
|
|
|
Рис. 69. Трьохколінна скляна трубка для відновлення оксидів воднем. |
Закінчення реакції відновлення оксидів визначити досить важко. Про це можна судити за зміною кольору або зменшенню маси оксиду, але тільки в тому випадку, якщо він має постійний і відомий склад. Практично водень пропускають явно в надлишку протягом 20 – 30 хв, після чого реакцію вважають доведеною до кінця. В тих випадках, коли відновлення проводять у прозорих трубках і при температурі, яка набагато перевищує точку плавлення металу, про закінчення реакції можна судити за утворенням металевих корольків. Іноді, особливо при роботі з великими кількостями оксидів, які легко відновлюються, води накопичується досить багато, і вона поступово стікає з трубки. Коли реакція близька до закінчення, утворення води припиняється, за цією ознакою можна, хоча і не цілком достовірно, судити про кінець реакції. Але при відновленні міцних оксидів (наприклад, оксидів молібдену і вольфраму), коли значення константи рівноваги реакції невелике і пари води в газовій фазі мало, вода в газовідвідній трубці може і не зібратися.
Після закінчення реакції прилад охолоджують в струмені водню, відокремлюють трубку, яка підводить газ, виймають лодочку з продуктом реакції і продукт реакції запаюють у пробірці. У жодному випадку не можна розбирати прилад у гарячому стані, оскільки повітря в реакторі може утворити з воднем вибухову суміш.
Одержання нижчих оксидів. Оксиди елементів з різним ступенем окислення відновлюються східчасто:
МnО2 Мn2О3 Мn3О4 МnО.
Кожна з цих реакцій має свою константу відновлення.
Деяке уявлення про можливість відновлення оксидів з метою одержання низьких оксидів дають дані про тиск кисню, що утворюється при дисоціації оксидів.
На підставі значення констант рівноваги реакцій відновлення оксидів воднем можна вирішити питання як про максимально необхідну кількість водню, так і про мінімальну кількість пари води в газовій фазі. Наприклад, константи відновлення Fe2O3 до Fe3O4, Fe3O4 до FeO і FeO до Fe при 727°С відповідно рівні 104,9, 1011 і 0,51. У першому випадку в стані рівноваги в газовій суміші знаходитиметься 99,99% пари води, оскільки
![]() ,
звідси
,
звідси
![]()
Отже, отримати Fe3O4 відновленням Fe2O3 непросто, оскільки в газовій фазі тільки сліди водню і велика кількість пари води. Якщо ж концентрацію водню збільшити, то оксид заліза (II, III) відновлюватиметься до оксиду заліза (II). Константа реакції відновлення оксиду заліза (ІІ) до металу при вказаній температурі рівна 0,51. Тому для одержання оксиду заліза (II) співвідношення концентрації пари води і водню у відновлюючому газі повинно бути дещо більше 0,51, наприклад 0,6 – 0,7. Практично, для одержання оксидів з проміжним ступенем окислення, якщо вони можуть легко відновлюватися далі, застосовують водень, що містить певну кількість пари води. Роботу проводять в спеціальній установці (рис. 70).
|
|
|
Рис. 70. Відновлення оксидів вологим воднем: 1 – промивалка з водою; 2 – термометр; 3 – лодочка з оксидом; 4 – фарфорова або кварцова трубка; 5 – електропіч; 6 – термопара з пірометричним гальванометром. |
Водень насичується парами води в промивалці, яка обігрівається водяною банею. Температура контролюється термометром 2, і вона на 3 – 4°С повинна бути вищою за температуру, необхідну для створення потрібної концентрації пари води. Трубка, яка сполучає промивалку з реакційною трубкою, повинна бути якомога коротшою, щоб зменшити в ній, конденсацію пари води. Відновлюваний оксид в лодочці 3 поміщається у фарфорову або кварцову трубку, яка обігрівається електропіччю 5, температура якої контролюється термопарою 6.
Роботу проводять так само, як це описано при одержанні металів відновленням їх оксидів воднем.
Одержання металів і нижчих хлоридів відновленням відповідних хлоридів. Деякі безводні хлориди, наприклад СrСl2, FeCl2, TiCl3 й ін., в яких елементи знаходяться в низькому ступені окислення, одержують відновленням хлоридів воднем. Оскільки більшість вихідних хлоридів гігроскопічні, то відновлення слід проводити в тій же установці, в якій одержують хлориди. Після одержання хлориду трубку охолоджують, хлор витісняють воднем і після цього трубку нагрівають до відповідної температури, продовжуючи пропускати над хлоридом водень. Заздалегідь водень випробовують на чистоту, щоб переконатися в повноті витіснення хлору. Відновлення проводять при температурі, вказаній в інструкціях, про закінчення відновлення хлориду до металу судять по закінченню утворення хлороводню. Для цього кінець газовідвідної трубки опускають в пробірку з розчином нітрату срібла. Якщо ж одержують хлорид з меншим ступенем окислення, який може відновлюватися до металу, то про закінчення реакції судять за зміною кольору вихідного і кінцевого хлориду.
Реакції проводять в установках, наведених на рисунках 68 і 69, які використовуються для відновлення оксидів воднем.
Реакції гідрування. Реакцію гідрування, тобто приєднання водню до металів і неметалів, проводять в тих же приладах, що і реакції відновлення воднем (рис. 68, 69).
Одержують гідриди лужних і лужноземельних металів в межах 400 – 700°С. Найпростішою установкою є трубка (скляна, фарфорова або кварцова), через яку при відповідній температурі пропускають чистий водень (рис. 68, 69). Натрій, калій, рубідій, цезій можна розміщувати або безпосередньо в трубці, оскільки зі склом вони майже не взаємодіють (невелика взаємодія спостерігається з натрієм), або у фарфорову лодочку. При розміщенні металів безпосередньо в трубці необхідно брати невеликі кількості, щоб метали не розтікалися. Метод, крім того, зручний ще й тим, що гідрид можна в цій же трубці запаяти. Перенесення ж цих гідридів з лодочки в трубку для запаювання пов'язано з великими труднощами внаслідок їх великої хімічної активності. Одержані гідриди мають дещо знижений вміст водню в порівнянні з теоретичним. Щоб вміст водню відповідав теоретичному, реакції слід проводити при температурі сублімації лужного металу. Продукт сублімації, який одержаний в слабому струмені водню є відносно чистим гідридом, але він володіє високою реакційною здатністю. Для перенесення гідридів у пробірку для запаювання потрібні спеціальні пристосування. Тому завжди після охолоджування трубки в струмені водню через неї пропускають ретельно осушений азот і нещільно закривають з двох кінців пробками. Потім відпаюють кінці трубки в безпосередній близькості від речовини, що переганяється.
Гідриди літію і лужноземельних металів потрібно добувати в залізних або нікелевих лодочках, оскільки вони відновлюють силікати, руйнуючи трубки. При добуванні цих гідридів у фарфорових або кварцових лодочках вони можуть бути забруднені кремнієм унаслідок утворення відповідних силіцидів. Добуті гідриди більш стійкі на повітрі, і їх можна перенести в трубку для запаювання, якщо цю операцію провести швидко. Пари металів, які утворюються в невеликих кількостях при гідруванні, також руйнують матеріал трубки. Тому гідрувати літій і лужноземельні метали краще в установці, зображеній на рисунку 68. Трубку від руйнуючої, дії пари металів захищають листовим залізом, згорнутим у вигляді трубки, в яку поміщають лодочку. Після закінчення гідрування продукт охолоджують в струмені водню і холодну лодочку виймають. Гідрид виймають з лодочки скальпелем або вузькою стамескою, швидко переносять у пробірку і запаюють. Заздалегідь пробірку заповнюють сухим оксидом вуглецю (IV).
Метали, як правило, містять різні включення, особливо на поверхні (оксиди, гідроксиди, нітриди, карбонати), тому їх заздалегідь з поверхні очищають. Для цього шматок металу поміщають у фарфорову чашку, заливають тонким шаром осушеного ефіру і зіскоблюють з нього скальпелем поверхневу кірку. Пінцетом метал переносять в іншу чашку з невеликою кількістю – ефіру і відмивають від шматочків сторонніх речовин. Потім метал переносять в трубку для гідрування і починають пропускати водень. При цьому ефір, який оберігав метал від окислення, випаровується. Тільки після повного витіснення повітря воднем можна нагрівати трубку.
Водень для досліду не повинен містити кисню і пари води. Тому його, незалежно від методу одержання, слід піддати ретельному очищенню, кінцевою стадією якого є пропускання через нагріті магнієві або кальцієві стружки або через розплавлений натрій. У протилежному випадку отримані гідриди міститимуть домішки оксидів.