- •1. Загальні правила роботи в лабораторії
- •2. Запобіжні засоби і перша допомога при нещасних випадках
- •3. Основний лабораторний хімічний посуд
- •4. Зборка приладів
- •5. Миття і сушка хімічного посуду
- •5. Використання літератури і правила складання звіту
- •1. Нагрівання
- •2. Охолоджування
- •3. Вимірювання і регулювання температури
- •4. Подрібнення і перемішування
- •5. Розчинення і Властивості деяких органічних розчинників
- •6. Сушка і основні осушувачі
- •7. Фільтрування
- •1. Кристалізація
- •2. Возгонка (сублімація)
- •3. Екстракція
- •4. Перегонка
- •5. Хроматографія
- •1. Температура плавлення
- •2. Температура кипіння
- •3. Відносна густина
- •4. Показник заломлення
- •5. Молекулярна маса
- •1. Якісний аналіз
- •2. Фізико-хімічні методи встановлення структури речовини
- •3. Ідентифікація невідомої речовини
- •1. Відновлення воднем і реакції гідрУвання
- •2. Одержання металів, їх сплавів і деяких неметалів
- •Питомі теплові ефекти (q) відновлення оксидів алюмінієм
- •3. Одержання металів і деяких неметалів відновленням водних розчинів солей
- •4. Хлорування металів, неметалів і оксидів
- •5. Бромування металів і неметалів
- •6. Йодування металів, неметалів і оксидів
- •7. Одержання сульфідів, селенідів і телуридів
- •8. Нітрування. Одержання нітридів
- •9. Одержання карбідів
- •10. Термічне розкладання речовин з метою одержання оксидів
- •11. Зневоднення крісталогідратів
- •12. Одержання солей
- •1. НітрУвання
- •2. Нітрозування
- •3. Сульфування
- •4. Галогенування
- •5. Алкілювання
- •6. Ацилювання
- •7. ДіазоТуВаНня і Реакції діазосполук
- •8. АзоспОлуЧення
- •9. Відновлення
- •10. Окислення
- •11. Амінування
- •12. Гидроксилювання
- •13. Конденсація
- •14. Полімеризація і поліконденсація
4. Показник заломлення
Показник заломлення широко використовується для ідентифікації рідких речовин і перевірки їх чистоти, при аналізі подвійних рідких розчинів, для яких відома залежність показника заломлення від складу розчину, при визначенні концентрації цукру у водних розчинах і в багатьох інших випадках.
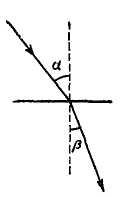
Показник заломлення п – величина постійна для даної речовини, рівна відношенню синусів кута падіння світла на поверхню розділу двох середовищ і кута заломлення світла (рис. 66):
![]()
Як правило, первинним середовищем є повітря, тобто падіння світла на заломлююче середовище йде через повітря.
Показник заломлення залежить від температури і дуже змінюється залежно від довжини хвилі світла. Так, у органічних рідин із зростанням температури на 1 °С він падає на 4·10–4. Тому вимірювання показника заломлення проводять в монохроматичному світлі при постійній температурі, при цьому індексом указують прийняте буквене позначення спектральної лінії, в світлі якої проводилося вимірювання, або довжину хвилі, а показником – температуру, наприклад (за звичай показник заломлення n дається для спектральної D-лінії жовтого натрієвого полум'я).
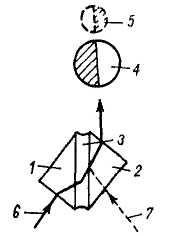
Простим і поширеним приладом для вимірювання показника заломлення є рефрактометр Аббе. Вимірювальна призма забезпечена освітлювальною призмою, зазор між якими заповнений 1 – 2 краплями досліджуваної рідини (рис. 67). Рефрактометр Аббе забезпечений компенсатором, що дозволяє проводити вимірювання при освітленні денним або електричним світлом. Точність вимірювання рефрактометром Аббе складає 1·10–3. Щоб добитися такої точності, під час вимірювання слід підтримувати постійну температуру, що досягається за допомогою термостата.
|
|
|
|
Рис. 66. Заломлення променя світла на межі двох прозорих середовищ. |
Рис. 67. Хід проміння в призмах рефрактометра Аббе: 1– освітлювальна призма; 2 – вимірювальна призма; 3 – досліджувана рідина; 4 – поле в зоровій трубі при вимірюванні в світлі, що проходить; 5 – те ж у відображеному світлі; 6 – хід проміння при вимірюванні в світлі, що проходить; 7 – хід проміння при вимірюванні у відображеному світлі. |
5. Молекулярна маса
Молекулярна маса – одна з найістотніших характеристик речовини. Вона лежить в основі визначення таких величин, як мольні концентрації, об'єм, теплоємність, електропровідність, теплота реакції і т.д. Молекулярна маса використовується для встановлення будови речовини, застосовується у всіх розрахунках за хімічними формулами і рівняннями.
Існує багато різних методів, які дають можливість визначати молекулярну масу речовин хімічних сполук будь-якого класу. Найбільше розповсюдження отримали кріоскопічний, ебуліоскопічний методи і метод Раста.
Для визначення молекулярної маси кріоскопічним методом беруть відважену кількість чистого розчинника і виміряють його температуру замерзання. Потім знов в тій же судині розплавляють розчинник, вносять у нього наважку досліджуваної речовини і виміряють температуру початку кристалізації. За ебуліоскопічним методом підвищення температури кипіння розчинника, обумовлене введенням певної кількості досліджуваної речовини, вимірюють термометром Бекмана, а потім за формулами розраховують молекулярну масу (докладний опис кріоскопії та ебуліоскопії наведено в керівництві по фізико-хімічному практикуму).
Ми більш детально зупинимося на методі Раста, який дозволяє визначати молекулярну масу хімічних сполук у приладі для визначення температури плавлення. Цей метод застосовний для речовин, розчинних у розплавленій камфорі і стійких до 190 °С. Метод полягає у визначенні пониження температури плавлення камфори при розчиненні в ній певної кількості досліджуваної речовини. Для визначення молекулярної маси потрібно всього 10 – 60 мг речовини; точність визначення 5 – 10%.
Розглянемо як приклад визначення молекулярної маси, нафталіну по зниженню температури плавлення камфори. В невелику чисту суху пробірку поміщають 60 – 70 мг нафталіну і близько 0,7 – 0,8 г камфори. Обережно, на маленькому полум'ї, нагрівають пробірку для сплаву цих речовин. Потім видаляють з полум'я пробірку, перемішують отриманий розплав капіляром, сплюснутим на кінці. Після того, як розплав твердне, витягують велику його частину тим же капіляром на годинне скло. Масу розтирають і набивають нею капіляр діаметром ~2 мм. В інший такий же капіляр набирають пробу чистої камфори. Обидва капіляри кріплять за допомогою маленького гумового кільця до термометра з поділками 0,1 або 0,2 °С. Потім починають поволі нагрівати прилад, уважно спостерігаючи за станом проб через лупу, і у момент плавлення останніх кристалів суміші камфори з нафталіном записують температуру, приймаючи її за температуру плавлення суміші. Продовжуючи нагрівання, визначають температуру плавлення чистої камфори в іншому капілярі. Молекулярну масу досліджуваної речовини (в даному випадку нафталіну) розраховують за формулою:
![]()
де m1 – наважка досліджуваної речовини; m2 – наважка камфори; t1 –температура плавлення чистої камфори; t2 – температура плавлення суміші; 40 – кріоскопічна константа.
Для контролю рекомендується повторити визначення з іншою парою капілярів.
ЛЕКЦІЯ 5. МЕТОДИ ІДЕНТИФІКАЦІЇ РЕЧОВИН
При одержанні речовин заданої будови за давно відомими і багато разів перевіреними методиками при дотриманні всіх умов синтезу ідентифікація отриманих продуктів полягає тільки у визначенні деяких констант після відповідного очищення. Такими константами є для рідких речовин температура кипіння при нормальному або іншому, але цілком певному тиску, абсолютна або відносна густина при стандартній температурі, показник заломлення при вказаній довжині хвилі падаючого світла і т.д. Для твердих (за з.у.) речовин такою константою є температура плавлення, порівняно мало залежна від тиску. Проте для підтвердження чистоти речовини можна використовувати у багатьох випадках і температуру кипіння при певному тиску. Чистоту отриманої речовини часто підтверджують тонкошаровою хроматографією, якщо були розроблені умови її проведення. Таким чином, ідентифікація отриманої за перевіреною методикою речовини зводиться, по суті справи, до оцінки її чистоти.
Відомі типи реакцій часто використовуються для одержання нових речовин заданої будови, а іноді розробляється новий, більш раціональний шлях отримання відомої речовини. Оскільки напрям реакції не є однозначним, продукти, що виділяються, після їх розділення тим або іншим шляхом і ретельного очищення кожного з них ідентифікуються, тобто проводиться доказ відповідності будові речовин приписуваних їй структурних формул. З цією метою проводиться аналіз речовини.