
- •1. Загальні правила роботи в лабораторії
- •2. Запобіжні засоби і перша допомога при нещасних випадках
- •3. Основний лабораторний хімічний посуд
- •4. Зборка приладів
- •5. Миття і сушка хімічного посуду
- •5. Використання літератури і правила складання звіту
- •1. Нагрівання
- •2. Охолоджування
- •3. Вимірювання і регулювання температури
- •4. Подрібнення і перемішування
- •5. Розчинення і Властивості деяких органічних розчинників
- •6. Сушка і основні осушувачі
- •7. Фільтрування
- •1. Кристалізація
- •2. Возгонка (сублімація)
- •3. Екстракція
- •4. Перегонка
- •5. Хроматографія
- •1. Температура плавлення
- •2. Температура кипіння
- •3. Відносна густина
- •4. Показник заломлення
- •5. Молекулярна маса
- •1. Якісний аналіз
- •2. Фізико-хімічні методи встановлення структури речовини
- •3. Ідентифікація невідомої речовини
- •1. Відновлення воднем і реакції гідрУвання
- •2. Одержання металів, їх сплавів і деяких неметалів
- •Питомі теплові ефекти (q) відновлення оксидів алюмінієм
- •3. Одержання металів і деяких неметалів відновленням водних розчинів солей
- •4. Хлорування металів, неметалів і оксидів
- •5. Бромування металів і неметалів
- •6. Йодування металів, неметалів і оксидів
- •7. Одержання сульфідів, селенідів і телуридів
- •8. Нітрування. Одержання нітридів
- •9. Одержання карбідів
- •10. Термічне розкладання речовин з метою одержання оксидів
- •11. Зневоднення крісталогідратів
- •12. Одержання солей
- •1. НітрУвання
- •2. Нітрозування
- •3. Сульфування
- •4. Галогенування
- •5. Алкілювання
- •6. Ацилювання
- •7. ДіазоТуВаНня і Реакції діазосполук
- •8. АзоспОлуЧення
- •9. Відновлення
- •10. Окислення
- •11. Амінування
- •12. Гидроксилювання
- •13. Конденсація
- •14. Полімеризація і поліконденсація
10. Окислення
Процеси, що супроводжуються відщепленням від субстрату електронів, називають окисленням. В цих реакціях окислювачами є сполуки, які володіють великою спорідненістю до електрона (електрофільністю), а субстратами – сполуки, які мають схильність до віддачі електронів (нуклеофільністю).
При окисленні органічних сполук повної передачі електронів і відповідно зміни валентності атомів вуглецю не відбувається. Ця уявна суперечність пояснюється тим, що змінюється ступінь окислення цього елемента завдяки зсуву електронної густини від атома вуглецю до окислювача, що і враховується при складанні електронного балансу:
Механізм реакції. Процеси окислення пов'язані або з приєднанням кисню, або з дегідруванням – відщепленням водню (точніше, двох електронів і двох протонів). Механізм найпоширенішої реакції окислення органічних сполук киснем, встановлений у 1933 р. М.М. Семеновим, називається радикально-ланцюговим. У присутності каталізаторів – металів змінної валентності (солей кобальту, марганцю, п’ятиоксиду ванадію) – відбуваються такі перетворення:
R + O–O → ROO
ROO + RH → ROOH + R
ROOH + Ме2+ → RO + ОН– + Ме3+
R + О2 → ROO
ROO + RH → ROOH + R і т.д.
Окислення органічних речовин сполуками металів, що знаходяться у вищому ступені окислення, ймовірно, протікає через утворення комплексів з донорно-акцепторним зв'язком.
Окислювачі. Найпоширенішими окислювачами є речовини з сильно вираженими електрофільними властивостями: азотна кислота, кисень і пероксидні сполуки (пероксид водню, пероксиди металів, неорганічні і органічні надкислоти), сірка, діоксид селену, хлор, бром, кисневмісні кислоти галогенів і їх солі (гіпохлорити і гіпобромити, хлорна кислота, йодна кислота і т.д.). До ефективних окислювачів відносяться сполуки металів у вищих ступенях окислення: сполуки заліза (III), перманганат калію, діоксид марганцю, хромова кислота і її ангідрид, діоксид і тетраацетат свинцю.
Умови проведення реакцій. Схильність до окислення органічних сполук в значній мірі залежить від будови субстрату. Наявні експериментальні дані дозволили зробити висновки про відносну легкість протікання реакції для різних класів сполук:
R–H < R–OH < R–NH2
–С–С– < –СС– < –С=С–
Специфічність окислення різних органічних сполук настільки залежить від будови, що інші фактори (температура, перемішування, розчинник і т.д.) не є визначаючими. Тому для даного методу органічного синтезу практично неможливо підібрати загальні умови отримання одних і тих же продуктів з різних субстратів.
При окисленні насичених вуглеводнів кінцевими продуктами реакції є карбонові кислоти, хоча за певних умов можна отримати і деякі проміжні сполуки – спирти, альдегіди або кетони.
Алкільні групи насичених вуглеводнів нормальної будови окислюються лише в дуже жорстких умовах (при нагріванні з хромовою сумішшю). Значно легше йде окислення, якщо вони знаходяться при подвійному зв'язку або у ароматичного ядра. Процес характеризується селективністю і залежно від природи окислювача утворюються різні кисневмісні продукти.
У лабораторній практиці окислення алкілпохідних ароматичного ряду до кислот здійснюється хромовою кислотою (дихромат натрію в сірчаній або оцтовій кислоті), перманганатом калію в лужному середовищі, азотною кислотою. В останньому випадку необхідно пам'ятати про можливість утворення нітросполук. Наприклад:
![]() Особливе
місце займають методи каталітичного
окислення алкілпохідних ароматичного
ряду киснем повітря за присутності
солей кобальту або марганцю. Як правило,
ці процеси здійснюють під тиском з
використанням розчинників (найчастіше
оцтової кислоти):
Особливе
місце займають методи каталітичного
окислення алкілпохідних ароматичного
ряду киснем повітря за присутності
солей кобальту або марганцю. Як правило,
ці процеси здійснюють під тиском з
використанням розчинників (найчастіше
оцтової кислоти):
![]()
Окислення алкілароматичних сполук до альдегідів зв'язано з певними труднощами, оскільки альдегід, що утворюється, окислюється легше, ніж метильна група. Проте при окисленні в середовищі оцтового ангідриду вдається виділити альдегід у вигляді діацетату. Альдегід можна також отримати при використанні як окислювача діоксиду марганцю:
Аr–CН3 + 2MnO2 + 2H2SO4 = Аr–СНО + 2MnSO4 + 3H2O
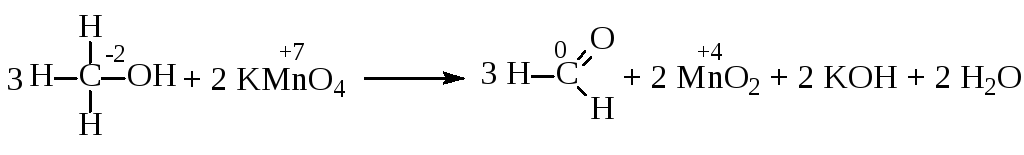
Окислення первинних спиртів до альдегідів і вторинних до кетонів проводять дихроматом, хоча вихід альдегідів не перевищує 60%. Окислення вторинних спиртів здійснюється легше, ніж первинних, унаслідок більшої стабільності кетонів, що утворюються. Вторинні спирти легко окислюються хромовим ангідридом в ацетоні і навіть диметилсульфоксидом в оцтовому ангідриді.
Для окислення первинних спиртів і альдегідів до відповідних кислот придатні всі окислювачі, які здатні перетворювати спирти на альдегіди. При окисленні альдегіду хромовою кислотою відбуваються такі перетворення:
 Первинні
спирти краще окислювати перманганатом
калію в лужному середовищі, оскільки в
кислому середовищі проміжний альдегід,
що утворюється, легко перетворюється
на ацеталь, що позначається на виході.
Якщо сполука містить спиртову і альдегідну
групи (альдози), то альдегідну групу
можна вибірково окислити аміачним
розчином оксиду срібла. Для одночасного
окислення альдегідної і кетонної груп
застосовують розбавлену азотну кислоту.
Первинні
спирти краще окислювати перманганатом
калію в лужному середовищі, оскільки в
кислому середовищі проміжний альдегід,
що утворюється, легко перетворюється
на ацеталь, що позначається на виході.
Якщо сполука містить спиртову і альдегідну
групи (альдози), то альдегідну групу
можна вибірково окислити аміачним
розчином оксиду срібла. Для одночасного
окислення альдегідної і кетонної груп
застосовують розбавлену азотну кислоту.
Окислення ароматичних вуглеводнів до хінонів (за винятком бензолу) легко здійснюється хромовою кислотою, пероксидом водню. Бензохінон у лабораторній практиці одержують окисленням гідрохінону дихроматом калію в кислому середовищі або азотною кислотою.
Хінони (бензохінон, антрахінон, фенантрахінон) самі володіють властивостями окислювачів, перетворюючись на відповідні гідрохінони.
Виділення продуктів реакції визначається їх агрегатним станом: рідкі речовини екстрагуються з реакційної маси відповідним розчинником, тверді виділяють фільтруванням.
Кислоти, які добувають окисленням в лужному середовищі, виділяють підкисленням реакційного розчину.
Запобіжні засоби. Проведення синтезів з кислотами (хромовою, азотною) вимагає використання захисних окулярів, рукавичок. У разі застосування кисню слід дотримувати правила роботи із стислими газами (робота у витяжній шафі, відсутність речовин, здатних до окислення і спалаху).
Ідентифікація. Ідентифікацію продуктів окислення унаслідок їх різноманітності проводять за смугами поглинання відповідних функціональних груп в ІЧ-спектрах і хімічними зсувами протонів, що входять до складу цих або сусідніх з ними груп.
