
- •1. Загальні правила роботи в лабораторії
- •2. Запобіжні засоби і перша допомога при нещасних випадках
- •3. Основний лабораторний хімічний посуд
- •4. Зборка приладів
- •5. Миття і сушка хімічного посуду
- •5. Використання літератури і правила складання звіту
- •1. Нагрівання
- •2. Охолоджування
- •3. Вимірювання і регулювання температури
- •4. Подрібнення і перемішування
- •5. Розчинення і Властивості деяких органічних розчинників
- •6. Сушка і основні осушувачі
- •7. Фільтрування
- •1. Кристалізація
- •2. Возгонка (сублімація)
- •3. Екстракція
- •4. Перегонка
- •5. Хроматографія
- •1. Температура плавлення
- •2. Температура кипіння
- •3. Відносна густина
- •4. Показник заломлення
- •5. Молекулярна маса
- •1. Якісний аналіз
- •2. Фізико-хімічні методи встановлення структури речовини
- •3. Ідентифікація невідомої речовини
- •1. Відновлення воднем і реакції гідрУвання
- •2. Одержання металів, їх сплавів і деяких неметалів
- •Питомі теплові ефекти (q) відновлення оксидів алюмінієм
- •3. Одержання металів і деяких неметалів відновленням водних розчинів солей
- •4. Хлорування металів, неметалів і оксидів
- •5. Бромування металів і неметалів
- •6. Йодування металів, неметалів і оксидів
- •7. Одержання сульфідів, селенідів і телуридів
- •8. Нітрування. Одержання нітридів
- •9. Одержання карбідів
- •10. Термічне розкладання речовин з метою одержання оксидів
- •11. Зневоднення крісталогідратів
- •12. Одержання солей
- •1. НітрУвання
- •2. Нітрозування
- •3. Сульфування
- •4. Галогенування
- •5. Алкілювання
- •6. Ацилювання
- •7. ДіазоТуВаНня і Реакції діазосполук
- •8. АзоспОлуЧення
- •9. Відновлення
- •10. Окислення
- •11. Амінування
- •12. Гидроксилювання
- •13. Конденсація
- •14. Полімеризація і поліконденсація
8. АзоспОлуЧення
Взаємодія діазосполук з ароматичними амінами і фенолами, що супроводжується утворенням речовин, які містять азогрупу –N=N–, зв'язану з двома ароматичними радикалами, називають азосполученням.
Діазосполуки отримали назву діазоскладової реакції азосполучення, а аміни або феноли – азоскладової.
Механізм реакції. Встановлено, що реакція азосполучення відбувається за механізмом електрофільного заміщення, в якому атакуючим агентом виступає іон діазонію (Аr–N=N), а субстратом – ароматичні системи, які містять в n- або о-положенні замісники NH2, NHAlk, NHAr, N(Alk)2, NHSO3H, NHNO2, ОН і в деяких випадках OAlk.
Унаслідок невеликої активності іонів діазонію реакція протікає направлено – з утворенням n- або о-ізомерів. Електроноакцепторні замісники в діазонієвому іоні підвищують його реакційну здатність, а електронодонорні групи знижують її.
Азосполуки містять разом з хромофорною азогрупою ауксохромні групи азоскладової, унаслідок чого вони є барвниками.
Умови проведення реакція. Для здійснення реакції азосполучення готують два компоненти: діазосполуку і азоскладовий реагент. Розчин діазосполуки одержують з дотриманням всіх правил. Надзвичайно важливим фактором є рН середовища. Залежно від природи азоскладового компоненту створюють слабокисле середовище для амінопохідних і слаболужне для сполук, які містять гідроксо-, карбокси- і сульфогрупи. Цей прийом необхідний, щоб перевести азокомпонент у розчин і, таким чином, провести з’єднання в гомогенних умовах.
Як правило, для отримання азосполук охолоджений розчин солі діазонію поступово, при енергійному перемішуванні, додають до охолодженого розчину азокомпоненту. Якщо діазосполуки нестабільні, порядок зливання реагентів зворотний.
Азосполучення часто проводять без охолоджування компонентів, особливо в тих випадках, коли діазосполуки є стабільними і мало реакційноздатними, як, наприклад, діазосполуки нафталіну.
Для підвищення швидкості реакції на практиці вдаються також до збільшення концентрації реагентів.
Реакцію здійснюють з таким розрахунком, щоб у реакційній суміші завжди був надлишок азоскладової. За ходом цього процесу стежать по пробі «на витік». Її проводять таким чином: на фільтрувальний папір наносять краплю реакційної маси, до якої додають розчин натрієвої солі 2-нафтол-3,6-дисульфокислоти (R-сіль). Відсутність забарвлення (утворення барвника) вказує на те, що умови сполучення витримані.
Виділення азобарвників. Якщо барвник мілкодисперсний, то вдаються до висолювання: в реакційну суміш додають хлорид натрію з розрахунку 200 г на 1 л розчину.
Цей спосіб використовується також і у тому випадку, коли барвник добре розчинний. За наявності в азосполуках солеподібних груп, які надають продукту добру розчинність у воді, для виділення барвника в реакційну суміш додають кислоту.
Запобіжні засоби в роботі такі ж, як і в інших синтезах з використанням кислот.
Ідентифікація. Ідентифікацію барвників здійснюють за їх індивідуальними спектрами поглинання у видимій області.
9. Відновлення
Реакції, приєднання електронів атомами або іонами, які супроводжуються зниженням ступеня окислення елементів, називають відновленням.
В органічній хімії, проте, за традицією ці широко поширені процеси зв'язують з приєднанням водню до молекули органічної сполуки. Якщо приєднання водню призводить до часткового або повного насичення кратних зв'язків, то такі реакції називають гідруванням, а видалення кисню з органічних молекул (елімінування) – власне відновленням. Тип реакцій, в яких має місце розщеплення простих зв'язків воднем, називають гідрогенолізом.
Відновники. Відновлення здійснюють різними за характером речовинами: воднем у присутності каталізаторів (гідрогенізація і дегідрогенізація); дією металів у присутності сполук, які містять рухомий атом водню; електролітично; сполуками, здатними змінювати ступінь окислення одного з своїх атомів; дією донорів гідрид-іонів.
Найпоширенішим відновником є водень у момент виділення (атомарний водень), а також молекулярний водень у присутності каталізаторів (нікель Ренея, платинова чернь, паладій на вугіллі й ін.). Для відновлення карбонільних сполук використовують гідриди металів (LiAlH4, NaBН4 й ін.). Процес протікає м'яко з високими виходами продуктів відновлення. Окрім гідридів металів для цієї мети застосовують також амальгами (Al/Hg, Zn/Hg, Na/Hg).
Групу відновників, які містять сірку в ступені окислення –2 (H2S, Na2S, K2S, (NH4)2S, NaHS, NH4HS), використовують головним чином для відновлення в динітросполуках однієї з нітрогруп. У лабораторній практиці найчастіше як відновники застосовують метали (Zn, Sn, Fe) в кислому, лужному і нейтральному середовищах. Енергійнішою відновлюючою дією, в порівнянні з індивідуальними металами, володіють їх пари: Zn–Сu, Fe–Сu, Na–К.
Механізм реакції. Відновлення гідроксо-, оксо- і карбоксогруп. Механізм відновлення воднем у момент виділення залежить від природи металу і характеру середовища, тобто від значення відновного потенціалу металу в даному середовищі. У присутності донора водню ан, протікають такі елементарні акти процесу відновлення:
|
R–X + M → R + МХ R+ M → R– + M+ R– + АН → R–Н + А– |
або |
С=О + М → >С–ОМ C–OM + M → >C––OM + M+ С–ОМ + AH– → >СН–ОМ + А– |
На відміну від цих радикальних реакцій відновлення комплексними гідридами (LiAlH4, NaBH4 і ін.) є іонним процесом, в який послідовно вступають всі гідридні атоми водню:
![]()
Цей комплексний алкоголят після гідролітичного розщеплення призводить до утворення відповідного карбінолу:
![]()
За аналогічним механізмом протікає реакція відновлення карбонових кислот.
В основі відновлення карбонільних сполук алкоголятами Al або Mg (реакція Меєрвейна-Пондорфа), окисно-відновного диспропорціонування альдегідів (реакція Канніццаро) також лежить перехід гідрид-іона від відновника до сполуки, яка відновлюється.
Спирти аліфатичного і жирно-ароматичного рядів відновлюються до відповідних вуглеводнів. Як відновники використовують амальгаму натрію, цинк у кислому середовищі. Ефективним реагентом, особливо для відновлення вторинних і третинних карбінолів, є йодоводнева кислота в суміші з хлоридом олова (II), наприклад:
Аr3СОН + 2HI → Аr3СН + I2 + Н2О; I2 + SnCl2 + 2HCI → 2HI + SnCl4
Альдегіди і кетони відновлюються відповідно до первинних і вторинних спиртів. При енергійнішому відновленні можливо утворення вуглеводнів:
АrСНО → АrСНОН + АrСН3
Відновлення нітрогрупи. Відкрита у 1842 р. М.М. Зініним реакція відновлення нітробензолу сульфідом амонію до аніліну
4C6H5NO2 + 6(NH4)2S + 7Н2О → 4C6H5NH2 + 3(NH4)2S2О3 + 6NH4OH
дозволила згодом отримати цілий клас ароматичних амінів, а на їх основі нові класи барвників, фармацевтичних препаратів і інших цінних продуктів.
Відновлення нітросполук при дії сполук елементів, що знаходяться в стані нижчого ступеня окислення (SnCl2, FeSO4, Na2S й ін.), також зв'язано з переходом електронів до органічної молекули. Залежно від рН середовища, в якому відбувається відновлення, утворюються різні проміжні продукти, проте кінцевим завжди є амін. Так, доведено, що в кислому середовищі нітросполука відновлюється до нітрозосполуки, проте унаслідок її високої реакційної здатності останню вловити під час відновлення не вдається.
У нейтральному розчині взаємодія нітросполуки, наприклад, з цинковим пилом і хлоридом амонію у воді призводить спочатку до утворення похідного гідроксиламіну. Перетворення останнього в продукти подальшого відновлення відбувається настільки повільно, що його можна виділити у вільному вигляді з реакційного середовища.
Відновлення ароматичних нітросполук в лужному середовищі протікає з утворенням проміжного нітрозопохідного і арилгідроксиламіну, які в реакційній суміші взаємодіють один з одним. Механізм цієї складної реакції може бути представлений такою схемою:
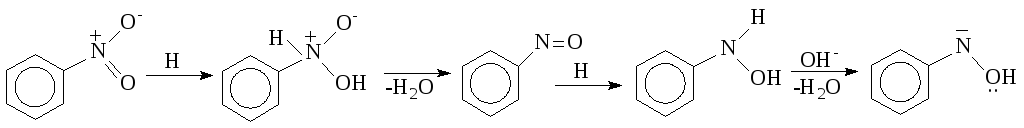
 Різноманітність
методів відновлення нітросполук дозволяє
одержувати не тільки кінцеві продукти
– аміни, але і важливі для синтезів
проміжні сполуки.
Різноманітність
методів відновлення нітросполук дозволяє
одержувати не тільки кінцеві продукти
– аміни, але і важливі для синтезів
проміжні сполуки.
Найбільш легко і гладко протікає реакція каталітичного відновлення воднем у присутності платини або нікелю Ренея під тиском.
Застосовують також і інші каталізатори, такі, як паладій на вугіллі, родій на оксиді алюмінію і сульфід платини на вугіллі. Останній менш чутливий до отруєння і не викликає гідрогенолізу галогену в ядрі.
Цинк володіє могутньою відновлюючою дією, але вона використовується не повністю, оскільки цей метал швидко реагує з кислотою. У зв'язку з цим потрібно завжди брати надлишок цинку.
Один з найстаріших методів – відновлення по Бешану – включає використання залізних стружок або порошку і каталітичної кількості кислоти. Знежирене залізо обробляють концентрованою соляною кислотою і висушують. Протравлений таким чином порошок є активним реагентом.
У нейтральному або слабокислому розчині, наприклад при взаємодії нітросполук з цинковим пилом у водному розчині хлориду амонію, утворюється похідне гідроксиламіну.
У лужному середовищі, відіграють певну роль реакції, які призводять до утворення гідразосполук. Останні широко використовуються для так званого бензидинового перегрупування при добуванні різних діамінів дифенільного ряду.
Запобіжні засоби. Унаслідок великої різноманітності методів відновлення, що використовуються, у кожному конкретному випадку передбачаються відповідні заходи безпечної роботи.
Ідентифікація. Ідентифікацію продуктів відновлення, які можуть відноситися до різних класів органічних сполук, проводять за смугами поглинання в ІЧ-спектрах і хімічними зсувами протонів в спектрах ЯМР відповідних функціональних груп. Наприклад, ідентифікацію амінів проводять за смугами поглинання симетричних і антисиметричних коливань аміногруп в ІЧ-спектрах, а також за хімічними зсувами протонів, зв'язаних з азотом, в спектрах ЯМР.
