
- •1. Загальні правила роботи в лабораторії
- •2. Запобіжні засоби і перша допомога при нещасних випадках
- •3. Основний лабораторний хімічний посуд
- •4. Зборка приладів
- •5. Миття і сушка хімічного посуду
- •5. Використання літератури і правила складання звіту
- •1. Нагрівання
- •2. Охолоджування
- •3. Вимірювання і регулювання температури
- •4. Подрібнення і перемішування
- •5. Розчинення і Властивості деяких органічних розчинників
- •6. Сушка і основні осушувачі
- •7. Фільтрування
- •1. Кристалізація
- •2. Возгонка (сублімація)
- •3. Екстракція
- •4. Перегонка
- •5. Хроматографія
- •1. Температура плавлення
- •2. Температура кипіння
- •3. Відносна густина
- •4. Показник заломлення
- •5. Молекулярна маса
- •1. Якісний аналіз
- •2. Фізико-хімічні методи встановлення структури речовини
- •3. Ідентифікація невідомої речовини
- •1. Відновлення воднем і реакції гідрУвання
- •2. Одержання металів, їх сплавів і деяких неметалів
- •Питомі теплові ефекти (q) відновлення оксидів алюмінієм
- •3. Одержання металів і деяких неметалів відновленням водних розчинів солей
- •4. Хлорування металів, неметалів і оксидів
- •5. Бромування металів і неметалів
- •6. Йодування металів, неметалів і оксидів
- •7. Одержання сульфідів, селенідів і телуридів
- •8. Нітрування. Одержання нітридів
- •9. Одержання карбідів
- •10. Термічне розкладання речовин з метою одержання оксидів
- •11. Зневоднення крісталогідратів
- •12. Одержання солей
- •1. НітрУвання
- •2. Нітрозування
- •3. Сульфування
- •4. Галогенування
- •5. Алкілювання
- •6. Ацилювання
- •7. ДіазоТуВаНня і Реакції діазосполук
- •8. АзоспОлуЧення
- •9. Відновлення
- •10. Окислення
- •11. Амінування
- •12. Гидроксилювання
- •13. Конденсація
- •14. Полімеризація і поліконденсація
5. Алкілювання
Реакціями алкілювання називають реакції, що включають заміну атома водню органічної сполуки алкільним радикалом. Залежно від того, при якому атомі в молекулі відбувається заміщення водню, розрізняють N-, О- і С-алкілювання.
Механізм реакції. Незалежно від природи реакційного центру субстрату і його будови, а також від будови алкілюючого агента у всіх випадках процеси протікають за електрофільним механізмом. На прикладі алкілювання амінів спиртами (у присутності сильної мінеральної кислоти) схема виглядає так:
AlkOH + Н+ Alk–ОН+2; Alk–OH+2 Alk+ + Н2О
Ar–NH2 + Alk+ → Ar–N+H2–Alk ArNHAlk + H+
За аналогічним механізмом відбувається алкілювання гідроксопохідних з утворенням відповідних алкілових ефірів.
Механізм С-алкілювання ароматичного ядра включає участь каталізаторів, які сприяють утворенню карбкатіонів:
![]()
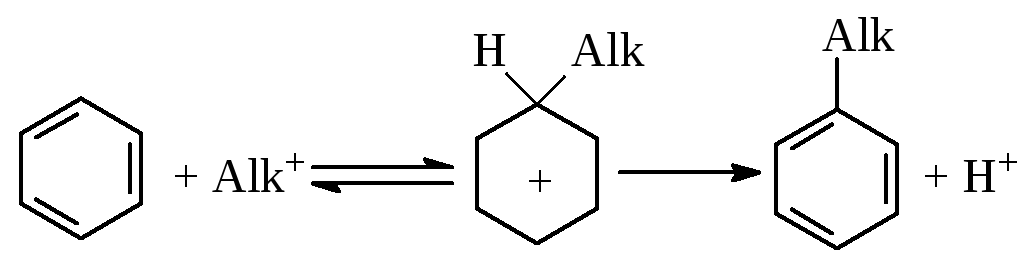
![]()
Алкілюючі агенти. В синтезі алкілпохідних використовуються одно-, двох- і багатоатомні спирти аліфатичного ряду, а також жирно-ароматичні спирти і феноли. Не меншого значення набули галогеналкіли і галогенарили.
У разі малої реакційної здатності субстратів застосовують діалкілсульфати – алкілові ефіри сірчаної кислоти (Alk)2SO4. Більш зручні в роботі в порівнянні з діалкілсульфатами метилові ефіри бензол- і толуолсульфокислот (С6Н5SО2ОСН3 і СН3С6H4SO2ОСН3), які абсолютно нешкідливі. Як м'який алкілюючий засіб використовують діазометан. Його перевага в тому, що побічний продукт реакції – азот – легко видаляється з реакційної суміші. Для добування С-алкілпохідних застосовуються також і ненасичені вуглеводні.
Умови проведення реакцій. Алкілювання амінів. Реакція алкілювання спиртами в звичайних умовах протікає дуже повільно. Тому процес проводять при нагріванні і підвищеному тиску. Залежно від природи алкілюємого субстрату і каталізатора час і температура, при яких здійснюється алкілювання, можуть бути різними. Істотний вплив надає каталізатор – галогеноводневі кислоти. Так, з бромоводневою кислотою швидкість реакції вища, ніж з хлороводневою. У присутності йодоводневої кислоти вона зростає ще більше.
Значний вплив на хід реакції справляє співвідношення аміну і кислоти, яке може змінюватися від 20:1 до 1:1. Хлороводень вводять у реакцію у вигляді гідрохлориду аміну. При використанні сірчаної кислоти її кількість складає 0,05 – 0,3 моль на моль аміну. Воду, яка виділяється в процесі реакції видаляють азеотропною відгонкою або водовіднімаючими засобами.
Алкілювання аміногруп може бути досягнуто також обробкою аміну галогеналкілами. Їх застосування представляє інтерес для введення таких алкільних груп, галогенопохідні яких більш доступні і легше вступають у взаємодію з амінами, ніж відповідні спирти. Застосування найпростіших галогеналкілів, наприклад, хлористого етилу, реалізується в тих випадках, коли аміни не можуть бути алкільовані спиртами. Галогеноводень, що виділяється в процесі реакції іноді зв'язують надлишком аміну, але найчастіше додаванням до реакційної маси гідроксидів лужних і лужноземельних металів, карбонатів натрію і кальцію. Температура реакції, як правило, не перевищує 100°С, тому синтези проводять у колбі зі зворотним холодильником. З низькокиплячими галогеналкілами реакції проводять в автоклавах.
Алкілювання спиртів і фенолів. Алкілювання гідроксогрупи дією спирту і мінеральної кислоти має обмежене застосування, переважно для сполук нафталінового і антраценового рядів. У бензоловому ряді спиртом в кислому середовищі можуть бути алкільовані резорцин і особливо легко флороглюцин. Для алкілювання і, зокрема, для метилювання гідроксосполук широко використовують диметилсульфат і метилові ефіри бензол- і n-толуолсульфокислот. Процес проводять, як правило, з надлишком лугу:
ArONa + (СН3О)2SO2 → АrOСН3 + CH3OS3ONa
Натрієва сіль монометилового ефіру сірчаної кислоти, що утворюється спочатку, при тривалому нагріванні до 100 – 110°С метилює другу молекулу гідроксипохідного:
ArONa + CH3OSO3Na → АrОСН3 + Na2SO4
Перспективними алкілюючими агентами, особливо для фенолів, виявилися галогеналкіли. В цьому випадку найкраще для редакції використовувати феноляти натрію або калію.
Алкілювання ароматичних вуглеводнів. Для алкілювання цих сполук використовуються ті ж реагенти, що і для амінів і спиртів. У разі застосування як алкілюючих агентів спиртів реакція протікає лише з участю кислот. Добрі результати досягаються в синтезах з вищими аліфатичними спиртами, головним чином з третинними. В процесі реакції відбувається ізомеризація радикала спирту, тому у такий спосіб не можна ввести в ядро замісники з нормальним ланцюгом. Первинні спирти ізомеризуються у вторинні, а вторинні – в третинні.
Як правило, при алкілюванні ароматичних вуглеводнів спиртами за присутності сірчаної кислоти останню нагрівають до 70 – 80°С і до неї при перемішуванні повільно, протягом 3 – 5 год., підливають суміш ароматичного вуглеводню і спирту.
Запобіжні засоби. Особливу увагу при проведенні реакцій алкілювання звертають на правила роботи з диметилсульфатом. Останній, будучи отруйним продуктом, вимагає проведення синтезу у витяжній шафі з приспущеними дверцями і використання гумових рукавичок для захисту рук. Роботу з галогеноводнями також проводять у витяжній шафі, дотримуючи всі правила роботи з кислотами.
Ідентифікація. Для ідентифікації продуктів алкілювання можна використовувати як ІЧ-спектри, так і спектри ЯМР.
