
Яцюк, Зубкова _Основы биоорганической химии
.pdf
Государственное образовательное учреждение высшего профессионального образования «Курский государственный медицинский университет Федерального агентства по здравоохранению
и социальному развитию»
Кафедра биоорганической химии
В.Я. Яцюк, И.В. Зубкова
ОСНОВЫ БИООРГАНИЧЕСКОЙ ХИМИИ
для студентов лечебного, педиатрического и медико-профилактического факультетов
Курск – 2010
1
УДК: 577.1(075) |
Печатается по решению |
ББК: 28.072 я 7 |
редакционно-издательского |
|
совета ГОУ ВПО КГМУ |
|
Росздрава |
Яцюк В.Я., Зубкова И.В. Основы биоорганической химии (для студентов лечебного, педиатрического и медико-профилактического факультетов). - Курск: ГОУ ВПО КГМУ Росздрава, 2010. – 248 с.
Общая редакция:
зав. кафедрой биоорганической химии, доктор фармацевтических наук, профессор Яцюк В.Я.
Рецензенты:
зав. кафедрой фармацевтической химии и фармакогнозии ГОУ ВПО «Белгородский государственный университет», профессор О.О. Новиков; профессор кафедры биологической химии ГОУ ВПО «Курский госу-
дарственный медицинский университет», д.м.н., член-корр. РАЕН
Н.А. Быстрова.
Учебное пособие соответствует программе по биоорганической химии для студентов медицинских вузов (Москва, 2004) и отражает опыт чтения лекций на лечебном, педиатрическом и медико-профилактическом факультетах КГМУ.
ISBN |
ББК: 28.072 я 7 |
Коллектив авторов, КГМУ, 2010
ГОУ ВПО КГМУ Росздрава, 2010
2
ВВЕДЕНИЕ
Биоорганическая химия играет важную роль в развитии современной медицинской науки, поэтому она является важной составляющей общего образования врача.
Целью биоорганической химии как учебной дисциплины является формирование знаний взаимосвязи строения и химических свойств биологически важных классов органических соединений, биополимеров и их структурных компонентов, т.е. основы для восприятия биологических, экологических и медицинских знаний на современном молекулярном уровне. Биоорганическая химия формирует знания и умения для изучения биохимии, фармакологии, молекулярной биологии, физиологии.
В качестве исходной общетеоретической основы для характеристики свойств и механизма функционирования биологически активных соединений необходимы знания электронного строения химических связей, взаимного влияния атомов в молекулах, пространственных эффектов, сведения об электронных механизмах химических реакций. Важнейшее место отводится овладению знаниями о реакционной способности функциональных групп.
Для решения вопроса химической совместимости лекарственных средств, выбора пути их введения, предположений о пути метаболизма ксенобиотиков и выведения из организма продуктов их детоксикации необходимо изучение кислотноосновных свойств органических соединений, прогнозирование их отношения к гидролизу, окислению и т.д., исходя из знания их химических свойств.
3
ЭЛЕКТРОННОЕ СТРОЕНИЕ ЭЛЕМЕНТОВ- ОРГАНОГЕНОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ОРГАНИЧЕСКИХ МОЛЕКУЛАХ
Биоорганическая химия изучает строение и свойства соединений, участвующих в процессах жизнедеятельности, во взаимосвязи с их биологическими функциями.
Основные объекты изучения биоорганической химии – это биополимеры (углеводы, пептиды и белки, нуклеиновые кислоты) и биорегуляторы (гормоны, витамины, лекарственные средства).
Биоорганическая химия неразрывно связана с органической химией, т.к. использует её методы и принципы. В основе теории органической химии, сформулированной А.М. Бутлеровым, лежит положение о зависимости свойств соединений от их химического строения и взаимного влияния атомов в молекулах. Это значит, что химические свойства органических соединений обусловлены типом химических связей, природой связываемых атомов и их взаимным влиянием. А это, в свою очередь, определяется электронным строением атомов и взаимодействием их атомных орбиталей.
Рассмотрим электронное строение атомов тех элементов, которые чаще всего встречаются в структуре органических молекул углерода, водорода, азота и кислорода.
Атомная орбиталь – это область пространства вокруг атомного ядра, в которой возможность нахождения электрона максимальна.
Водород – элемент первого периода, следовательно, его внешний электронный уровень представлен только s-орбиталью (она имеет сферическую форму). Углерод, азот и кислород – элементы второго периода, их внешний электронный уровень представлен одной s- и тремя p-орбиталями. Причём эти три p- орбитали характеризуются одинаковой формой (объёмной восьмёрки или гантели), энергией, но отличны ориентацией в пространстве (в трёхмерной системе координат – px, py и pz).
4
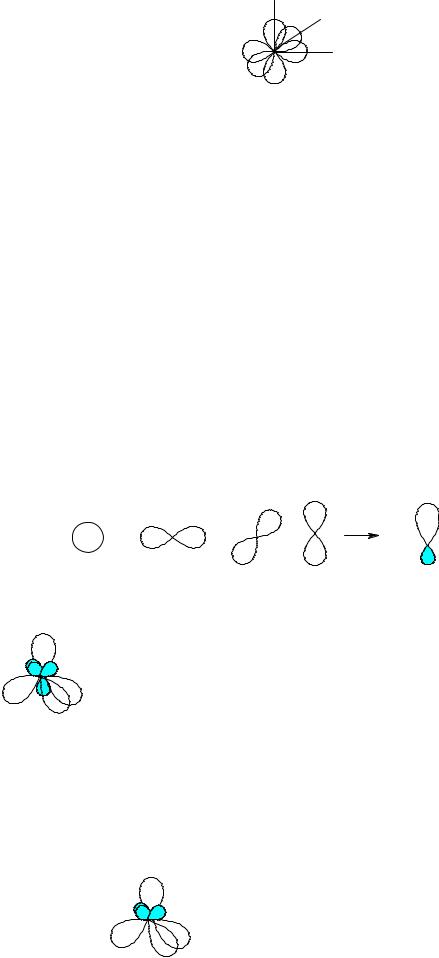
z |
y |
x |
Электронное строение углерода в основном состоянии 1s22s22p2. В возбуждённом состоянии (т.е. при образовании свя-
зей) – 1s22s2p3.
Ворганической химии широко используются представления
огибридных орбиталях. Сущность гибридизации заключается в том, что из нескольких различных орбиталей, близких по энергии, образуется такое же число атомных орбиталей одинаковых по форме и энергии. Гибридные орбитали за счёт большего перекрывания затем образуют более прочные связи по сравнению с негибридными.
Атомы углерода и азота могут находиться в одном из трёх состояний гибридизации – sp3, sp2, sp. Для атома кислорода характерна sp3- и sp2-гибридизация.
Процесс sp3-гибридизации протекает с участием всех четырёх внешних атомных орбиталей углерода:
+ |
+ |
+ |
|
4 |
s |
px |
py |
pz |
гибридные |
|
|
|||
|
|
орбитали |
||
|
|
|
|
Гибридные орбитали равноценны, имеют форму не-
.
правильных объёмных восьмёрок и расположены в пространстве под углом 109о28’, т.е. направлены к
.. . углам тетраэдра. Поэтому sp3-гибридизованный атом
углерода называют тетраэдрическим. У атома углерода на каждой гибридной орбитали присутствует по одному электрону.
Электронная конфигурация sp3-гибридизованного атома азота отличается тем, что на одной из гибридных орбиталей у не-
го присутствуют два электрона (электронная формула азота
1s22s22p3): ..
. . .
. .
5
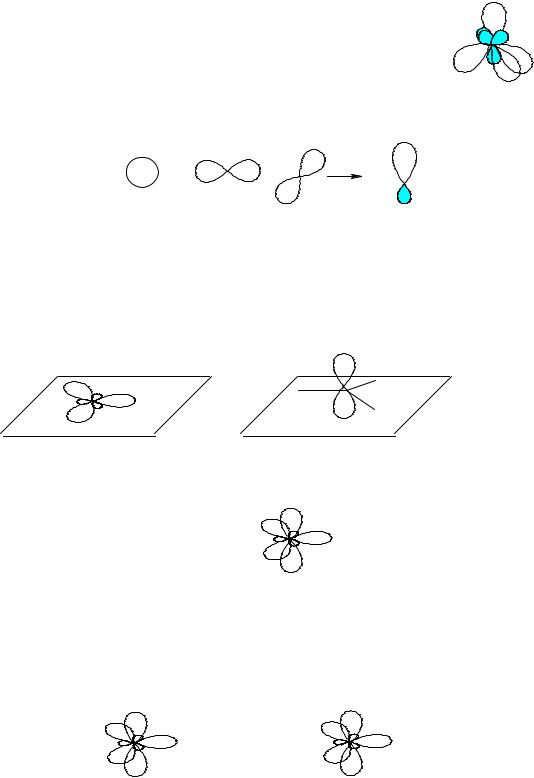
Эту пару электронов называют неподелённой электронной парой, т.к. обычно она не участвует в образовании связей. Валентный угол sp3-гибридизованного азота равен 107о.
У sp3-гибридизованного атома кислорода (электронная формула – 1s22s22p4) две гибридные орбитали заняты неподелёнными
о |
|
.. |
|
электронными парами и валентный угол равен 104,5 : |
|
||
|
|
||
|
.. |
. |
. |
|
|
|
|
В sp2-гибридизации участвуют s-орбиталь и две p-орбитали:
|
+ |
+ |
3 |
s |
px |
py |
|
|
|
гибридные |
|
|
|
|
орбитали |
Одна pz-атомная |
орбиталь |
остаётся |
негибридизованной. |
sp2-атомные орбитали расположены в одной плоскости под углом 120о, а pz-орбиталь – перпендикулярно им. pz
У sp2-гибридизованного атома углерода на каждой орбитали находится по одному электрону:
.
.
.
.
Распределение электронов по орбиталям (электронная конфигурация) у sp2-гибридизованного атома азота может быть различным: неподелённая электронная пара может находиться или на sp2-атомной орбитали, или на негибридной pz-орбитали.
. |
.. |
. |
. |
. |
|
||
|
. |
: |
|
|
. |
|
6

Известны также два типа sp2-гибридизованных атома кислорода: на pz-орбитали может находиться один электрон или неподелённая электронная пара.
. |
|
.. |
|
. |
. |
|
|
|
|
||
|
. |
: |
или |
. |
: |
|
|
|
. |
|
В sp-гибридизации участвуют s- и p-атомные орбитали:
+ |
|
2 |
|
s |
px |
гибридные |
Две гибридные орбитали |
|
|
||
|
|
орбитали |
расположены под углом |
|
|
|
|
|
|
|
180о. |
Оставшиеся негибридными py- и |
pz-орбитали расположены |
||
перпендикулярно осям гибридных орбиталей и перпендикулярно
друг другу: |
pz |
|
|
py |
|
У sp-гибридизованного атома углерода каждая орбиталь за- |
||
нята одним электроном: |
. . |
|
.  .
.
Неподелённая электронная пара sp-гибридизованного азота
всегда расположена на одной из гибридных орбиталей:
. .
. :
Для кислорода sp-гибридизация не характерна.
Очень важно научиться определять тип гибридизации и электронную конфигурацию атомов. Это необходимо для понимания распределения электронной плотности в молекулах, опре-
7
деления электронных эффектов, стабильности молекул и промежуточных частиц. А это, в свою очередь, помогает определить преимущественное направление реакции, сравнить активность различных соединений в той или иной химической реакции.
Как же правильно определить тип гибридизации атомов в молекулах?
Для углерода тип гибридизации определяется по количеству σ-связей. σ-Связи образуются за счёт гибридных орбиталей, значит, сколько σ-связей у углерода, столько и гибридных орбиталей. Например, определим тип гибридизации атомов углерода в молекуле пропена CH2=CH-CH3. Первый атом углерода образовал три σ-связи (одну – с соседним углеродом и две – с двумя атомами водорода), значит, у этого углерода три гибридных орбитали, что соответствует sp2-гибридизации. Второй атом углерода также образовал три σ-связи (две – с двумя соседними атомами углерода и одну – с водородом), т.е. он также находится в sp2-гибридизации. Третий углерод образовал четыре σ-связи, имея четыре гибридных орбитали, т.е. он sp3-гибридизован.
Тип гибридизации атомов азота или кислорода определяется по соседнему углероду, например, в молекуле этиламина CH3-CH2-NH2 азот имеет sp3-гибридизацию так же, как и соседний углерод. В молекуле виниламина CH2=CH-NH2 азот sp2- гибридизован.
Если вы определили, что азот или кислород в какой-либо молекуле sp2-гибридизован, возникает следующая проблема. Нужно определить его электронную конфигурацию (распределение электронов по орбиталям). Другими словами, нужно определить число электронов на негибридной орбитали. Запомните, что если sp2-гибридизованный азот (или кислород) образовал только одинарные связи, на негибридной орбитали – 2 электрона (неподелённая электронная пара). Если же он образовал двойную связь, на негибридной орбитали – 1 электрон. Например, электронная конфигурация атома азота в молекуле виниламина
CH2=CH-NH2 : |
. |
.. |
|
. |
|
|
|
|
|
|
. |
8
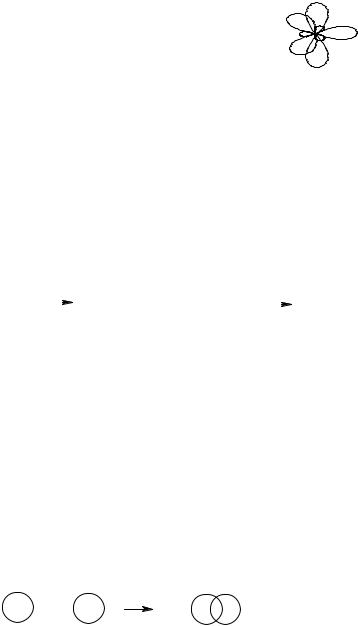
а в молекуле имина формальдегида CH2=NH : |
. |
. |
:
.
Химическая связь в органических молекулах
Различают два основных типа связи – ковалентную и электровалентную (ионную). Ковалентная связь возникает в результате обобщения неспаренных валентных электронов с противоположными спинами, электровалентная – за счёт передачи неспаренного электрона одного атома другому с образованием противоположно заряженных ионов, которые взаимно притягиваются. Это можно показать в виде схемы:
. |
. |
|
|
A: B |
. |
. |
|
|
+ |
- |
|
|
|
||||||||
A + |
|
B |
|
A + |
|
B |
|
A + : B |
||
ковалентная связь |
электровалентная связь |
|||||||||
В органических молекулах в основном присутствуют ковалентные связи. Для их описания используют два метода: метод валентных пар и метод молекулярных орбиталей. Коротко рассмотрим их.
Метод валентных пар предполагает, что при образовании ковалентной связи происходит перекрывание атомных орбиталей взаимодействующих атомов с образованием общей электронной пары, посредством которой атомы и удерживаются друг с другом. При этом электрон продолжает находиться на своей атомной ор-
битали: |
+ |
. |
: |
. |
|
||
независимые |
перекрывание |
||
атомные орбитали |
атомных орбиталей |
||
В соответствии с методом молекулярных орбиталей при образовании связи из n атомных орбиталей образуется n молекулярных орбиталей. Молекулярная орбиталь принадлежит не отдельным атомам, а обоим связываемым атомам, т.е. молекулярная орбиталь как минимум двухцентровая (на самом деле, молекулярные орбитали могут быть и многоцентровыми, например, в так называемых сопряжённых системах). Если связь образуется между двумя атомами, то при взаимодействии их атомных орбиталей образуются две молекулярные орбитали. На одной из них (связывающей), с минимальной энергией, находятся два элек-
9

трона. Другая (разрыхляющая), с максимальной энергией, остаётся вакантной.
. |
+ |
. |
. . |
|
|
|
|
независимые |
связывающая |
||
атомные орбитали |
молекулярная орбиталь |
||
Существует два типа ковалентных связей – σ- и π-. σ-Связью называется ковалентная связь, образованная при
перекрывании атомных орбиталей по оси, соединяющей центры атомов, с максимумом перекрывания по этой оси. При образовании σ-связей могут перекрываться s-, p- и гибридные орбитали:
s s s p p p гибридные орбитали
У элементов-органогенов (C, N, O, S) в образовании σ-связей участвуют гибридные орбитали, т.к. в этом случае возможно более эффективное перекрывание, и образуется более прочная связь.
Кроме осевого перекрывания атомных орбиталей возможно и боковое, приводящее к образованию π-связей.
π-Связь образуется при боковом перекрывании негибридных p-орбиталей с максимумом перекрывания по обе стороны от оси, соединяющей центры атомов. За
p p счёт этого π-связь менее прочная, чем σ-связь. Встречающиеся в органических соединениях крат-
ные связи являются сочетанием σ- и π-связей: двойная – одна σ- и одна π-связь; тройная – одна σ- и две π-связи.
Свойства ковалентной связи выражаются следующими характеристиками: длина, энергия, полярность, поляризуемость.
Длина связи – это расстояние между центрами связанных атомов. Длина связи является её важной характеристикой, т.к. от длины зависит энергия связи. Длина связи приблизительно равна сумме атомных радиусов связываемых атомов. Чтобы сравнить длины различных связей, нужно сравнить атомные радиусы атомов, а это можно сделать, используя Периодическую таблицу Д.И. Менделеева. Например, сравним длины следующих связей:
10
