
Яцюк, Зубкова _Основы биоорганической химии
.pdf
кислот, например, ангидриды. Так, фенилацетат (сложный эфир фенола и уксусной кислоты) получают при взаимодействии фенола с уксусным ангидридом:
|
OH |
O |
|
|
|
|
O-C |
-CH 3 |
|
|||
|
|
|
CH3-C |
|
|
|
|
|
||||
|
|
|
|
|||||||||
|
|
+ |
O |
|
|
|
|
|
|
|
|
+ CH3-COOH |
|
|
|
|
|
|
|
O |
|||||
|
|
|
||||||||||
фенол |
CH3-C |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||
O |
фенилацетат |
|
||||||||||
|
|
|
|
|||||||||
|
|
уксусный ангидрид |
(сложный эфир) |
|
||||||||
Для получения простых эфиров фенолы предварительно переводят в феноляты, а уже потом подвергают реакции алкилирования алкилгалогенидами:
OH + NaOH |
ONa + H2O |
|
фенолят натрия |
ONa + C2H5-I |
OC2H5 + NaI |
этил иодид |
|
фенолят натрия |
метилфениловый эфир |
Реакции окисления фенолов протекают легче, чем спиртов. Особенно легко окисляются многоатомные фенолы (даже кислородом воздуха).
При окислении фенола образуется смесь орто- и парахинонов:
OH |
|
O |
O |
|
|
|
|
|
|
|
K2Cr2O7, H2SO4 |
|
O |
|
|
|
+ |
|
|
|
|
|
|
|
фенол |
|
O |
о-хинон |
|
|
|
|
|
|
|
|
п-хинон |
|
|
OH |
O |
|
OH |
O |
OH |
[O] |
O |
[O] |
|
пирокатехин |
о-хинон |
|
OH |
O |
|
|
|
|
|
|
|
|
гидрохинон |
п-хинон |
61
Хиноны широко распространены в природе, они участвуют в окис- лительно-восстановительных процессах, сопровождающих дыхание. Принимая два электрона и два протона, хиноны восстанавливаются в соответ-
ствующие гидрохиноны: |
|
|
O |
|
|
OH |
||||||
|
|
|
|
|
|
|
- |
+ |
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
+2e, +2H |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
- |
+ |
|
|
|
|
|
|
|
|
|
|
|
-2e, -2H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||
|
|
|
O |
|
|
|
||||||
|
п-хинон |
гидрохинон |
||||||||||
Окислительно-восстановительные свойства системы хинон – гидрохинон играют важную роль в организме. По отношению к большинству органических субстратов эта система выполняет роль окислителя. Принимая электроны от субстрата, производное хинона in vivo превращается в соответствующий гидрохинон, который в свою очередь передаёт электроны кислороду (через цитохромную систему) и опять окисляется в хинон. Таким образом, система хинон – гидрохинон участвует в переносе электронов от субстрата к кислороду.
Биологически важными производными хинонов являются витамины группы К (см. стр. 233 ) .
Реакции фенола по ароматическому кольцу. Фенол вступает в реакции электрофильного замещения легче, чем бензол, т.к. фенольный гидроксил, являясь электронодонорным заместителем (+M>-I), повышает электронную плотность в кольце, особенно в орто- и пара-положениях.
Нитрование фенола протекает при действии разбавленной азотной кислоты, без катализатора (бензол нитруют смесью концентрированных азотной и серной кислот):
OH |
|
OH |
OH |
|
+ HNO3 |
|
+ |
|
NO2 |
O2N |
|
|
|
||
фенол |
|
о-нитрофенол |
п-нитрофенол |
Бромирование фенола в неполярном или малополярном растворителе приводит к образованию смеси о- и п-бромфенолов:
OH |
|
OH |
OH |
|
+ Br2 |
CHCl3 |
+ |
|
Br |
Br |
|
|
|
||
фенол |
|
о-бромфенол |
п-бромфенол |
|
|
|
62
Если же бромирование проводят в избытке бромной воды, образуется 2,4,6-трибромфенол:
|
|
Br |
|
OH |
H2O |
OH |
|
+ 3 Br2 |
+ 3 HBr |
||
Br |
|||
|
Br |
||
фенол |
2,4,6-трибромфенол |
||
Эта реакция используется как качественная реакция на фенол: 2,4,6-триброфенол образует белый осадок.
Другой качественной реакцией на фенол (реакция на фенольный, а точнее, енольный, гидроксил =C-OH) является реакция с раствором FeCl3. Различные фенолы при этом образуют продукты разной окраски, например, фенол – фиолетовое, крезолы – голубое.
Медико-биологическое значение спиртов и фенолов
Метанол является высокотоксичным соединением, вызывает ацидоз и слепоту, связанные с накоплением в организме формальдегида и муравьиной кислоты – продуктов окисления метанола.
Этанол используется как обеззараживающее средство, для приготовления настоек, как растворитель и реагент в органическом синтезе.
Глицерин применяется как компонент кремов и мазей для смягчения кожи, является структурной основой молекул жиров.
Фенолы являются антисептическими средствами. Фенол – первый антисептик, использованный в хирургии.
Крезолы используются как дезинфицирующие средства. Резорцин применяют при лечении кожных заболеваний. Тимол (2-изопропил-5-метилфенол) содержится в эфирных
маслах многих растений. В медицине он применяется как антисептическое и антигельминтное средство.
63

КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. РЕАКЦИОННАЯ СПОСОБНОСТЬ АМИНОВ
Кислотные и основные свойства органических соединений являются важными аспектами их реакционной способности. Перенос протона водорода наблюдается в ходе многих биохимических реакций.
Современные представления о природе кислот и оснований основаны на теории Бренстеда.
По Бренстеду, кислоты – это нейтральные молекулы и ионы, способные отдавать протоны водорода (доноры протонов). Основаниями являются нейтральные молекулы и ионы, способные присоединять протоны водорода (акцепторы протонов).
Кислотно-основное взаимодействие может быть представлено схемой:
A-H + B |
A- + B+-H |
кислота основание |
сопряжённые |
основание кислота
Кислота A-H, теряя протон, превращается в основание A-, которое называют сопряжённым основанием данной кислоты. Наоборот, основание B, принимая протон, превращается в сопряжённую кислоту B+-H.
В кислотно-основном равновесии существует важная закономерность: чем сильнее кислота, тем слабее сопряжённое с ней основание.
Понятие кислотности и основности взаимосвязаны: кислотные свойства проявляются только в присутствии оснований и наоборот.
Например, газообразный хлороводород не проявляет кислотных свойств, для этого необходимо присутствие основания:
HCl + H2O |
Cl - + |
H3O+ |
кислота основание |
сопряжённые |
|
|
основание |
кислота |
Некоторые соединения в зависимости от условий могут проявлять и кислотные, и основные свойства, т.е. понятия «кислота» и «основание» относительны. Например, в присутствии
64
воды как основания уксусная кислота проявляет кислотные свойства, а в присутствии концентрированной серной кислоты – основные:
O |
|
|
|
|
|
|
|
O |
|
+ |
|
+ H2O |
|
|
|
|
|
|
|
|
|
CH3-C |
|
|
|
|
|
CH3-C |
O- |
+ H3O |
||
|
|
|
||||||||
|
|
|
|
|||||||
OH основание |
|
|
|
|
|
|||||
кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
O |
|
|
|
|
|
|
|
OH |
+ HSO-4 |
|
CH3-C |
+ H2SO4 |
|
|
|
|
CH3-C |
OH |
|||
|
|
|
|
|||||||
|
|
|
||||||||
OH |
|
|
|
|
|
|
|
|
||
основание |
кислота |
|
|
|
|
|
|
|||
Так как в биохимических процессах растворителем обычно является вода, то дальше мы будем рассуждать о кислотноосновных свойствах соединений по отношению к воде.
Кислоты Бренстеда
Сила кислот количественно выражается константой равновесия реакции (К), заключающейся в переносе протона водорода от кислоты к основанию – молекуле воды.
A-H + H O |
|
|
|
A- + H O+ |
|
|
|||
|
|
|
||
2 |
3 |
|||
Используя значение константы равновесия этой реакции и учитывая, что концентрация воды практически постоянна, можно определить произведение K.[H2O], называемое константой кислотности (Ka) (от слова acid – кислота).
|
- |
+ |
|
- |
+ |
|
|
K= |
[A ][H3O ] |
; K |
= K. [H O] = |
[A ][H3O ] |
|||
|
|
|
|
|
|||
|
[A-H] [ H2O] |
a |
2 |
|
[A-H] |
||
|
|
|
|
||||
Чем больше Ka, тем сильнее кислота. Но величины Ka очень |
|||||||
малы (например, Ka |
уксусной кислоты 1,75. 10-5 ), пользоваться |
||||||
ими неудобно, поэтому введено понятие «показатель константы кислотности» (её отрицательный логарифм) - pKa. pKa=-lg Ka. Например, для уксусной кислоты pKa=4,75. Чем меньше величи-
на pKa, тем сильнее кислота.
65

В зависимости природы кислотного центра (атома, отщепляющего протон водорода) различают следующие типы кислот:
-OH-кислоты (вода, спирты, фенолы, карбоновые кислоты);
-SH-кислоты (тиоспирты, тиофенолы, тиокислоты);
-NH-кислоты (аммиак, амины, амиды кислот, пиррол);
-CH-кислоты (углеводороды и их производные).
Сила кислот определяется стабильностью сопряжённых ос-
нований – чем стабильнее сопряжённое основание (анион ки- слоты), тем сильнее кислота.
Стабильность сопряжённого основания определяется степенью делокализации заряда, которая зависит от следующих факторов: природа атома в кислотном центре, влияние радикала, степень сольватации.
Рассмотрим каждый из этих факторов.
Природа атома в кислотном центре. Для делокализации отрицательного заряда наибольшее значение имеют электроотрицательность атома и его поляризуемость.
Чем выше электроотрицательность атома, получившего отрицательный заряд после отщепления протона, тем сильнее он этот отрицательный заряд удерживает и труднее предоставляет протону, а значит равновесие A-H  А- + H+ смещается вправо.
А- + H+ смещается вправо.
В периодах слева направо электроотрицательность возрастает. Поэтому OH-кислоты сильнее NH-кислот, а NH-кислоты сильнее CH-кислот (при прочих равных условиях).
Так как электроотрицательность атомов зависит от типа гибридизации, то среди CH-кислот при переходе от алканов к алкенам и далее к алкинам кислотность возрастает:
CH3-CH3 < CH2=CH2 < CH≡CH.
Так, этан и этилен не реагируют с амидом натрия, а ацети-
лен – реагирует: |
CH CH + NaNH2 |
CH CNa + NH3 |
|
В группах сверху вниз увеличивается поляризуемость. Это связано с тем, что увеличивается число энергетических уровней, т.е. объем электронных оболочек. Чем выше поляризуемость, тем более делокализован заряд, тем стабильнее анион, а значит, выше
66

сила кислоты. Поэтому SH-кислоты сильнее, чем OH-кислоты. Например, спирты не реагируют со щелочами, а тиолы – реагируют:
C2H5-OH + NaOH
этанол
C2H5-SH + NaOH |
|
C 2H5-SNa + H2O |
|
||
этантиол |
|
этантиолят |
|
|
натрия |
Влияние радикала (заместителя). Кислотность органиче-
ских соединений в значительной степени зависит от природы заместителя, связанного с реакционным центром. Особенно сильно повышает кислотные свойства наличие сопряженной системы в анионе.
Сравним кислотные свойства спиртов и фенолов.
OH |
|
O - + H + |
|
фенолят анион |
|
CH -OH |
CH O - |
+ H + |
3 |
3 |
|
алкоголят
анион
В случае фенолят-аниона (p,π-сопряженная система) степень делокализации заряда гораздо выше, поэтому фенолы более сильные OH-кислоты, чем спирты. Например, фенолы в отличие от спиртов реагируют с щелочами:
OH + NaOH |
ONa + H2O |
фенолят натрия
Разницу в кислотных свойствах можно подтвердить и величинами pKa: для фенола pKa=10,00; для метанола pKa=16,00.
Фенолы – более сильные кислоты, чем спирты, но и они являются слабыми: фенол не вытесняет угольную кислоту из её солей, т.е. является более слабой кислотой, чем угольная.
Сравнивая кислотные свойства фенолов и карбоновых ки- слот, нужно отметить, что и фенолят-, и ацилат-анион являются p,π-сопряженными системами, но в ацилат-анионе наблюдается более полная делокализация отрицательного заряда за счёт двух электроотрицательных атомов кислорода:
67

|
O |
|
O |
|
|
|
O-1/2 |
CH -C |
|
CH -C |
O - |
+ H + |
или |
CH -C |
|
3 |
OH |
3 |
|
3 |
O-1/2 |
||
|
|
|
|
|
|||
|
|
ацетат анион |
|
|
|
|
|
|
OH |
|
O - |
+ H + |
|
|
|
|
|
фенолят анион |
|
|
|
|
|
В отличие от фенолов карбоновые кислоты взаимодействуют с гидрокарбонатом натрия:
CH3-COOH + NaHCO 3 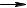 CH3-COONa + CO 2 + H2O , т.е. они явля-
CH3-COONa + CO 2 + H2O , т.е. они явля-
уксусная ацетат натрия кислота
ются более сильными кислотами, чем угольная кислота. Заместители в радикале также влияют на кислотные свойст-
ва. Если заместитель способствует делокализации отрицательного заряда в анионе (электроноакцепторный заместитель), то кислотность будет выше. И наоборот, электронодонорные заместители затрудняют делокализацию заряда и поэтому понижают кислотные свойства.
Сравним кислотные свойства следующих соединений: масляная кислота, α-хлормасляная и β-хлормасляные кислоты.
O |
|
|
|
O |
|
+ H + |
CH3-CH2-CH2-C |
CH |
CH |
CH |
C |
- |
|
OH |
3 |
2 |
2 |
O |
|
|
масляная кислота |
|
|
|
|
|
|
pKa=4,80 |
|
|
|
|
|
|
O |
|
|
|
O |
|
+ H + |
CH3-CH2-CH-C |
CH3-CH2-CH C |
- |
||||
OH |
|
|
|
O |
|
|
Cl |
|
|
Cl |
|
|
|
α-хлормасляная кислота |
|
|
|
|
|
|
pKa=2,84 |
|
|
|
|
|
|
O |
|
|
|
O |
- + H + |
|
CH3-CH-CH2-C |
CH3-CH CH2 |
C |
||||
OH |
|
|
|
O |
|
|
Cl |
|
Cl |
|
|
|
|
β-хлормасляная кислота pKa=4,06
Анион масляной кислоты стабилизируется только за счёт слабого индуктивного эффекта углеводородного радикала. Атом хлора проявляет сильный отрицательный индуктивный эффект,
68
поэтому гораздо более сильно стабилизирует анион кислоты. Так как индуктивный эффект передается с затуханием, влияние хлора в α-положении проявляется сильнее. Итак, самой сильной является α-хлормасляная кислота, затем – β-хлормасляная и, наконец, самая слабая кислота – масляная. Это подтверждается и значениями pKa данных кислот.
В ароматическом ряду электроноакцепторные заместители также способствуют делокализации заряда, таким образом увеличивая кислотные свойства. Электронодонорные заместители оказывают обратное влияние.
O- |
O- |
O- |
N |
|
: NH2 |
|||
O |
|
O |
+M NH |
> -I NH2 |
|
-I NO2 |
, |
||||
-M NO |
2 |
2 |
|||
|
|
|
|
||
pKa=7,16 pKa=10,0 pKa=10,68
Суммируя все наши рассуждения, можно выстроить ряд убывания кислотных свойств OH-кислот:
карбоновые кислоты > угольная кислота > фенолы > спирты. (Причем в каждой группе электронодонорные заместители
понижают кислотность, а электроноакцепторные – повышают).
Основания Бренстеда
Основания, по Бренстеду, это нейтральные молекулы и ионы, способные присоединять протон водорода. Для образования ковалентной связи с протоном основания Бренстеда должны предоставлять или неподелённую электронную пару, или электроны π-связи. В соответствии с этим основания Бренстеда делятся на n-основания и π-основания.
n-Основания – это анионы или нейтральные молекулы, имеющие атом с неподелённой электронной парой. Их классифицируют по центрам основности следующим образом:
69

- оксониевые основания: спирты R-ÖH, простые |
эфиры |
|||||||||
R-Ö-R, сложные эфиры |
R-C |
O: , альдегиды и кетоны |
R-C |
O: |
||||||
|
|
O-R' |
|
|
|
R'(H) |
||||
- |
аммониевые основания: амины |
.. |
|
, гетероциклические |
||||||
R-NH2 |
||||||||||
соединения, например, пиридин |
|
N |
|
|
.. |
|
.. |
|||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
- |
сульфониевые основания: тиоспирты |
|
|
|||||||
R-SH |
|
R-S-R' |
||||||||
|
, тиоэфиры |
. |
||||||||
π-Основания – соединения, имеющие π-связи, т.е. алкены, алкадиены, алкины, арены. Это очень слабые основания, т.к. протонируемые электронные пары несвободны. Например, этен проявляет π-основные свойства при образовании π-комплекса с
протоном водорода: |
CH |
=CH |
2 |
+ H+ |
CH |
2 |
|
|
|
CH |
|
|
|
||||||||
|
|
|
|
|||||||
|
|
|
|
|||||||
|
2 |
|
|
|
|
2 |
||||
H+
π-комплекс
Для количественной характеристики основности использу-
ют величину pKa сопряжённой с данным основанием кислоты
(BH+). Эту величину обозначают pKBH+. Чем pKBH+ больше, тем сильнее основание.
Влияние природы атома в основном центре и связанных с ним заместителей на основность противоположно рассмотренному ранее их влиянию на кислотность:
- с увеличением электроотрицательности атома основного центра основность уменьшается (атом труднее отдаёт свою неподелённую электронную пару для присоединения протона), т.е. аммониевые основания сильнее оксониевых. Так, этанол способен взаимодействовать только с концентрированными минеральными кислотами:
|
|
.. |
|
|
|
|
|
|
|
|
|
|
+ H |
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
CH -CH |
-OH |
+ H |
SO |
|
|
|
|
|
CH -CH |
-O |
HSO |
|
|||||
4 |
|
|
4 |
|
|||||||||||||
|
|
|
|
||||||||||||||
3 |
2 |
|
2 |
|
|
3 |
2 |
H |
|
, |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
этилоксония гидросульфат
а этиламин проявляет основные свойства даже при взаимодейст-
вии с водой: |
.. |
+ |
- |
|
|
|
C2H5-NH2 + H2O |
|
C2H5-NH3 OH |
|
|
|
|
|
|||
|
этиламин |
|
этиламония гидроксид |
. |
|
|
|
|
|
|
|
70
