
Яцюк, Зубкова _Основы биоорганической химии
.pdf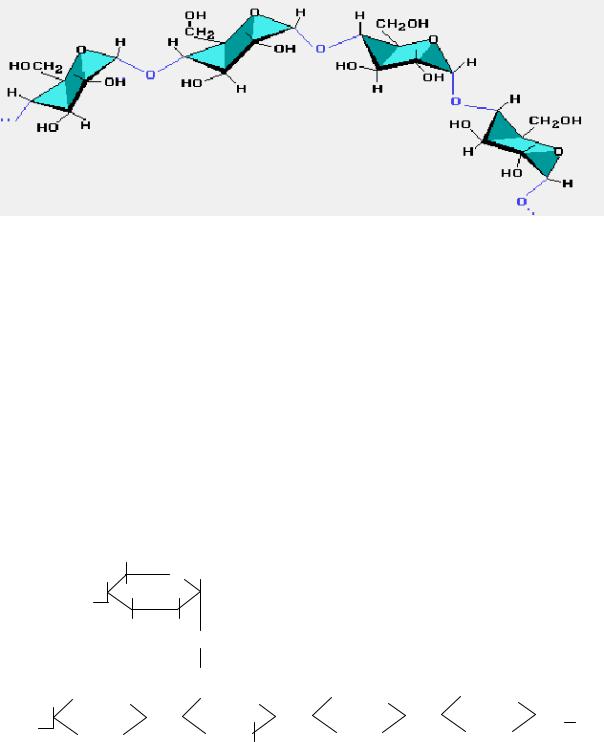
рода у α-D-глюкопиранозы – полуацетальный гидроксил находится в аксиальном положении (см. стр. 162).
Рис. 3. Фрагмент спирали амилозы.
Во внутреннюю полость этой спирали могут входить подходящие по размеру молекулы, например, молекулы иода, образуя комплексы, так называемые соединения включения. Комплекс амилозы с иодом имеет синюю окраску. Эта реакция используется и для открытия крахмала, и для обнаружения иода.
Амилопектин имеет разветвленное строение. В цепи D-глюкопиранозные остатки связаны α-1,4-гликозидными связями, а в точках ветвления – α-1,6-гликозидными связями. Между точками ветвления расположены 20-25 моносахаридных остатков. Молекула амилопектина состоит из нескольких тысяч остатков D-глюкозы (молекулярная масса – 1-6 млн.).
CH2OH
O
OH
OH
O α-1,6
CH2OH |
|
|
|
|
CH2 |
|
|
|
|
|
|
CH2OH |
|
|
|
|
|
CH2OH |
|
|
|||||||||||||
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
OH |
|
O |
|
|
OH |
|
|
|
O |
|
|
OH |
|
O |
|
|
|
|
OH |
|
|
O |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
OH α-1,4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
OH |
|
|
||||||||
амилопектин
В связи с наличием разветвлений молекула амилопектина не способна принимать форму спирали и связывает иод в незначительных количествах.
181
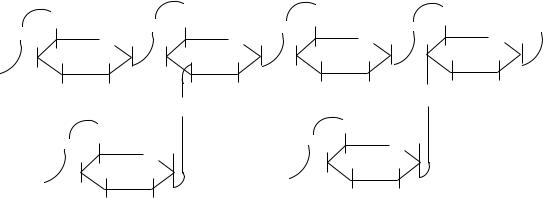
Гидролиз крахмала в пищеварительном тракте происходит с участием фермента амилазы, расщепляющего α-1,4- и α-1,6-гликозидные связи. Конечными продуктами гидролиза являются мальтоза и глюкоза.
В животных организмах функцию запасного питательного вещества выполняет гликоген (животный крахмал). Строение гликогена сходно со строением амилопектина, но его молекула еще более разветвлена. Между точками ветвления находится 10-12 глюкозных остатков (молекулярная масса гликогена может достигать многих млн.). Сильная разветвленность цепей гликогена способствует атаке его ферментами сразу со многих концов. Это приводит к чрезвычайно высокой скорости расщепления полисахарида и, следовательно, к почти мгновенной мобилизации заключенных в гликогене энергетических запасов. Наиболее богаты гликогеном печень и мышцы.
Декстраны – полисахариды бактериального происхождения. Они построены из остатков α-D-глюкопиранозы. Молекулы декстранов сильно разветвлены. Основной тип связи – α-1,6-гликозидная, в местах ветвления – α-1,3 и α-1,4:
CH2 |
α-1,6 |
CH2 |
O CH2 |
|
|
CH2 |
O |
|
O |
||||
O |
O |
|
O |
O |
|
O |
|
|
|
OH |
|
|
OH |
HO |
HO |
|
HO |
OH |
|
OH |
|
OH |
O |
OH |
O |
||
|
|
|
|
|
α-1,4 |
|
|
CH2 |
α-1,3 |
|
CH2 |
|
|
O |
O |
O |
|
|||
|
|
|
||||
|
O |
|
|
OH |
|
|
|
OH |
|
|
|
|
|
|
|
HO |
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Структура декстрана |
|
|
|
|
Молекулярная масса декстранов достигает нескольких млн. Они плохо растворимы в воде. Путем частичного гидролиза получают так называемые «клинические декстраны» с молекулярной массой 50-100 тыс. Их используют в качестве заменителя плазмы крови (препарат «Полиглюкин»).
Наиболее широко распространенный растительный гомополисахарид – целлюлоза (клетчатка). Молекулы целлюлозы обла-
182
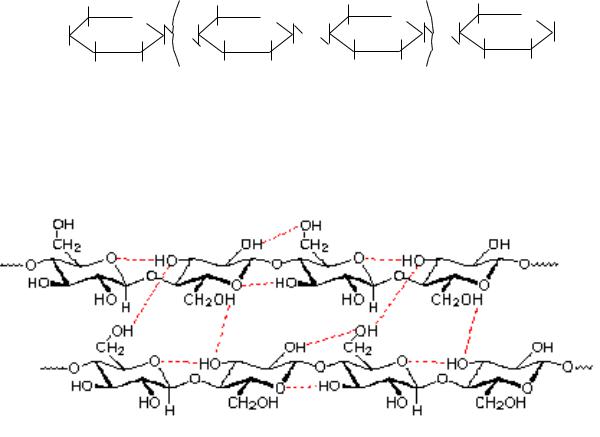
дают большой механической прочностью, поэтому выполняют роль опорного материала растений.
Молекула целлюлозы – длинная линейная цепь, состоящая из остатков β-D-глюкопиранозы, тип связи между моносахаридными остатками – β-1,4-гликозидная. Молекулярная масса целлюлозы от 400 000 до 2 млн.
CH2OH |
CH2OH |
|
CH2OH |
|
CH2OH |
O |
O |
|
O |
|
O OH |
OH |
O OH |
O OH |
O OH |
||
HO |
OH |
β-1,4 |
OH |
n |
OH |
OH |
|
|
|||
Целлюлоза
β-Конфигурация аномерного атома углерода приводит к линейному строению молекулы (β-полуацетальный гидроксил занимает экваториальное положение) (рис. 4).
Рис. 4. Строение фрагмента молекулы целлюлозы.
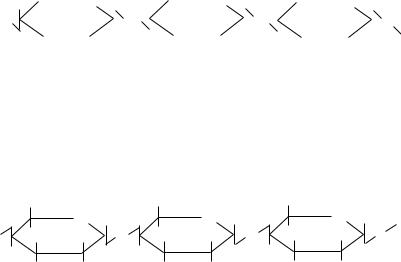
Внутри цепи и между параллельными цепями образуются водородные связи, что обеспечивает высокую механическую прочность, волокнистость, нерастворимость целлюлозы в воде.
Как O-гликозид целлюлоза способна к кислотному гидролизу с образованием глюкозы.
В человеческом организме нет фермента, расщепляющего β-гликозидные связи целлюлозы, поэтому она не усваивается организмом, но является необходимым компонентом пищи, т.к. улучшает пищеварение.
Целлюлоза является важным сырьем в бумажной и текстильной промышленности. Большое практическое применение
183
находят эфиры целлюлозы – ацетаты (искусственный шелк), ксантогенаты (вискоза, целлофан), нитраты (смесь моно- и динитратов – коллоксилин в виде спирто-эфирного раствора используется для заклеивания мелких ранок и ссадин; тринитрат является взрывчатым веществом).
В животных организмах опорные и механические функции выполняет хитин (роговые оболочки насекомых, панцири ракообразных). Хитин построен из остатков N-ацетилглюкозамина, связанных β-1,4-гликозидными связями:
CH OH |
|
|
|
|
|
CH2OH |
CH OH |
||||||||||||||||||
|
2 |
O |
β-1,4 |
|
|
|
|
O |
|
|
|
2 |
O |
||||||||||||
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|||||||||||
|
|
|
OH |
O |
|
|
|
|
O |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
NHCOCH |
3 |
|
|
|
NHCOCH3 |
|
|
|
NHCOCH3 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хитин
К гомополисахаридам относятся также пектины. В основе их структуры лежит пектовая (полигалактуроновая) кислота. Остатки галактуроновой кислоты связаны α-1,4-гликозидными свя-
зями: |
COOH |
COOH |
|
COOH |
|
|
O |
|
O |
|
O |
|
OH |
O OH |
O |
OH |
O |
|
OH |
|
OH |
|
OH |
|
|
Пектовая кислота |
|
|
|
В состав пектинов полигалактуроновая кислота может входить в виде сложных эфиров по карбоксильной группе и солей.
Пектины содержатся в овощах и плодах, для них характерно желеобразование под действием органических кислот, что используется в пищевой промышленности (желе, мармелад). Пектины обладают противоязвенным действием (препарат «Плантаглюцид» содержит пектины подорожника).
Гетерополисахариды. К гетерополисахаридам принадлежат полисахариды соединительной ткани – хондроитинсульфаты (содержатся в коже, хрящах), гиалуроновая кислота (в стекловидном теле, суставной жидкости, хрящах) гепарин (в печени).
В строении гетерополисахаридов есть общие черты – их молекулы линейны и состоят из повторяющихся дисахаридных фрагментов, в состав которых входят остатки уроновых кислот
184

(глюкуроновая, галактуроновая) и N-ацетилгексозаминов (N-ацетилглюкозамин, N-ацетилгалактозамин).
Хондроитинсульфаты состоят из дисахаридных остатков N-ацетилированного хондрозина, соединенных β-1,4-глико-
зидными связями. Сам |
хондрозин состоит из |
остатков |
||||||||||||||||
D-глюкуроновой кислоты |
и |
D-галактозамина, |
связанных |
|||||||||||||||
β-1,3-гликозидной связью: |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
COOH |
HO |
|
CH2OH |
|
|||||||||||||
|
|
|
|
O |
1 |
|
|
|
|
|
O OH |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
O |
|
|
|
|
3 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
HO |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
OH |
β-1,3 |
|
|
|
|
|
NHCOCH3 |
|
||||||
D-глюкуроновая |
|
|
|
N-ацетил-D- |
|
|||||||||||||
кислота |
|
|
|
галактозамин |
|
|||||||||||||
N-ацетилхондрозин
Хондроитинсульфаты являются эфирами серной кислоты.
Сульфатная |
группа присутствует в 4-м |
или 6-м положении |
|||||||||||||||||||||||||||||
N-ацетилгалактозамина. Соответственно различают хондроитин- |
|||||||||||||||||||||||||||||||
4-сульфат и хондроитин-6-сульфат. |
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
COOH |
HO3SO |
CH2OH |
COOH |
HO3SO |
CH2OH |
|||||||||||||||||||||||||
|
|
|
|
O |
|
|
|
|
O β-1,4 |
|
|
|
|
|
O |
|
|
O |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
OH |
|
O |
|
|
|
|
|
O |
|||||
|
|
|
|
|
O |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
β-1,3 |
|
|
|
NHCOCH3 |
|
|
|
|
OH |
β-1,3 |
|
|
NHCOCH3 |
|||||||||||||
Хондроитин-4-сульфат
Хондроитинсульфатные цепи соединены O-гликозидными связями с гидроксильными группами аминокислотных остатков белков.
Гиалуроновая кислота построена из дисахаридных фрагментов, связанных β-1,4-гликозидными связями. Дисахаридный фрагмент состоит из остатков D-глюкуроновой кислоты и N- ацетил-D-глюкозамина, связанных β-1,3-гликозидной связью.
|
COOH |
|
CH2OH |
|
|
COOH |
CH OH |
||||||||||||||||||||||||||||
|
|
|
|
O |
1 |
|
|
|
|
|
O |
|
β-1,4 |
|
|
|
|
O 1 |
|
|
|
2 |
O |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
OH |
|
|
|
|
|
3 |
|
|
|
|
O |
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
O |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
O HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O HO |
|
|
3 |
|
|
|
|
|
||
|
|
|
|
OH |
|
|
|
|
NHCOCH3 |
|
|
|
|
OH |
|
|
|
|
NHCOCH3 |
||||||||||||||||
D-глюкуроновая β-1,3 |
N-ацетил-D- |
|
|
|
|
|
|
|
|
|
β-1,3 |
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
кислота |
глюкозамин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Гиалуроновая кислота
185

Гиалуроновая кислота имеет высокую молекулярную массу (2-7 млн.). Ее растворы обладают высокой вязкостью, с чем связывают ее функции по обеспечению непроницаемости соединительной ткани для патогенных микроорганизмов.
Хондроитинсульфаты и гиалуроновая кислота содержатся в организме в связанном виде с полипептидными цепями. Углеводсодержащие смешанные биополимеры составляют основу клеток и жидкостей животных организмов. Если в молекуле биополимера преобладает полисахаридная часть, его относят к протеогликанам, если полипептидная часть – к гликопротеинам.
ПРИРОДНЫЕ α-АМИНОКИСЛОТЫ. ПЕПТИДЫ, БЕЛКИ
α-Аминокислоты являются мономерными единицами биополимеров – пептидов и белков. Белки – основа всего живого. Функции белков в природе многообразны. Это ферменты и гормоны, выполняющие регуляторную функцию, структурные белки (кератин, коллаген), транспортные (гемоглобин), защитные (иммуноглобулины). Некоторые аминокислоты используются как лекарственные средства, например, глутаминовая кислота – при заболеваниях ЦНС, метионин – для лечения заболеваний печени, цистеин – как радиопротектор, а также в глазной практике.
В природе в свободном и связанном виде обнаружены сотни аминокислот, 20-25 из них постоянно встречаются во всех белках.
Строение и классификация природных α-аминокислот
Общая формула α-аминокислот (исключение – пролин и ок-
сипролин):
R-CH-COOH
NH2
В основном используют тривиальные названия α- аминокислот. В биохимии часто пользуются сокращенными трехбуквенными названиями.
Согласно общей формуле, аминокислоты отличаются лишь строением радикала, в соответствии с чем они классифицируются на алифатические, ароматические и гетероциклические. Среди алифатических аминокислот в зависимости от наличия в радика-
186

ле функциональной группы выделяют подгруппы гидрокси- и серосодержащих аминокислот.
Примеры алифатических аминокислот:
CH2-COOH |
CH3 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||
NH2 |
CH-CH |
-CH-COOH |
|||||||||
Глицин |
|||||||||||
|
|
|
|
|
|
CH3 |
2 |
|
|
Лейцин * |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
CH3- |
|
CH-COOH |
|
NH2 |
|||||||
|
|
|
|
||||||||
|
Аланин |
|
|
|
|
||||||
|
|
|
|
|
|||||||
|
|
|
|
NH2 |
|
|
|
|
|||
CH3 |
|
|
CH3-CH2-CH-CH-COOH |
||||||||
|
|
CH-CH-COOH |
CH3 NH2 |
Изолейцин * |
|||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||
CH3 |
|
|
|
|
Валин * |
|
|
|
|
||
|
|
NH2 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||
CH2-CH-COOH
Серин
OH NH2
CH2-CH-COOH
SH NH2 Цистеин
CH3-S-CH2-CH2-CH-COOH
NH2 Метионин
HOOC-CH 2-CH-COOH
NH2
Аспарагиновая кислота
H2NOC-CH 2-CH-COOH
NH2
Аспарагин (Асн )
H2N-CH2-CH2-CH2-CH-COOH
Орнитин |
NH2 |
|
H2N-CH2-CH2-CH2-CH2-CH-COOH |
||
|
|
|
Лизин* |
NH2 |
|
CH3-CH-CH-COOH
Треонин *
OH NH2
CH2-CH-COOH
SNH2
Цистин (Цис-S-S-Цис)
S NH2
CH2-CH-COOH
HOOC-CH2-CH2-CH-COOH
NH2
Глютаминовая кислота
H2NOC-CH 2-CH2-CH-COOH
NH2
Глютамин (Глн )
H2N-C-NH-CH 2-CH2-CH2-CH-COOH
NH |
NH2 |
Аргинин
187
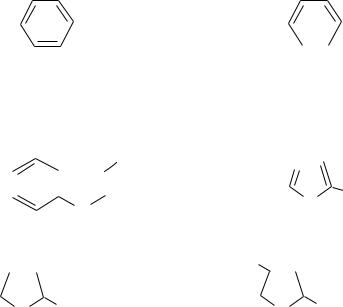
Примерами ароматических аминокислот являются фенилаланин и тирозин:
|
|
CH2- |
|
CH-COOH |
HO |
|
|
|
|
|
|
|
CH2- |
|
CH-COOH |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
||||||||||||
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
NH2 |
Фенилаланин * |
|
|
|
|
|
|
|
Тирозин |
|||||||
К гетероциклическим аминокислотам относятся:
|
|
|
|
|
|
CH2- |
|
CH-COOH |
|
|
N |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
N |
|
CH2-CH-COOH |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
||||
|
|
|
|
H |
Триптофан |
|
|
|
|
|
|
Гистидин |
||||||
|
|
|
|
|
|
|
|
|
* |
HO |
|
|
|
|
|
|
|
|
|
N |
COOH |
|
|
|
|
N |
|
|
|
COOH |
|
||||||
|
|
|
|
Пролин |
|
|
|
|
|
Оксипролин (Про-OH ) |
||||||||
|
H |
|
|
|
|
H |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В зависимости от соотношения количества карбоксильных и аминогрупп в молекулах различают нейтральные (моноаминомонокарбоновые) – глицин, аланин и др., кислые (моноаминодикарбоновые) – аспарагиновая, глютаминовая кислоты, основные (диаминомонокарбоновые) аминокислоты – лизин, орнитин, аргинин.
Природа радикала в молекулах аминокислот значительно влияет на свойства белков. Например, наличие полярных групп (-SH, NH2, -OH, COOH, фенольного гидроксила) увеличивает растворимость белков. Кроме того, эти группы принимают участие в образовании связей, формирующих пространственную структуру белка. За счет карбоксильной и аминогруппы многие ферменты обеспечивают кислотный или основный катализ ряда биохимических процессов.
Большинство α-аминокислот синтезируется в организме, но некоторые организм не способен синтезировать, они должны поступать с пищей. Эти аминокислоты называют незаменимыми, в норме их восемь: валин, лейцин, изолейцин, треонин, метилнин, фенилаланин, триптофан, лизин. При некоторых заболеваниях незаменимых аминокислот больше. Так, фенилкетонурия (пиро-
188

виноградная олигофрения) представляет собой врожденное нарушение обмена веществ, каким-то образом связанное с некоторыми умственными расстройствами. Люди, страдающие этим заболеванием, нуждаются еще в одной незаменимой для них аминокислоте – тирозине, т.к. в отличие от здоровых людей их организм не способен превращать фенилаланин в тирозин.
Стереоизомерия α-аминокислот
Все α-аминокислоты, за исключением глицина, имеют в своей структуре хотя бы один хиральный центр, значит, для них характерна оптическая изомерия. Например, аланин существует в виде пары энантиомеров:
* |
|
COOH |
COOH |
||||||
CH3- |
|
CH-COOH |
|||||||
|
|
|
|
|
|
|
|||
|
|
NH2 |
аланин |
|
|
NH2 H2N |
|
|
H |
|
|
|
H |
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
CH3 |
||||
|
|
|
|
D-аланин |
L-аланин |
||||
Относительная конфигурация стереоизомеров определяется в сравнении с конфигурационным стандартом – стереоизомерами глицеринового альдегида.
Все α-аминокислоты, участвующие в построении молекул белков животных и человека, имеют L-конфигурацию. D-ами- нокислоты встречаются в некоторых грибах и микроорганизмах.
α-Аминокислоты представляют собой кристаллические вещества с высокой температурой плавления, растворимые в воде, но не растворимые в неполярных растворителях. Эти свойства результат того, что и в кристаллическом состоянии, и в водных растворах аминокислоты существуют в виде биполярных ионов (цвиттер-ионов). Возможность образования биполярных ионов связана с амфотерностью аминокислот, в молекулах которых
присутствуют и кислотные |
|
COOH-группы, и основные |
|||||
NH2-группы. Близость этих групп у α-аминокислот облегчает пе- |
|||||||
реход протона H+: |
R- |
CH-COOH |
|
|
|
R-CH-COO - |
|
|
|
|
|
||||
|
|
|
+ |
|
|||
|
NH2 |
||||||
|
|
||||||
|
|
|
|
NH3 |
|||
189

Практически α-аминокислоты в водном растворе существуют в виде равновесной смеси из цвиттер-ионов, катионной и ани-
онной форм: |
|
OH - |
+ |
|
|
H+ |
+ |
|
||
H2N-CH-COO - |
|
|
|
|
||||||
|
|
|
H N-CH-COO |
- |
|
H N-CH-COOH |
||||
|
|
|
|
|||||||
|
|
|
H+ |
3 |
|
|
OH - |
3 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||
R |
|
|
|
R |
|
|
R |
|||
анион |
|
|
|
биполярный ион |
|
|
катион |
|||
Положение такого равновесия существенно зависит от pH среды: в сильнокислой среде (pH=1-2) преобладает катионная форма, в сильнощелочной (pH=13-14) – анионная.
Если поместить раствор аминокислоты в электрическое поле, то в кислых растворах она будет мигрировать к катоду, а в щелочных – к аноду. При некотором значении pH, характерном для данной аминокислоты, она не будет перемещаться в электрическом поле. При этом значении pH, называемом изоэлектриче- ской точкой (ИЭТ, pI), аминокислота существует в виде биполярного иона и в целом электронейтральна. Итак, изоэлектриче-
ская точка аминокислоты – это то значение pH раствора, при котором большинство молекул данной аминокислоты суще- ствуют в виде биполярных ионов, а концентрации анионной и катионной форм минимальны и равны. Изоэлектрическая точка зависит от соотношения кислотных и основных групп в молекуле: pI кислых аминокислот имеет значение <7, pI основных аминокислот >7.
При пропускании электрического тока через раствор, содержащий смесь аминокислот, каждая из них будет двигаться к катоду или аноду со скоростью, зависящей от природы аминокислоты и pH среды. Это явление используют для разделения и анализа смеси аминокислот методом электрофореза.
Химические свойства
Являясь амфотерными соединениями, аминокислоты реаги-
руют и с кислотами, и с щелочами: |
|
HCl |
|
|
R-CH-COOH |
|||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
NH Cl - |
|||
|
|
|
|
|
|
|
3 |
|||
R-CH-COOH |
|
|
гидрохлорид α−аминокислоты |
|||||||
|
|
|
|
|
||||||
|
|
|
|
NaOH |
|
|
|
|
||
NH2 |
|
R- |
|
CH-COONa + H 2O |
||||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|||
|
|
|
|
|
|
натриевая соль α−аминокислоты |
||||
190
