
Яцюк, Зубкова _Основы биоорганической химии
.pdf
Специфическим свойством щавелевой и малоновой кислот является их способность к декарбоксилированию при нагревании:
O |
O |
|
|
O |
|
|||
C-C |
|
to |
H-C |
+ CO2 |
|
|||
|
|
|
|
|
||||
HO |
OH |
|
|
OH |
|
|||
щавелевая |
муравьиная |
|
||||||
кислота |
|
O |
кислота |
|
||||
O |
|
to |
O |
|
||||
C-CH2-C |
|
|
|
CH3-C |
+ CO 2 |
|||
|
|
|
||||||
HO |
|
OH |
|
|
OH |
|
||
малоновая кислота |
|
|
уксусная |
|
||||
|
|
|
|
|
|
|
кислота |
|
Реакция декарбоксилирования характерна для дикарбоновых кислот, у которых две карбоксильные группы оказывают друг на друга наиболее сильное влияние.
Янтарная, глутаровая и малеиновая кислоты при нагревании образуют циклические ангидриды. Это связано, во-первых, с тем, что при нагревании их молекулы принимают клешневидную конформацию, и две карбоксильные группы оказываются пространственно сближенными, а во-вторых, с тем, что образуются пятиили шестичленные циклы, которые являются наиболее стабильными.
|
O |
|
|
|
|
|
O |
||
|
|
|
|
|
|
|
|
||
H2C |
C |
|
|
|
H2C |
C |
|
|
|
OH |
|
to |
|
|
|
O + H2O |
|||
H2C |
OH |
|
|
|
H2C |
C |
|||
|
|
|
|
|
|||||
|
C |
|
|
|
|
|
O |
||
|
O |
|
|
|
янтарный ангидрид |
||||
янтарная кислота |
|
|
|
|
|
|
|
||
|
O |
|
|
|
|
|
|
O |
|
|
CH2-C |
|
to |
H2 C |
|
C |
|||
|
|
|
|||||||
|
OH |
|
|
|
O + H2O |
||||
H C |
|
|
|
H2C |
|
||||
OH |
|
|
|
|
|||||
2 |
|
|
|
|
H2 C |
|
C |
||
|
CH2-C |
|
|
|
|
|
|||
|
|
|
|
|
|
|
O |
||
|
O |
|
|
|
|
|
|
||
|
|
|
|
глютаровый ангидрид |
|||||
глютаровая кислота
101

Медико-биологическое значение карбоновых кислот и их производных
Соли уксусной кислоты применяются в медицине. Ацетат калия (CH3COOK) – диуретическое средство; ацетат свинца ((CH3COO)2Pb . 3 H2O) – вяжущее средство, применяется при воспалительных воспалениях кожи и слизистых оболочек.
Изовалериановая кислота (CH3)2CHCH2COOH входит в со-
став валидола, присутствует в настойке валерианы. Оказывает успокаивающее действие.
Бензоат натрия C6H5COONa применяется как отхаркивающее средство.
Сложные эфиры карбоновых кислот широко распространены в природе. Жиры являются сложными эфирами высших карбоновых кислот и спирта глицерина. Запах плодов и цветов в значительной степени обусловлен присутствием сложных эфиров.
Некоторые лекарственные средства химически модифицируют, получая их сложные эфиры (так называемые «пролекарства»). Этерификация приводит к снижению или исчезновению некоторых отрицательных свойств исходных лекарств (горький вкус, раздражающее действие в месте инъекции). В организме под действием ферментов эстераз происходит гидролиз сложных эфиров с выделением исходного лекарственного соединения. Например, в отличие от левомицетина его стеарат не обладает горьким вкусом, что дало возможность применять его в педиатрической практике. В организме левомицетина стеарат гидролизуется до свободного левомицетина:
O |
N- |
|
|
|
|
|
|
|
|
|
|
NH-CO-CHCl2 |
|
|
|
|
гидролиз |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
-CH-CH-CH |
-O-C-(CH |
) |
-CH |
|||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
2 |
|
16 |
|
3 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
O |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
левомицетина стеарат |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH-CO-CHCl2 |
|
|
|
|||||
|
|
|
|
|
O2N- |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
-CH-CH-CH 2-OH |
|
+ |
C17 H35 COOH |
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
стеариновая кислота |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
левомицетин |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
102

ГЕТЕРОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ АЛИФАТИЧЕСКОГО РЯДА – МЕТАБОЛИТЫ И БИОРЕГУЛЯТОРЫ
Большинство органических веществ, участвующих в процессах метаболизма, относятся к гетерофункциональным соединениям, т.е. имеющим в структуре несколько различных функциональных групп. Наиболее распространенными гетерофункциональными соединениями являются аминоспирты, аминокислоты, оксикислоты и оксокислоты.
Химические свойства гетерофункциональных соединений нельзя рассматривать как сумму свойств, обусловленных наличием каждой функциональной группы. Так как функциональные группы влияют друг на друга, то у гетерофункциональных соединений появляются и специфические химические свойства.
Аминоспирты
Аминоспиртами называют соединения, содержащие одновременно амино- и окси-группы.
Простейшим представителем аминоспиртов является 2- аминоэтанол, или коламин: CH2-CH2.
OH NH2
Как амин коламин образует соли с сильными кислотами:
CH -CH |
|
+ HCl |
|
CH -CH |
|
Cl - |
||||
|
|
|
||||||||
|
2 |
|
2 |
|
|
|
2 + |
|
2 |
|
|
|
|
|
|||||||
OH NH2 |
|
|
OH NH3 |
|
||||||
коламина гидрохлорид
Основные свойства его понижены по сравнению с алифатическими аминами, т.к. OH-группа является электроноакцепторным заместителем.
Коламин проявляет нуклеофильные свойства за счет неподеленной электронной пары азота и подвергается реакции алки-
лирования: |
|
3 CH3I |
|
|
|
+ CH3 |
||||
|
|
|
|
|
|
|
||||
|
|
CH2 |
-CH2 |
|
|
CH2 |
-CH2-N-CH3 OH - |
|||
|
|
OH |
- |
|
|
|||||
|
|
|
||||||||
|
||||||||||
OH NH2 |
OH |
CH3 |
||||||||
|
|
|||||||||
холин
103
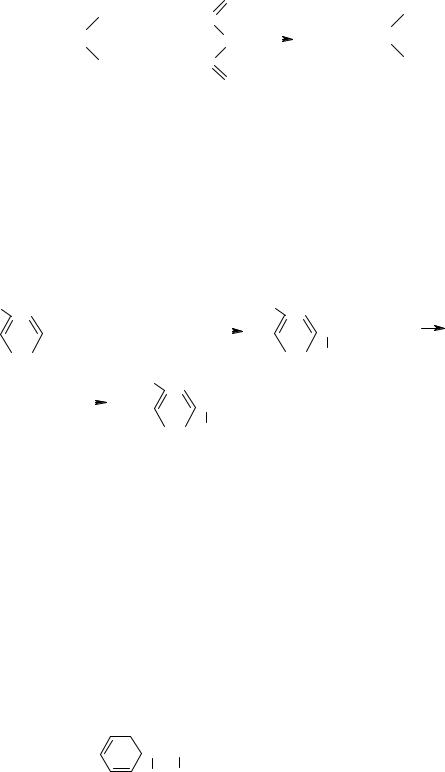
В результате реакции образуется другой аминоспирт – холин. Коламин и холин участвуют в построении молекул фосфолипидов – основных компонентов клеточных мембран (см.
стр. 225).
За счет наличия гидроксильной группы холин способен к реакциям ацилирования:
|
|
|
|
O |
|
|
|
|
|
|
|
+ |
CH3 |
CH3-C |
+ |
CH3 |
|||||||
|
|
CH2-CH2-N-CH 3 + |
O |
|
|
|
CH2-CH2-N-CH 3 |
||||
|
|
|
|||||||||
|
|
|
|
||||||||
|
|||||||||||
OH |
CH3 |
CH3-C |
|
O-C |
-CH 3 |
CH3 |
|||||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
холин |
|
|
|
|
O |
|
|||
|
|
|
|
|
|
|
|
||||
ацетилхолин
(в организме этот процесс осуществляется с участием ацетилкоэнзима А). Ацетилхолин является нейромедиатором.
Важную роль в организме играют аминоспирты, содержащие в качестве структурного фрагмента остаток пирокатехина. Их общее название катехоламины. Катехоламины синтезируются в организме из фенилаланина через образование дофамина:
HO |
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
HO- |
|
|
|
-CH2-CH2-NH2 |
окисление HO- |
|
|
|
-CH-CH2-NH2 |
||||||
|
|
|
|
|
дофамин |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
метилирование |
HO |
|
|
|
|
норадреналин |
||||||||
|
|
|
|
-CH-CH2-NH-CH3 |
|||||||||||
|
|
|
|||||||||||||
|
|
|
|
|
|
|
HO- |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
адреналин |
|
|
|
|
|
Адреналин является гормоном надпочечников, участвует в регуляции сердечной деятельности, обмена углеводов. При стрессах он выделяется в кровь, его называют «гормоном страха».
Структурно близки катехоламинам некоторые природные и синтетические биологически активные вещества, применяемые в качестве лекарственных средств. Так, алкалоид эфедрин обладает сосудосуживающим действием, расширяет бронхи, повышает артериальное давление. Его используют в виде гидрохлорида при бронхиальной астме, для уменьшения воспалительных процессов
при ринитах.
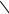 -CH-CH-NH-CH 3
-CH-CH-NH-CH 3
OH CH3
эфедрин
104

Аминокислоты
Аминокислоты – гетерофункциональные соединения, содержащие амино- и карбоксильную группу. По их взаимному расположению аминокислоты классифицируют на α-, β-, γ-, δ-, ε- аминокислоты. Например:
CH3- |
CH-COOH |
CH3- |
CH-CH2-COOH |
|
|
||
|
|
|
|
NH2 |
NH2 |
||
α-аминопропионовая кислота |
β-аминомасляная кислота |
||
2-аминопропановая кислота |
3-аминобутановая кислота |
||
Аминокислоты обладают всеми свойствами карбоновых кислот - они способны образовывать соли, сложные эфиры и другие функциональные производные:
|
|
|
|
NaOH |
CH3 |
- |
CH-COONa + H 2O |
||
|
|
|
|
|
|||||
|
|
|
|
|
|||||
|
|
|
|
|
|
NH2 |
|
||
CH3- |
CH-COOH |
|
|
|
натриевая соль |
|
|||
|
|
|
|
||||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
CH3OH |
|
|
|
|
|
|
|
|
|
|
CH3-CH-COOCH |
3 + H2O |
||||
|
|
|
|
|
|||||
|
|
|
|
H+ |
|||||
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
метиловый эфир |
||||
Аминокислоты проявляют также свойства аминов (основные свойства, способность к реакциям ацилирования и алкилирования):
HCl |
CH3 |
-CH-COOH |
||
|
||||
|
+ |
|
NH3 Cl- |
|
|
|
|
||
|
|
|
||
гидрохлорид
(CH3CO)2O
CH3-CH-COOH 
 CH3-CH-COOH + CH 3-COOH
CH3-CH-COOH + CH 3-COOH
NH2 |
|
|
NH-C-CH |
3 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
||
|
|
N-ацетильное производное |
|||||||
|
CH3I |
|
CH3 |
- |
|
CH-COOH + HI |
|||
|
|
|
|
||||||
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
NH-CH3
N-метильное производное
105

Амфотерность аминокислот приводит к тому, что они могут существовать в виде внутренних солей:
CH3- |
CH-COOH |
|
|
|
CH3- |
CH-COO - |
|
|
|
||||||
|
|
|
|||||
|
|
|
|
|
|||
|
|
+ |
|
||||
NH2 |
|||||||
|
|||||||
|
|
|
NH3 |
||||
|
|
|
|
|
внутренняя соль |
||
Специфические свойства аминокислот зависят от взаимного расположения амино- и карбоксильной групп.
α-Аминокислоты вступают в реакции декарбоксилирования при нагревании с гидроксидом бария с образованием соответствующих аминов, например:
CH3-CH-COOH  CH3-CH2-NH2 + BaCO3 + H2O
CH3-CH2-NH2 + BaCO3 + H2O
этиламин
NH2
α-аминопропионовая кислота
Сходным образом декарбоксилирование природных α- аминокислот протекает и in vivo с участием ферментов, например, при декарбоксилировании серина образуется коламин:
CH -CH-COOH |
фермент |
CH -CH |
|
+ CO |
|
|||||||
|
|
|
||||||||||
|
|
2 |
|
|
|
|
2 |
|
|
2 |
|
2 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
OH NH2 |
OH |
NH2 |
|
|
||||||||
|
|
серин |
коламин |
|
|
|||||||
Другим специфическим свойством α-аминокислот является их способность к образованию межмолекулярных циклических амидов (дикетопиперазинов):
|
O |
|
|
|
|
O |
CH3-CH-C |
|
CH3-HC |
|
C |
||
|
|
|||||
HN |
OH |
to |
|
NH + 2 H2O |
||
H |
+ H |
|
HN |
|
||
|
||||||
HO |
NH |
|
C |
|
|
CH-CH3 |
|
C-CH-CH3 |
|
|
|
||
|
|
O |
|
|
||
O |
|
|
|
|
||
|
|
дикетопиперазин |
||||
|
|
|
||||
Так как дикетопиперазины фактически являются амидами, они способны к гидролизу и в кислой, и в щелочной среде.
Характерной особенностью β-аминокислот являются реакции внутримолекулярного элиминирования: при нагревании они отщепляют молекулу аммиака. Например, при нагревании
106
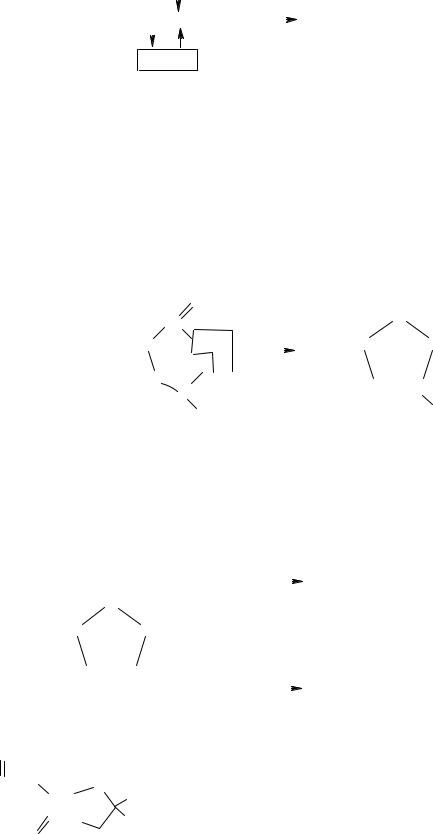
β-аминомасляной кислоты образуется кротоновая (бутен-2-овая) |
||||||
кислота: |
|
|
H |
|
|
|
|
|
|
|
|
||
|
|
|
|
α |
to |
|
|
|
|
|
|||
|
CH3- |
|
CH-C-COOH |
|
CH3-CH=CH-COOH + NH 3 |
|
|
|
|||||
|
|
|
||||
NH2 H
Способность к этой реакции связана с подвижностью протона водорода при α-углеродном атоме из-за электроноакцепторного влияния двух функциональных групп.
За счет существования молекул γ-аминокислот в клешневидной конформации функциональные группы оказываются пространственно сближенными, и между ними может происходить взаимодействие с образованием циклического внутримолекуляр-
ного амида (лактама): |
|
O |
|
|
|
O |
||||
|
|
|
|
|
|
|
|
|
|
|
α |
C |
|
|
|
|
|
C |
|||
|
|
to |
|
|
|
|
|
|||
|
|
OH |
|
|
|
|
|
|||
H2C |
|
|
H2C |
|
|
|
NH + H2O |
|||
|
γ |
NH |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
H2C |
|
H |
|
|
H2C |
|
|
|
CH |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||
|
|
CH |
|
|
|
|
|
|||
|
|
|
CH |
|
|
|
|
|
|
CH3 |
|
|
|
3 |
|
|
|
|
|
|
|
γ -аминовалериановая кислота |
γ -валеролактам |
|||||||||
Пятичленные циклы устойчивы, поэтому реакция протекает достаточно легко.
Как амиды лактамы подвергаются гидролизу и в кислой, и в щелочной среде:
|
O |
|
|
|
H2O, HCl |
+ |
|
|||
|
|
|
|
|
|
|
|
|
H3N-CH2-CH2-CH2-COOH |
|
|
|
|
|
|
|
|
|
|
||
|
C |
|
|
|
|
|
Cl |
- |
||
|
|
|
|
|
|
|
|
|
|
|
H2C |
NH |
|
|
|
|
γ -аминомасляной кислоты |
||||
|
|
|
|
гидрохлорид |
||||||
|
|
|
|
|
|
|
|
|
||
H2C |
|
|
|
CH2 |
|
|
NaOH, H2O |
H2N-CH2-CH2-CH2-COONa |
||
|
|
|
||||||||
γ -бутиролактам |
|
|
|
|
||||||
|
|
|
|
натриевая соль γ -аминомасляной |
||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
кислоты |
|
O
R-C-NH |
S |
CH3 |
|||||
|
|
|
|
|
|
||
|
|
N |
|
|
CH3 |
||
|
|
|
|
||||
|
|
|
|
||||
O |
|
|
|
||||
COOH |
|||||||
|
|
|
|
||||
пенициллины |
|
||||||
Некоторые природные соединения и синтетические лекарственные средства содержат в своей структуре лактамный цикл. Например, четырехчленный β-лактамный цикл присутствует в молекулах пенициллинов.
107

Из-за его способности к гидролизу, что приводит к потере биологической активности, пенициллины не стерилизуют в водных растворах.
Гидроксикислоты (оксикислоты)
Примерами гидроксикислот являются:
CH3- |
CH-COOH |
CH3- |
CH-CH2-COOH |
|
|
||
|
|
|
|
OH |
OH |
||
2-гидроксипропановая кислота |
3-гидроксибутановая кислота |
||
α-оксипропионовая кислота |
β-оксимасляная кислота |
||
молочная кислота |
|
|
|
Для гидроксикислот характерны свойства карбоновых кислот и спиртов. Как карбоновые кислоты они образуют соли и
сложные эфиры: NaOH
 CH3-CH-COONa + H 2O
CH3-CH-COONa + H 2O
|
|
|
|
|
OH |
CH3- |
CH-COOH |
|
|
|
лактат натрия |
|
|||||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
CH3OH |
||
|
|
|
|
||
молочная кислота |
|
|
|
CH3-CH-COOCH 3 + H2O |
|
|
|
|
|||
H+
OH
метиловый эфир молочной кислоты
Как спирты оксикислоты способны к реакциям окисления и ацилирования:
[O]
 CH3-C-COOH
CH3-C-COOH
O
CH3-CH-COOH 2-оксопропановая (пировиноградная) кислота
OH |
(CH3CO)2O |
|||||
молочная кислота |
||||||
|
|
CH3- |
|
CH-COOH + CH 3-COOH |
||
|
|
|
||||
|
|
O-C-CH 3 |
||||
|
|
|
|
|
|
|
|
|
|
|
O |
||
|
|
O-ацетильное производное |
||||
|
|
молочной кислоты |
||||
108
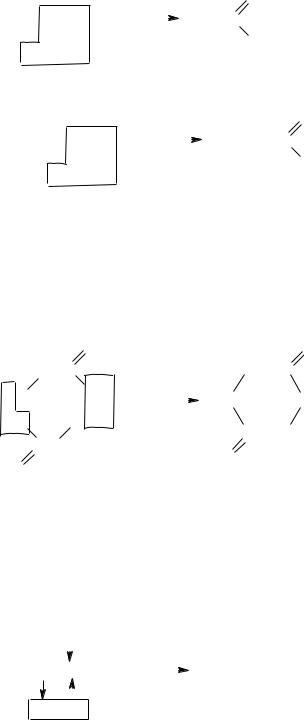
Специфические свойства α-оксикислот. α-Оксикислоты при нагревании в присутствии концентрированной серной кислоты разлагаются с образованием карбонильных соединений и муравьиной кислоты. Например:
|
|
|
|
|
c.H2SO4 |
|
O |
|
|
||
CH3 |
-CH-COOH |
|
CH3-C |
+ H-COOH |
|||||||
|
|
|
|||||||||
|
to |
|
|||||||||
|
|
|
|
|
|
|
H |
муравьиная |
|||
|
OH |
|
|||||||||
|
|
|
|
|
уксусный |
кислота |
|||||
|
|
|
|
|
|
|
|||||
молочная кислота |
альдегид |
|
|
||||||||
|
|
|
|
||||||||
|
|
|
|
|
|
c.H2SO4 |
|
O |
|
||
CH3-CH2 |
-CH-COOH |
CH3-CH2 |
-C |
+ H-COOH |
|||||||
|
|
||||||||||
to |
|
||||||||||
|
|
|
|
|
|
|
|
H |
муравьиная |
||
|
|
|
|
|
|
|
|||||
|
|
|
OH |
|
пропионовый |
кислота |
|||||
|
|
|
|
|
|
|
|
||||
альдегид
α-оксимасляная кислота
Другим специфическим свойством α-оксикислот является их способность к реакциям образования межмолекулярных циклических сложных эфиров – лактидов:
|
O |
|
|
|
|
O |
|
CH3 |
-CH-C |
|
CH3-HC |
|
C |
|
|
|
|
|
|||||
HO |
OH |
to |
|
|
+ 2 H O |
||
|
+ |
|
O |
|
O |
||
|
|
||||||
|
|
|
|
|
|
2 |
|
HO |
OH |
|
C |
|
|
CH-CH3 |
|
|
C-CH-CH3 |
|
|
|
|
||
|
|
O |
|
|
|
||
O |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
молочная кислота |
|
лактид молочной кислоты |
|||||
Лактиды способны к гидролизу и в кислой, и в щелочной среде.
Для β-оксикислот характерны реакции внутримолекулярного элиминирования, при нагревании они отщепляют воду:
H |
|
|
|
|
α |
to |
|
|
|||
CH3-CH-C-COOH |
|
CH3-CH=CH-COOH + H 2O |
|
|
|||
|
|
|
кротоновая (бутен-2- |
|
|
||
OH H |
|
овая) кислота |
|
β-оксимасляная кислота
109

γ-Оксикислоты способны к реакциям внутримолекулярной этерификации, приводящим к образованию циклических слож-
ных эфиров, например, |
|
|
|
|
O |
|||
|
|
|
|
|
||||
|
|
O |
|
|
|
|
|
|
α |
C |
|
|
C |
||||
|
|
|
||||||
|
to |
|
|
|
|
|
||
|
OH |
|
|
|
|
|
||
H2C |
|
H2C |
|
|
|
O + H2O |
||
|
OH |
|
|
|
|
|||
β |
γ |
|
|
|
|
|
|
|
H2C |
|
|
H C |
|
|
|
CH |
|
CH2 |
|
|
|
|
||||
|
|
|
|
|||||
|
|
2 |
2 |
|||||
|
|
|
|
|||||
γ -оксимасляная кислота |
γ -бутиролактон |
|||||||
Как сложные эфиры лактоны гидролизуются и в кислой, и в щелочной среде:
|
O |
|
H2O, H+ |
CH3- |
CH-CH2-CH2-COOH |
||||||
|
|
|
|
|
|
|
|
|
|||
|
C |
|
|
|
|
OH |
|||||
|
|
|
|
|
|
|
|
|
|
||
H2C |
|
|
|
O |
|
|
|
|
γ -оксивалериановая кислота |
||
|
|
|
|
|
|
|
|||||
H2C |
|
|
|
CH |
|
NaOH, H2O |
CH3 |
-CH-CH2-CH2-COONa |
|||
|
|
|
|||||||||
|
|
|
|
CH3 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
OH |
|||
γ -валеролактон |
|
|
|
|
|||||||
натриевая соль γ -оксивалериановой кислоты
Примерами многоосновных оксикислот являются яблочная (соли – малаты), винная (соли – тартраты) и лимонная (соли –
цитраты) кислоты: |
|
|
|
COOH |
||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HOOC-CH 2-C-CH 2-COOH |
||
HOOC- |
|
CH-CH2-COOH |
HOOC-CH-CH-COOH |
OH |
||||
|
|
|
|
лимонная кислота |
||||
|
|
|
|
|
|
|||
OH |
OH OH |
2-гидроксипропан- |
||||||
яблочная кислота |
винная кислота |
трикарбоновая кислота |
||||||
2-гидроксибутандиовая |
||||||||
2,3-дигидроксибутандиовая |
|
|
||||||
кислота |
|
|
||||||
кислота |
|
|
||||||
|
|
|
|
|
||||
Как дикарбоновая кислота, винная кислота дает два ряда солей – кислые и средние, причем кислая калиевая соль нерастворима в воде, а средняя – растворима.
110
