
Яцюк, Зубкова _Основы биоорганической химии
.pdf
Кислород с полным отрицательным зарядом проявляет положительный индуктивный эффект.
CH2 CH
CH CH3
CH3
В молекуле пропена углерод метильной группы sp3- гибридизован, а атомы углерода при двойной связи sp2- гибридизованы, т.е. более электроотрицательны. Поэтому метильная группа смещает электронную плотность от себя, проявляя положительный индуктивный эффект (+ICH3) .
Итак, индуктивный эффект может проявляться в любой молекуле, в которой есть разные по электроотрицательности атомы.
Мезомерный эффект – это передача электронного влияния заместителей в сопряжённых системах, посредством поляризации π-связей. Мезомерный эффект передаётся без затухания, т.к. π- связи поляризуются легко. Обратите внимание: мезомерным эффектом обладают только те заместители, которые сами являются частью сопряжённой системы. Например:
CH2=CH-CH=CH-NH2 |
Амино-группа является частью |
||||
p,π-сопряжённой системы. |
|
||||
p,π -сопряжённая система |
|
||||
|
|
|
|||
CH2=CH-CH=CH-CH2-NH2 |
Амино-группа не является ча- |
||||
стью сопряжённой |
системы. |
||||
π,π-сопряжённая система |
|||||
Мезомерный эффект отсутству- |
|||||
|
|
||||
|
|
ет. |
|
|
|
Мезомерный эффект может быть как положительный (+М), |
|||||
так и отрицательный (-М). |
|
|
|
||
|
В молекуле хлорвинила неподелённая электрон- |
||||
.. |
ная пара хлора участвует в p,π-сопряжении, |
т.е. |
|||
CH =CH-Cl |
|
|
|
|
|
2 |
вклад хлора в сопряжённую систему больше, чем |
||||
+M Cl |
|||||
у каждого из атомов углерода. Поэтому хлор про- |
|||||
являет положительный мезомерный эффект. |
|
|
|||
O |
Молекула акрилового альдегида |
– |
это |
||
CH2=CH-C |
π.π-сопряжённая система. Атом кислорода отдаёт |
||||
H |
|
|
|
|
|
-M CHO |
|
|
|
|
|
41

в сопряжение один электрон – столько же, как и каждый атом углерода, но при этом электроотрицательность кислорода выше, чем у углерода, поэтому кислород смещает электронную плотность сопряжённой системы на себя, альдегидная группа в целом проявляет отрицательный мезомерный эффект.
Итак, заместители, отдающие в сопряжение два электрона, обладают положительным мезомерным эффектом. К ним относятся:
а) заместители с полным отрицательным зарядом, например, –O-; б) заместители, в структуре которых есть атомы с неподелёнными электронными парами на pz-орбитали, например: -NH2, -OH, -F, -Cl, -Br-, -I, -OR (-OCH3, -OC2H5).
Заместители, смещающие электронную плотность по сопряжённой системе на себя, проявляют отрицательный мезомерный эффект. К ним относятся заместители, в структуре которых есть двойные связи, например:
O |
O |
O |
|
O |
C |
, C |
, S |
OH , |
N . |
H |
OH |
O |
|
O |
Заместитель может проявлять и индуктивный, и мезомерный эффекты одновременно. В некоторых случаях направление этих эффектов совпадает (например, -I и –M), в других – они действуют в противоположных направлениях (например, -I и +M). Как в этих случаях определить общее влияние заместителя на остальную часть молекулы (другими словами, как определить, является данный заместитель электронодонорным или электроно-
акцепторным)? Заместители, повышающие электронную плот- ность в остальной части молекулы, называют электронодонор- ными, а заместители, понижающие электронную плотность в остальной части молекулы, – электроноакцепторными.
Чтобы определить общее влияние заместителя, необходимо сравнить его электронные эффекты по величине. Если преобладает положительный по знаку эффект, заместитель является электронодонорным. Если преобладает отрицательный по знаку эффект, заместитель является электроноакцепторным. Нужно отметить, что, как правило, мезомерный эффект проявляется сильнее,
42
чем индуктивный (из-за большей способности π-связей к поляризации). Однако есть и исключения из этого правила: индуктивный эффект галогенов проявляется сильнее, чем мезомерный.
Рассмотрим конкретные примеры:
.. |
|
|
В |
этом соединении |
||
CH2=CH |
|
NH2 |
-I NH2 |
, +M NH2 |
; |+M| > |-I | аминогруппа являет- |
|
|
||||||
|
|
|
|
|
ся |
электронодонор- |
ным заместителем, т.к. её положительный мезомерный эффект проявляется сильнее, чем отрицательный индуктивный.
CH3-CH2 |
|
NH2 |
В этом соединении аминогруппа явля- |
|
-I NH2 ется электроноакцепторным заметите- |
||
|
лем, т.к. проявляет только отрицательный индуктивный эффект.
|
|
|
|
|
|
|
|
|
В молекуле фенола гидро- |
||
.. |
|
|
|
|
|
ксильная |
группа является |
||||
|
|
|
OH |
|
|
|
; |+M| > |-I | электронодонорным |
за- |
|||
|
|
|
|
-I |
OH |
, +M |
|||||
|
|
|
|
|
|
|
OH |
местителем из-за преобла- |
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
дания положительного ме- |
||
зомерного эффекта над отрицательным индуктивным. |
|
||||||||||
|
|
|
|
|
|
|
|
В |
молекуле бензилового |
спирта |
гидро- |
|
|
|
CH2 |
OH |
|||||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
-IOH |
ксильная группа не участвует в сопряжении |
|||
|
|
|
|
|
|
|
и проявляет только отрицательный индук- |
||||
тивный эффект. Поэтому она является электроноакцепторным заместителем.
Эти примеры показывают, что нельзя рассматривать влияние какого-либо заместителя вообще, а нужно рассматривать его влияние в конкретной молекуле.
Только галогены всегда являются электроноакцепторными заместителями, т.к. их отрицательный индуктивный эффект проявляется сильнее, чем положительный мезомерный. Например:
.. |
|
|
|
|
|
|
|
|
|
CH2 Cl |
|||
Cl |
|
|
|
|||
|
|
|
|
|
|
|
-ICl , +MCl |
; |+M| < |-I | |
|
|
|
|
-ICl |
|
|
|
|
|||
|
|
|
|
|
|
|
Атеперь вернёмся к реакциям электрофильного замещения
впроизводных бензола. Итак, мы выяснили, что заместитель, уже имеющийся в кольце, влияет на ход реакций электрофильного замещения. В чём же выражается это влияние?
43
Заместитель влияет на скорость реакций SE и на положе- ние второго заместителя, вводимого в кольцо. Рассмотрим оба этих аспекта влияния.
Влияние на скорость реакции. Чем выше электронная плотность в кольце, тем легче протекают реакции электрофильного замещения. Понятно, что электронодонорные заместители облегчают реакции SE (являются активаторами цикла), а электроноакцепторные заместители – затрудняют их (дезактивируют цикл). Поэтому реакции электрофильного замещения в производных бензола, содержащих электроноакцепторные заместители, проводят в более жёстких условиях.
Сравним активность фенола, толуола, бензола, хлорбензола
и нитробензола в реакции нитрования. |
|
O |
|
|
|
|
|
.. |
CH3 |
.. |
N |
OH |
Cl |
O |
|
|+M| > |-I | |
+I |
|+M| < |-I | |
-I , -M |
содержат электронодонорные |
|
||
содержат электроноакцепторные |
|||
заместители |
|
заместители |
|
Так как фенол и толуол содержат электронодонорные заместители, они более активны в реакциях SE, чем бензол. Наоборот, хлорбензол и нитробензол менее активны в этих реакциях, чем бензол, т.к. содержат электроноакцепторные заместители. Фенол активнее толуола из-за положительного мезомерного эффекта OH-группы. Хлор не такой сильный электроноакцепторный заместитель, как нитрогруппа, т.к. нитрогруппа проявляет и отрицательный индуктивный, и отрицательный мезомерный эффекты. Итак, в данном ряду активность в реакциях электрофильного замещения убывает от фенола к нитробензолу. Экспериментально установлено, что если скорость реакции нитрования бензола принять за 1, то этот ряд будет выглядеть так:
фенол толуол бензол хлорбензол нитробензол
скорость |
1000 |
24,5 |
1,0 |
0,033 |
0,0000001 |
нитрования |
44

Вторым аспектом влияния заместителя в ароматическом кольце на ход реакций электрофильного замещения является так называемое ориентирующее действие заместителей. Все замес-
тители можно подразделить на две группы: орто-, параориентанты (заместители 1 рода) и мета-ориентанты (заместители 2 рода).
К заместителям 1 рода относятся: -OH, -O-, -NH2, алкильные группы (-CH3, -C2H5 и т.д.) и галогены. Вы можете видеть, что все эти заместители проявляют положительный индуктивный эффект и (или) положительный мезомерный эффект. Все они, кроме галогенов, повышают электронную плотность в кольце, особенно в орто- и пара-положениях. Поэтому электрофил и направляется в эти положения. Рассмотрим это на примере фено-
ла: |
За счёт положительного |
мезомерного эффекта |
||
OH |
||||
: |
|
|
|
|
δ− |
гидроксильной группы происходит перераспреде- |
|||
δ− |
ление |
электронной плотности по сопряжённой |
||
δ− |
системе, и в орто- и пара-положениях она особен- |
|||
но повышена. |
|
|
||
|
|
|
||
При бромировании фенола образуется смесь орто- и пара- |
||||
бромфенола: |
OH |
OH |
|
OH |
|
: |
|
|
|
|
δ− |
Br |
|
+ HBr |
δ− |
|
+ Br2 |
+ |
|
|
|
|||
|
δ− |
o-бромфенол |
|
Br |
|
|
|
|
|
п-бромфенол
Если бромирование проводить в полярном растворителе (бромной водой) и использовать избыток брома, реакция протекает сразу по трём положениям:
OH |
|
|
OH |
|||||
|
|
+ 3 Br2 |
H2O |
Br |
|
|
|
Br |
|
|
|
|
|
||||
|
|
|
|
|
|
+ 3 HBr |
||
|
|
|
|
|
|
|
||
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
Br 2,4,6-трибромфенол
45
Заместителями 2 рода являются: -NH3+, -COOH, -CHO (альдегидная группа), -NO2, -SO3H. Все эти заместители понижают электронную плотность в ароматическом кольце, но из-за её перераспределения в мета-положениях она понижена не так сильно, как в орто- и пара-. Рассмотрим это на примере бензойной кислоты:
 O Карбоксильная группа проявляет отрицательный
O Карбоксильная группа проявляет отрицательный
Cиндуктивный и отрицательный мезомерный эффек-
|
OH |
δ− |
δ− |
|
ты. За счёт перераспределения по сопряжённой системе в мета-положениях электронная плотность остаётся более высокой, чем в орто- и пара-, поэтому электрофил будет атаковать мета-положения:
|
O |
|
O |
|
|
C |
|
||
|
|
C |
||
|
OH |
|
||
|
|
OH |
||
|
|
|
||
|
+ Cl2 |
FeCl3 |
+ HCl |
|
δ− |
to |
|||
δ− |
Cl |
|||
|
|
м-хлорбензойная кислота
Реакции электрофильного замещения в нафталине
Мы уже выяснили, что нафталин является ароматической системой. Однако электронная плотность в системе нафталина распределена не столь равномерно, как в бензо-
|
|
α |
|
α |
ле: она выше в α-положениях, поэтому реакции |
|
β |
|
|
|
|
β |
|
|
|
|
электрофильного замещения протекают именно |
|||
β |
|
|
|
|
β |
|
|
||||||
|
|
|
||||
|
|
α |
|
α |
по α-положениям. Например, при бромировании |
|
|
|
|
|
|
|
нафталина образуется α-бромнафталин: |
|
Br |
|
CH3COOH |
+ Br2 |
+ HBr |
|
α-бромнафталин |
46
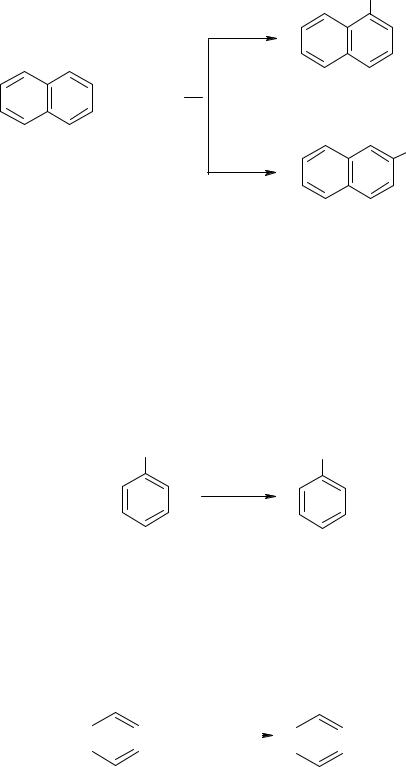
Реакция сульфирования нафталина может давать разные продукты в зависимости от условий: при более низкой температуре (80оС) образуется α-нафталинсульфокислота, а при температуре около 160оС – β-нафталинсульфокислота.
|
SO3H |
80oC |
+ H2O |
|
|
|
α-нафталинсульфокислота |
+ H2SO4 |
|
160oC |
SO3H |
|
+ H2O |
|
β-нафталинсульфокислота |
Реакции окисления гомологов бензола
Сам бензол очень устойчив к реакциям окисления. Однако его гомологи окисляются относительно легко по боковой цепи. В качестве окислителя обычно используют перманганат калия в кислой среде.
Например, при окислении толуола образуется бензойная кислота:
CH3 |
COOH |
|
KMnO4 |
|
to |
толуол |
бензойная кислота |
Обратите внимание, что и другие гомологи бензола (этилбензол, пропилбензол и т.д.) окисляются тоже в бензойную кислоту, т.е. окисление протекает по α-положению боковой цепи:
|
|
|
CH2-CH2-CH3 |
|
|
|
|
|
COOH |
|||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
KMnO4 |
|
|
|
|
|
+ CH3COOH |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
to |
|
|
|
|
|
|
|
пропилбензол |
бензойная кислота |
|||||||||||
47

ХИМИЧЕСКИЕ СВОЙСТВА ГАЛОГЕНАЛКАНОВ, СПИРТОВ И ФЕНОЛОВ
Функциональной группой галогеналканов является атом галогена (фтор, хлор, бром или иод). Отсюда первый признак их классификации – по природе галогена:
CH3-I CH3-CH2-Br
иодметан бромэтан
Другой вид классификации – по положению атома галогена (по характеру атома углерода, связанного с галогеном). Галогеналканы классифицируют на первичные, вторичные и третичные:
|
|
|
CH3 |
|
|
|
|
|
|
CH3-CH2-Cl |
CH3- |
CH-CH3 |
CH3-C-CH2-CH3 |
|
|
|
|
|
|
хлорэтан |
Br |
I |
||
(первичный |
2-бромпропан |
2-иод-2-метилбутан |
||
галогеналкан) |
(вторичный |
|||
|
галогеналкан) |
(третичный |
||
|
|
|
галогеналкан) |
|
Для названия галогеналканов используют радикалофункциональную (для несложных молекул) и заместительную номенклатуру IUPAC.
По радикало-функциональной номенклатуре название галогеналкана состоит из названия соответствуюшего углеводородного радикала и слова хлорид, бромид и т.п. Например:
CH3-CH2-Cl CH3-CH-CH3
этилхлорид Br
изопропилбромид
По заместительной номенклатуре галогеналкан рассматривают как производное соответствующего углеводорода. Наличие галогена обозначают префиксом (если их несколько, используют умножающие частицы ди-, три-, тетра-) и обозначают положение цифрой.
48

Например:
CH3 |
|
|
|
|
|
|
|
|
|
CH3-C-CH2-CH3 |
CH2-CH2 |
|||
|
|
|
|
|
Br |
Cl Cl |
|||
2-бром-2-метилбутан |
1,2-дихлорэтан |
|||
Для галогеналканов характерны реакции нуклеофильного замещения (SN). Это связано с распределением электронной плотности в молекуле.
δ+ |
δ− Хлор смещает электронную плотность на себя |
|
CH3-CH2 |
Cl |
вследствие более высокой электроотрицательности. |
|
|
|
На атоме углерода возникает частичный положительный заряд. Этот электронодефицитный углерод является электрофильным центром и может быть атакован каким-либо нуклеофилом.
С помощью реакций нуклеофильного замещения можно превратить галогеналканы в спирты, тиолы, амины, простые эфиры:
|
|
|
NH3 |
+ |
|
- |
|
|
|||||||
R-NH2 + HCl |
|
|
|
|
|
|
|
Na OH |
|
|
R-OH + NaCl |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
первичный |
|
|
|
|
|
|
|
|
|
|
|
|
спирт |
||
амин |
R'-NH2 |
|
|
|
|
|
H2O |
|
|
|
|
||||
R-NH-R' + HCl |
|
R-Cl |
|
|
|
|
|
|
R-OH + HCl |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
вторичный |
|
|
|
|
|
|
|
|
|
|
|
|
спирт |
||
|
|
|
|
|
|
|
|
- |
|
|
|
|
|||
амин |
Na HS |
|
+ |
|
|
||||||||||
R-SH + NaCl |
|
|
|
|
|
|
R'-O Na |
R-O-R' + NaCl |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
тиол |
|
|
|
|
|
|
|
|
|
|
|
|
простой |
||
|
|
|
|
|
|
|
|
|
|
|
|
эфир |
|||
(тиоспирт) |
|
|
|
|
|
|
|
|
|
|
|
|
|||
Общая схема реакции нуклеофильного замещения может быть представлена следующим образом:
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|||
R |
: X |
+ |
:Nu |
|
R : Nu |
+ : Х |
|
|
|
||||||
субстрат |
нуклеофил |
продукт |
уходящая |
||||
|
|
|
|
|
реакции |
группа |
|
Связь углерод-галоген разрывается гетеролитически. Новая связь образуется за счет электронной пары нуклеофила (нуклеофил замещает галоген в молекуле галогеналкана). Частица Х- уходит, унося электроны бывшей σ-связи. Эту частицу называют «уходящей группой». Реакции нулеофильного замещения часто бывают обратимыми, т.к. любая уходящая группа также является нуклеофилом. Чтобы сместить равновесие реакции вправо, необходимы «хороший» нуклеофил и «хорошая» уходящая группа.
49

«хороший» нуклеофил – это активный нуклеофил. Как же сравнить силу различных нуклеофилов?
1)Анионы более активные нуклеофилы, чем соответствующие ней-
тральные молекулы, т.к. анионы легче отдают электроны. Например, анион OH- является более сильным нуклеофилом, чем нейтральная молекула во-
ды H2O. Алкоголят-анион R-O- активнее, чем молекула спирта R-OH, тио- лят-анион R-S- активнее, чем молекула тиола R-SH.
2)Чем ниже электроотрицательность атома нуклеофильного центра, тем активнее нуклеофил, т.к. такой атом легче отдает электронную пару на
образование новой σ-связи. Поэтому молекула аммиака NH3 является более сильным нуклеофилом, чем молекула воды H2O (электроотрицательность азота ниже, чем кислорода).
«Хорошая» уходящая группа, наоборот, должна быть слабым нуклеофилом. Например, нейтральная молекула воды лучшая уходящая группа, чем гидроксид-анион. Анионы галогенов являются «хорошими» уходящими группами вследствие высокой электроотрицательности атомов галогена.
Реакции нуклеофильного замещения в галогеналканах могут конкурировать с реакциями отщепления (элиминирования).
Например, при нагревании галогеналкана с водным раствором щелочи протекает реакция нуклеофильного замещения:
CH3-CH2-Cl + NaOH |
H2O |
CH3-CH2-OH + NaCl (SN) |
|
to |
|||
хлорэтан |
этанол |
||
|
Если же в реакции использовать не водный, а спиртовой раствор щелочи, протекает реакция элиминирования с образованием соответствующего алкена:
CH3-CH2-Cl + NaOH |
спирт |
CH2=CH2 + NaCl + H2O (E) |
|
|
|||
to |
|||
хлорэтан |
этен |
||
|
Обратите внимание, что реакции элиминирования в галогеналканах и спиртах протекают по правилу Зайцева (см. стр. 56).
Медико-биологическое значение галогеналканов
Галогеналканы широко используются как алкилирующие реагенты в органическом синтезе, в том числе и при получении лекарственных веществ. Некоторые галогеналканы применяются в медицине.
50
