
Яцюк, Зубкова _Основы биоорганической химии
.pdf
Салицилат натрия используется при лечении ревматизма.
В медицине используются сложные эфиры салициловой кислоты по карбоксильной группе – метилсалицилат и фенилсалицилат. Метилсалицилат получают при взаимодействии салициловой кислоты с метиловым спиртом в присутствии концентрированной серной кислоты (обычные условия этерификации):
COOH |
|
COOCH3 |
OH |
H+ |
OH |
+ CH OH |
+ H2O |
|
3 |
|
|
салициловая |
|
метилсалицилат |
кислота |
|
|
|
|
Для получения фенилсалицилата карбоксильную группу салициловой кислоты предварительно активируют (фенолы не ацилируются карбоновыми кислотами из-за своей пониженной нуклеофильности):
COOH |
COCl |
|
COOC 6H5 |
|
|
||
OH |
OH |
C6H5OH |
OH |
|
PCl5 |
||
|
хлорангидрид |
|
фенилсалицилат |
|
салициловой |
|
|
|
кислоты |
|
|
Метилсалицилат оказывает противовоспалительное, жаропонижающее и обезболивающее действие, но применяется только наружно в составе мазей. Фенилсалицилат (салол) применяется при кишечных инфекциях. Его действие связано со способностью гидролизоваться в щелочной среде кишечника с высвобождением фенола.
Ацетилсалициловая кислота (аспирин) – это сложный эфир салициловой кислоты по фенольному гидроксилу. Ее получают ацилированием салициловой кислоты уксусным ангидридом:
|
|
COOH |
|
|
|
COOH |
|
||||||
|
|
|
|
OH |
|
|
|
|
|
O-C |
-CH 3 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
+ (CH3CO)2O |
|
|
|
|
|
|
|
|
+ CH3COOH |
|
|
|
|
|
|
|
|
|
|
|
|
||
салициловая |
|
|
|
|
|
O |
|
||||||
|
ацетилсалициловая |
|
|||||||||||
кислота |
|
|
|||||||||||
|
кислота |
|
|||||||||||
|
|
|
|
|
|
|
|||||||
131

Ацетилсалициловая кислота обладает жаропонижающим и противовоспалительным действием.
При неправильном хранении (повышенная влажность и температура) ацетилсалициловая кислота способна гидролизоваться, т.е. в препарате появляется примесь свободной салициловой кислоты.
|
|
COOH |
|
|
|
|
COOH |
фенольный |
|||||||
|
|
|
|
|
|
гидроксил |
|||||||||
|
|
|
|
O-C |
-CH 3 |
|
|
|
|
|
|
|
OH |
||
|
|
|
|
+ H2O |
|
|
|
|
|
|
+ CH3COOH |
||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
O |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
салициловая |
|
||||||||
ацетилсалициловая |
|
|
|
||||||||||||
кислота |
|
|
кислота |
|
|||||||||||
Такой препарат применять нельзя, т.к. салициловая кислота раздражает слизистую ЖКТ и обладает ульцерогенным действием. Определить доброкачественность ацетилсалициловой кислоты (т.е. отсутствие в ней примеси салициловой кислоты) можно, используя качественную реакцию на фенольный гидроксил. Если при взаимодействии с хлоридом железа (III) появилось фиолетовое окрашивание, препарат недоброкачественный.
Из производных салициловой кислоты в медицине применяется также п-аминоса- лициловая кислота (ПАСК). Она используется при лечении туберкулеза и действует как антагонист п-аминобензойной
кислоты (см. стр.129).
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. ПРОИЗВОДНЫЕ ПЯТИЧЛЕННЫХ ГЕТЕРОЦИКЛОВ
Производные гетероциклических соединений, особенно ароматических, широко распространены в природе. Они составляют основу таких природных веществ, как витамины, хлорофилл, гемоглобин, входят в структуру различных пигментов, алкалоидов. Более 50% лекарственных препаратов как растительного, так и синтетического происхождения содержат в своей структуре гетероциклические фрагменты.
132

Гетероциклическими называют соединения, в цикле кото- рых помимо атомов углерода содержатся и другие атомы (так называемые гетероатомы), чаще всего азот, кислород, сера.
Гетероциклы классифицируют по размеру цикла на трёх-, четырёх-, пяти-, шестичленные; по характеру гетероатома (азот-, кислородсодержащие и т.д.); по количеству гетероатомов в цикле (гетероциклы с одним гетероатомом, с двумя гетероатомами и т.д.).
Пятичленные гетероциклы с одним гетероатомом
Представителями пятичленных гетероциклов с одним гетероатомом являются пиррол, фуран и тиофен:
ββ
α |
α |
|
|
|
N |
O |
S |
|
H |
|
|
|
пиррол |
фуран |
тиофен |
.Все они являются ароматическими соедине-
.H . ниями, т.к. отвечают критериям ароматично-
H . |
.. |
H сти. Все атомы цикла sp2-гибридизованы, |
|
N H |
цикл плоский. Имеется замкнутая p,π- |
H |
сопряженная система. Гетероатом отдает в |
сопряжение неподеленную электронную па-
ру, т.е. 4n+2=6; n=1.
Пиррол, фуран и тиофен относят к π-избыточным гетероциклам, т.к. электронная плотность ароматического кольца повышена в сравнении с бензолом (шесть электронов ароматического облака делокализована между пятью атомами).
Как для всех ароматических соединений для пиррола, фура-
на и тиофена характерны реакции электрофильного замещения.
Из-за π-избыточности циклов эти реакции протекают легче, чем в бензоле. Кроме того, в отличие от бензола электронная плотность в их молекулах распределена неравномерно, она наиболее высокая в α-положениях. Поэтому реакции SE протекают по α-положениям.
133

Например, реакцию бромирования пиррола проводят при комнатной температуре, без катализатора:
.. |
α |
+ Br2 |
.. |
Br |
+ HBr |
N |
|
|
N |
|
|
H |
|
|
H |
|
|
α-бромпиррол
Реакции нитрования и сульфирования пиррола и фурана проводят в специальных условиях, что связано с ацидофобностью этих циклов. Ацидофобность в переводе с греческого – «боязнь кислот». При действии на ацидофобные гетероциклы концентрированных кислот происходит реакция полимеризации, и образуется смолоподобная масса (происходит осмоление). Рассмотрим причины ацидофобности на примере пиррола.
Неподеленная электронная пара азота, отвечающая за основные свойства, является частью ароматического облака, поэтому пиррол не проявляет основных свойств при взаимодействии с разбавленными кислотами. Протоны концентрированных минеральных кислот «вырывают» пару электронов атома азота из сопряжения, тем самым нарушая ароматичность. Полученный продукт подвергается полимеризации:
.. |
+ HNO3 |
+ |
NO3 |
- полимеризация |
+ |
N |
|
N |
|
|
N |
H |
|
H |
H |
|
H H n |
Для нитрования и сульфирования пиррола и фурана необходимо использовать реагенты, не проявляющие сильных кислотных свойств: ацетилнитрат и пиридинсульфотриоксид.
|
O |
|
|
|
+ CH3-COOH |
|
|
|
|
||
|
+ CH3-C |
|
|
|
|
|
|
|
|
||
O |
O-NO 2 |
|
|
O |
NO2 |
|
ацетилнитрат |
|
α-нитрофуран уксусная кислота |
||
.. |
+ |
|
|
|
|
.. |
SO3H |
+ |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
||||||||
|
|
|
|
||||||||
N |
|
N . SO3 |
|
|
|
||||||
|
|
N |
|
|
N |
||||||
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
пиридин- |
α-пирролсульфо- пиридин |
||||||||
|
сульфотриоксид |
кислота |
|
|
|
|
|
||||
134

Свойства пиррола и его производных
Пиррол проявляет крайне слабые основные свойства при взаимодействии с концентрированными минеральными кислотами (см. ацидофобность пиррола). За счёт полярности NH-связи проявляются слабые кислотные свойства. Пиррол образует соли при взаимодействии с щелочными металлами или их амидами:
|
K |
|
H2O |
+ KOH |
.. |
- H2 |
- |
.. |
|
N |
N |
N |
|
|
|
|
|||
H |
|
K+ |
H |
|
|
|
пирролкалий |
|
|
Даже вода, являясь более сильной кислотой, чем пиррол, вытесняет его из солей.
Реакции восстановления (гидрирования) пиррола протекают в довольно жёстких условиях, ступенчато:
[H] |
|
[H] |
.. |
|
|
N |
N |
N |
H |
H |
H |
пиррол |
пирролин |
пирролидин |
Пирролидин – сильное основание (как вторичный алифатический амин). Ядро пирролидина входит в структуру алкалоида никотина, аминокислоты пролина:
|
N |
N |
COOH |
|
|
|
|
N |
CH3 |
H |
|
пролин |
|
||
|
|
|
никотин
 ..
.. 
N
H
N N
H
N
..
порфин
Важную группу азотсодержащих природных веществ составляют так называемые тетрапиррольные соединения, т.е. соединения, в структуру которых входят четыре пиррольных кольца. К тетрапиррольным соединениям относится порфин, производными которого являются такие биологически
135

важные соединения как хлорофилл, гем, цитохром. Порфин является устойчивой ароматической системой (энергия сопряжения – 840 кДж/моль). В замкнутой p,π-сопряженной системе делокализовано 26 электронов.
Порфины, имеющие заместители в пиррольных циклах, называются порфиринами. Заместители могут содержать кратные связи, способные вступать в сопряжение с ароматическим облаком, что еще более стабилизирует молекулу. Пример порфирина – протопорфирин, входящий в структуру гемоглобина крови.
H3C |
|
CH=CH2 |
|
.. |
|
H3C |
N |
CH3 |
H |
NN
HOOC-CH2-CH2 |
H |
CH=CH |
|
2 |
|
|
N |
|
|
.. |
|
HOOC-CH2-CH2 |
CH3 |
.. |
N |
||
протопорфирин |
N Fe N |
|
|
|
|
|
|
HOOC |
|
|
N |
|
|
.. |
HOOC
гем
Порфирины находятся в природе в виде комплексов с металлами. Комплекс порфирина с железом – гем – небелковая часть молекулы гемоглобина и цитохромов. Комплекс с магнием является основой молекулы хлорофилла.
При биологическом окислении гемоглобина образуются окрашенные вещества с линейной тетрапиррольной структурой – билирубиноиды, например, билирубин, имеющий оранжевую окраску.
[O]
Гемоглобин
O N |
CH |
N |
CH2 |
N |
CH |
N |
O |
H |
|
|
|
|
|||
|
H |
|
H |
|
H |
|
|
|
|
|
|
|
билирубин
136
Индол (бензопиррол) – конденсированное
|
4 |
|
3 β |
гетероциклическое соединение. В его молекуле |
|||||
5 |
|
|
|||||||
6 |
|
|
.. |
|
2 α |
сконденсированы |
бензольное |
и |
пиррольное |
|
|
|
кольца. Индол |
ароматичен. |
В |
его p,π- |
|||
|
7 |
|
N 1 |
||||||
|
|
H |
сопряженной системе делокализовано 10 элек- |
||||||
|
|
|
|||||||
индол тронов.
По свойствам индол подобен пирролу. Его основные свойства практически не проявляются, он ацидофобен, обладает слабыми NH-кислотными свойствами. Индол вступает в реакции электрофильного замещения легче, чем бензол. Реакции SE протекают по β-положению пиррольного кольца:
β |
Br |
α + Br2 |
+ HBr |
N |
N |
H |
H |
индол |
β-броминдол |
Наиболее важными биологически активными производными индола являются α-аминокислота триптофан и продукты его метаболических превращений.
Триптофан входит в структуру белков. В организме он подвергается метаболическим превращениям по двум направлениям: неокислительное и окислительное декарбоксилирование:
|
|
|
|
|
|
|
|
ферменты |
|
|
|
|
|
|
CH2- |
|
CH2 |
+ CO2 |
|||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
||||||
|
|
|
CH2- |
|
CH-COOH |
|
|
|
|
|
|
H |
|
||||||||
|
|
|
|
|
триптамин |
|
|||||||||||||||
|
|
N |
NH2 |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
HO |
|
|
|
|
|
|
CH2-CH-COOH |
||||||
триптофан |
|
|
|
|
|
[O] |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
ферменты |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
||||||
|
|
|
|
|
|
|
|
|
|
5-гидрокситриптофан |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ферменты |
|
|||||||
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
CH2- |
|
CH2 |
+ CO2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
5-гидрокситриптамин |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
(серотонин) |
|
|||||||||
137

В результате неокислительного декарбоксилирования образуется токсичный биогенный амин триптамин, который затем подвергается дальнейшему превращению в β-индолилуксусную кислоту.
При окислительном декарбоксилировании вначале образуется 5-гидрокситриптофан, который затем декарбоксилируется в 5-гидрокситриптамин (серотонин). Серотонин является одним из нейромедиаторов головного мозга. Нарушение его нормального обмена в организме может привести к шизофрении. В норме серотонин окисляется в (5-гидрокси-β-индолил)уксусную кислоту и выводится с мочой.
CH3O

 CH2-COOH
CH2-COOH
 N
N 
 CH3
CH3
O=C 

 Cl
Cl
индометацин
Другим важным производным индола является нестероидный противовоспалительный препарат индометацин.
Свойства фурана и его производных
Фуран является ацидофобным соединением, нитруется и сульфируется в специальных условиях (стр. 134) по α-положениям. Фуран способен к реакции гидрирования с образованием тетрагидрофурана:
O O
фуран тетрагидрофуран
Тетрагидрофуран используется как растворитель в органических синтезах, в т.ч. при получении лекарственных препаратов.
4 |
|
3 |
Фурфурол |
(фуранкарбальдегид) является |
|
|
|||||
5 |
1 |
2 O |
одним из |
наиболее важных производных |
|
C |
|||||
|
O |
|
|
||
|
H |
фурана. |
|
||
|
|
|
фурфурол
Фурфурол проявляет свойства альдегида: он легко окисляется, участвует в реакции Канниццаро (т.к. в его структуре отсутствует α-CH-кислотный центр).
138
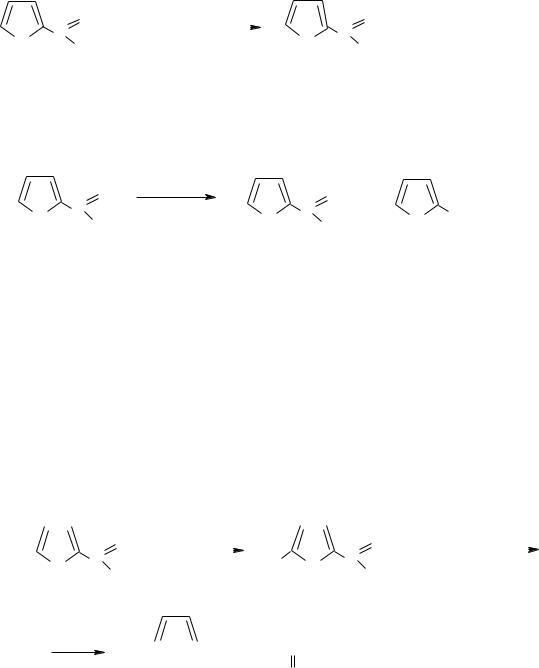
При окислении фурфурола образуется фуранкарбоновая кислота:
|
C |
O |
+ Ag(NH3)2OH |
to |
C |
O |
+ Ag + NH3 |
+ H2O |
|
O |
H |
|
O |
OH |
|||||
|
|
|
|
|
|
||||
фуранкарбоновая кислота
В реакции Канниццаро одна молекула фурфурола окисляется в фуранкарбоновую кислоту, а вторая – восстанавливается в фурфуриловый спирт:
2 |
O |
NaOH |
O |
+ |
|
|
|
|
CH2OH |
||||
O |
C |
O |
C |
|
O |
|
H |
ONa |
|
|
|||
фурфурол |
натриевая соль |
|
фурфуриловый |
|||
|
|
фуранкарбоновой |
|
спирт |
|
|
|
|
кислоты |
|
|
|
|
Из фурфурола получают 5-нитропроизводные фуранового ряда, проявляющие антибактериальное действие. Для этого фурфурол нитруют азотной кислотой в уксусном ангидриде (он необходим для защиты альдегидной группы от окисления), а затем проводят реакцию присоединения-отщепления с различными аминами или производными гидразина. Например, в синтезе фу-
рацилина (семикарбазона 5-нитрофурфурола) используют семи- |
|||||||||||
карбазид: |
|
|
|
|
|
|
O |
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
HNO3 |
5 |
|
O |
H2N-NH-C-NH 2 |
|
|||
|
|
C H |
|
|
O2N O |
C H |
семикарбазид |
||||
|
O |
(CH3CO)2O |
|||||||||
5-нитрофурфурол
O2N
 O
O  CH=N-NH-C-NH 2 O
CH=N-NH-C-NH 2 O
семикарбазон 5-нитрофурфурола
К производным 5-нитрофуранового ряда также относятся фуразолидон, фурадонин, фуразолин и др. препараты.
Производным тиофена, а точнее тетрагидротиофена является биотин (витамин H), недостаток которого ведет к кожным заболеваниям:
139
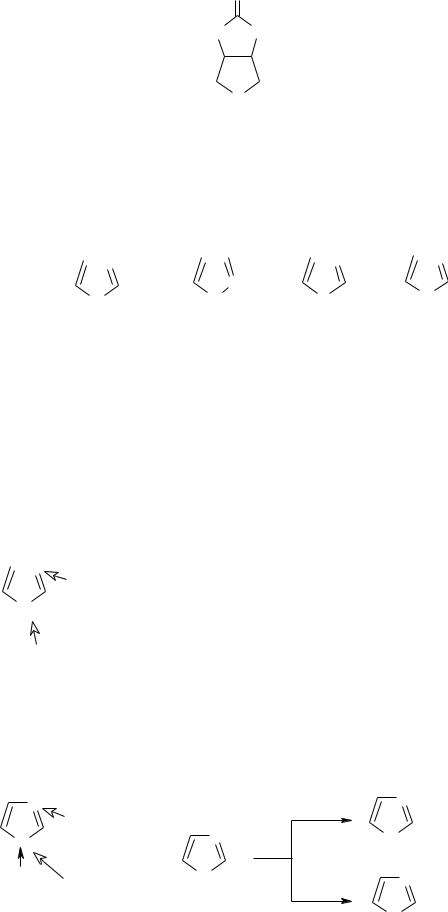
O
HN NH
 (CH2)4-COOH
(CH2)4-COOH
S
биотин
Пятичленные гетероциклы с двумя гетероатомами
Примерами пятичленных гетероциклических соединений с
двумя гетероатомами являются: |
|
3 |
4 |
|
|
3 |
||||||
|
3 |
4 |
|
3 |
4 |
|
|
|||||
4 |
|
N |
|
|
N |
|
|
|
N |
|||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||
5 |
1 2 |
5 |
1 N2 |
5 1 2 |
5 1 |
|
2 |
|||||
|
N |
|
N |
|
S |
|
O |
|
||||
|
H |
|
H |
|
|
|
|
|
|
|
||
имидазол |
пиразол |
тиазол |
оксазол |
|||||||||
Все эти соединения ароматические. Они вступают в реакции электрофильного замещения с меньшей скоростью, чем пятичленные гетероциклы с одним гетероатомом (электронная плотность ароматического кольца ниже из-за электроноакцепторного влияния пиридинового атома азота). Для имидазола и пиразола характерны также таутомерные превращения и образование межмолекулярных водородных связей.
3 |
|
В молекуле имидазола два неравно- |
||
|
N: |
|
||
.. |
пиридиновый |
ценных атома азота: пиррольный в по- |
||
|
||||
|
азот |
|||
N 1 |
ложении 1 и пиридиновый в положе- |
|||
|
||||
H |
|
нии 3. Пиррольный азот отдает в со- |
||
пиррольный |
||||
пряжение неподеленную электронную |
||||
азот |
|
|||
пару, пиридиновый азот – один электрон. Его неподеленная электронная пара в сопряжении не участ-
вует. Пирольный азот отвечает за слабые кислотные свойства, |
|||||
пиридиновый – за основные: |
|
+ |
|
||
|
|
|
|
|
|
|
N: |
|
HCl |
NH |
|
|
основный |
|
|
Cl - |
|
.. |
|
|
|
||
центр |
N |
|
N |
||
N |
|
имидазолия хлорид |
|||
|
|
|
H |
||
|
|
|
|
||
H |
кислотный |
N |
K |
N |
|
|
H |
- |
|
||
|
центр |
|
|
|
|
|
|
|
N |
имидазол калий |
|
|
|
|
|
||
K +
140
