
Яцюк, Зубкова _Основы биоорганической химии
.pdf
-с увеличением поляризуемости атома основного центра основность уменьшается, т.е. оксониевые основания сильнее сульфониевых;
-электронодонорные заместители повышают основность, а электроноакцепторные – понижают (чем выше электронная плотность на основном центре, тем легче он предоставит свою электронную пару протону). Так, в ряду п-нитроанилин, анилин,
п-толуидин основность повышается: нитро-группа является электроноакцепторным заместителем, а метильная группа – электронодонорным. Это подтверждают и значения pKBH+.
.. |
|
|
.. |
.. |
|
NH2 |
|
NH2 |
NH2 |
||
|
|
< |
|
< |
|
N |
|
|
|
CH3 |
|
O |
|
O |
|
|
+I |
-I NO2 |
, |
-M NO |
2 |
|
CH3 |
|
|
|
|
|
|
pKBH+=1,00 |
|
pKBH+=4,60 |
pKBH+=5,10 |
||
Итак, самыми сильными основаниями являются аммониевые. Основность различных типов аминов мы обсудим, рассматривая химические свойства аминов в целом.
АМИНЫ
Амины – это производные аммиака, в молекуле которого один, два или три атома водорода замещены углеводородными радикалами. Отсюда первый тип классификации аминов: по количеству радикалов амины подразделяют на первичные, вторичные и третичные.
CH3-NH2 |
CH3-NH-CH2-CH3 |
CH3-N-CH3 |
первичный |
вторичный |
CH3 |
метиламин |
метилэтиламин |
|
|
|
третичный |
|
|
триметиламин |
71

Другой вид классификации аминов – по природе радикалов. Амины подразделяют на алифатические и ароматические. Например, приведенные выше амины являются алифатическими, а анилин (аминобензол) – ароматическим:

 NH2
NH2
анилин
Для названия аминов применяют радикалофункциональную и заместительную номенклатуру IUPAC. По радикало-функциональной номенклатуре называют радикал или радикалы, если их несколько (в алфавитном порядке), и добавляют слово «амин», например, метиламин, метилэтиламин, диметиламин и т.д. Те амины, которые нельзя назвать по радикалофункциональной номенклатуре (сложные радикалы), называют
по заместительной номенклатуре, например: 4 3 2 1
CH3-CH-CH-CH 3
CH3 NH2
3-метилбутанамин-2
Ароматические амины обычно рассматривают как производные анилина, например:
|
NH2 |
CH3 |
NH-CH3 |
|
|
||
|
|
|
|
|
|
|
2-метиланилин N-метиланилин (о-метиланилин, о-толуидин)
За счёт неподелённой электронной пары азота амины проявляют основные и нуклеофильные свойства.
Сравним основные свойства различных групп аминов. Алифатические амины являются более сильными основа-
ниями, чем ароматические. Это связано с тем, что неподелённая электронная пара азота в ароматических аминах участвует в p,π- сопряжении и менее доступна для атаки протона водорода. В алифатических же аминах электронная плотность на атоме азота аминогруппы повышена за счёт электронодонорного влияния алкильных групп:
72

.. |
|
|
|
NH2 |
|
|
.. |
|
CH |
|
NH2 |
|
3 |
Алифатические амины взаимодействуют с минеральными кислотами, карбоновыми кислотами и даже с водой (очень слабой кислотой):
|
|
|
+ |
- |
|
|
CH3-NH2 + HCl |
|
|
CH3-NH3 Cl |
|
||
|
|
|||||
метиламин |
метиламмония |
|
||||
|
|
|
хлорид |
|
|
|
|
|
|
|
|
O |
|
CH3-NH2 + CH3COOH |
|
CH3-C |
- + |
-CH3 |
||
|
||||||
метиламин |
|
|
O NH3 |
|||
|
метиламмония ацетат |
|||||
+ -
CH3-NH2 + H2O  CH3-NH3 OH
CH3-NH3 OH
метиламин метиламмония гидроксид
Ароматические амины как слабые основания взаимодействуют с минеральными кислотами:
|
+ |
- |
NH2 + HCl |
NH3 |
Cl |
анилин |
анилиния хлорид |
|
(фениламмония хлорид)
Заместители в ароматическом кольце влияют на основные свойства аминов: электронодонорные заместители повышают основные свойства, а электроноакцепторные – понижают (см.
стр.71).
Сравним основные свойства различных типов алифатических аминов – первичных, вторичных и третичных, например, метиламина, диметиламина и триметиламина.
|
|
|
|
.. |
.. |
|
|
H3C .. CH3 |
|||
CH3 |
|
|
NH2 |
CH3 |
NH |
|
CH3 |
N |
|||
|
|
||||||||||
первичный |
вторичный амин |
|
|
||||||||
|
|
||||||||||
амин |
|
|
|
|
|
|
|
||||
|
pKBH+=10,77 |
CH3 |
|||||||||
pK |
|
|
|
=10,62 |
|||||||
BH+ |
третичный амин |
||||||||||
|
|
|
|
|
|
||||||
pKBH+=9,80
73

Чем выше электронная плотность на атоме азота, тем выше основные свойства амина. Каждая метильная группа смещает электронную плотность к атому азота, поэтому можно было бы предположить, что самым сильным основанием является третичный амин. Однако, сравнивая значения pKBH+, можно увидеть, что это не так: самым сильным основанием является вторичный амин. Этот факт можно объяснить с позиций пространственной доступности неподелённой электронной пары азота: в триметиламине три крупных заместителя «прикрывают» её. Таким образом, ряд убывания основности алифатических аминов:
вторичные > первичные > третичные.
За счет неподелённой электронной пары азота амины проявляют также нуклеофильные свойства. Амины являются нуклеофилами, например, в реакциях алкилирования и ацилирования.
Алкилирование – это введение в молекулу алкила (метил, этил, пропил и т.п.). В качестве алкилирующих реагентов обычно используют алкилгалогениды (этилхлорид, метилбромид, например). Так, в реакции этиламина с метилхлоридом образуется метилэтиламин:
.. |
δ+ |
|
||
C2H5-NH2 |
+ CH3 |
Cl |
|
C2H5-NH-CH 3 + HCl |
|
||||
этиламин |
метилхлорид |
метилэтиламин |
||
Это реакция нуклеофильного замещения. Она позволяет получить вторичный амин из первичного и третичный – из вторичного.
.. |
δ+ |
|
|
|
|
|
|
C2H5-NH-CH3 + CH3-Cl |
|
C2H5-N-CH3 + HCl |
|
|
|||
метилэтиламин |
|
|
CH3 |
|
|
|
|
|
|
|
диметилэтиламин |
Ароматические амины также вступают в реакции алкилирования, но менее активно, т.к. их нуклеофильные свойства понижены (неподелённая электронная пара, отвечающая за них, участвует в p,π-сопряжении).
.. |
|
NH2 + CH3-Cl |
NH-CH3 + HCl |
анилин |
N-метиланилин |
|
(метилфениламин) |
74

Ацилированием называют введение в молекулу ацила – остатка карбоновой кислоты (например, ацетил – это остаток уксусной кислоты, пропионил – пропионовой). Для ацилирования аминов обычно используют ангидриды соответствующих кислот.
δ+ O |
|
|
|
O |
|
CH3-C |
.. |
|
|
|
|
O |
+ H2N-CH3 |
|
CH3 |
-C |
+ CH3-COOH |
|
|||||
CH3-C |
метиламин |
|
|
NH-CH3 |
уксусная кислота |
O |
|
|
N-метиламид |
|
|
уксусный ангидрид |
уксусной кислоты |
|
Подробнее мы будем рассматривать эти реакции, изучая тему «Карбоновые кислоты и их функциональные производные».
Для ароматических аминов характерны также реакции, протекающие за счёт ароматического кольца – реакции электрофильного замещения. Ранее мы уже рассматривали влияние аминогруппы на ход реакций SE (см. стр.44,45): аминогруппа, являясь электронодонорным заместителем (+MNH2 >> -INH2), облегчает эти реакции в сравнении с бензолом и является орто-, параориентантом. Например, бромирование анилина бромной водой приводит к образованию белого осадка 2,4,6-триброманилина:
NH2 |
|
NH2 |
H2O |
Br |
Br |
+ 3 Br2 |
|
+ 3 HBr |
анилин |
|
Br |
|
|
|
|
2,4,6-триброманилин |
|
Эту реакцию используют для качественного обнаружения
анилина.
РЕАКЦИОННАЯ СПОСОБНОСТЬ ОКСОСОЕДИНЕНИЙ
Функциональной группой оксосоединений является карбонильная или оксогруппа  C=O. В молекулах альдегидов оксогруппа связана с радикалом и атомом водорода, поэтому общая фор-
C=O. В молекулах альдегидов оксогруппа связана с радикалом и атомом водорода, поэтому общая фор-
мула альдегидов |
. |
O |
|
R-C H |
|||
|
|
75

В кетонах оксогруппа связана с двумя радикалами, общая
формула кетонов R-C-R' .
O
Классификация и номенклатура оксосоединений
Оксосоединения классифицируют по природе радикала на алифатические (предельные и непредельные) и ароматические.
Рассмотрим номенклатуру первых представителей предельных алифатических альдегидов. По заместительной номенклатуре IUPAC их названия строятся с использованием названий алканов с соответствующим количеством атомов углерода в цепи с добавлением суффикса –аль. Часто используют и тривиальные названия альдегидов.
|
|
|
|
|
|
|
Таблица 1 |
|
|
|
Названия алифатических альдегидов |
||||
|
|
|
|
|
|
||
|
|
Строение |
|
Тривиальное название |
Название по IUPAC |
||
|
|
|
|
|
|
|
|
|
|
H-C |
O |
|
муравьиный |
альдегид |
метаналь |
|
|
H |
|
(формальдегид) |
|
|
|
|
|
|
|
|
|
||
|
|
CH3-C |
O |
|
уксусный альдегид |
этаналь |
|
|
|
H |
|
(ацетальдегид) |
|
|
|
|
|
|
|
|
|
||
|
|
|
O |
пропионовый альдегид |
пропаналь |
||
|
CH3-CH2 |
-C |
|
|
|
|
|
|
|
|
H |
|
|
|
|
CH3 |
-CH2-CH2-C |
O |
масляный альдегид |
бутаналь |
|||
H |
|
|
|
||||
|
|
|
|
|
|
|
|
CH3 |
-CH2-CH2-CH2 |
O |
валериановый альдегид |
пентаналь |
|||
-C |
|
|
|
||||
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
Альдегиды с разветвлёнными радикалами также можно называть, используя два вида номенклатуры. Рассмотрим это на конкретном примере:
β |
α |
|
O |
|
|
2 |
1 |
|
|||
3 |
|
|
|||
CH3-CH-CH2 |
-C |
H |
3-метилбутаналь (IUPAC) |
||
|
|
|
|
β-метилмасляный альдегид |
|
CH3 |
|
|
|
||
|
|
|
|
||
76

По номенклатуре IUPAC это соединение рассматривается как производное бутаналя, положение заместителя обозначается цифрой (первым является атом углерода альдегидной группы): 3-метилбутаналь. Если за основу принимается тривиальное название альдегида (масляный), то положение заместителя обозначается греческой буквой (α-, β-, γ- и т.д.), при этом α-положением является атом углерода, ближайший к альдегидной группе: β- метилмасляный альдегид.
Простейшим непредельным альдегидом является акриловый альдегид, или акролеин (тривиальное название). По номенклатуре IUPAC это пропеналь:
O
CH2=CH-C
H
Примером ароматических альдегидов является бензальдегид:
O
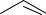
 C
C
H
Кетоны называют по двум видам международной номенклатуры – заместительной и радикально-функциональной.
По заместительной номенклатуре название кетона рассматривают как производное соответствующего углеводорода, обозначая оксогруппу суффиксом –он и указывая её положение. По радикало-функциональной номенклатуре название кетона складывается из названий соответствующих радикалов (в алфавитном порядке) с добавлением слова кетон. Например:
|
1 |
2 |
3 |
4 |
5 |
CH3-C-CH 3 |
CH3-C-CH 2-CH2-CH3 |
||||
O |
|
O |
|
|
|
пропанон |
|
пентанон-2 |
|
||
диметилкетон |
|
метилпропилкетон |
|||
ацетон |
|
|
|
|
|
Диметилкетон часто называют тривиальным названием – ацетон.
77

Реакционные центры в молекулах оксосоединений
|
H |
δ− |
основный центр |
R |
α |
δ+ O: |
|
C |
C |
|
|
CH-кислотный |
H |
H |
|
|
|
||
центр |
электрофильный |
||
|
центр |
|
|
Более электроотрицательный атом кислорода смещает к себе электронную плотность, создавая на атоме углерода карбонильной группы частичный положительный заряд. Углерод карбонильной группы становится электрофильным центром. За счёт неподеленной электронной пары кислород является основным центром. Альдегидная группа смещает электронную плотность с соседнего атома углерода (α-атом), создавая на нем частичный положительный заряд. За счёт этого C-H-связи поляризуются,
возникает CH-кислотный центр.
Электрофильный центр в молекулах оксосоединений может быть атакован нуклеофильным реагентом. Реакции протекают с разрывом π-связи (присоединение). Значит, для альдегидов и ке-
тонов характерны реакции нуклеофильного присоединения (AN).
Легкость протекания реакций нуклеофильного присоединения зависит от величины δ+ на электрофильном центре и от его пространственной доступности.
Сравним активность муравьиного, уксусного, трихлоруксусного альдегидов и ацетона.
|
O |
|
O |
Cl |
O |
|
δ+ |
|
δ+ |
δ+ |
|||
|
|
δ+ |
|
|||
H-C |
H |
CH3 |
C |
Cl C C |
H |
CH3 C CH3 |
|
|
H |
|
O |
||
муравьиный |
уксусный |
Cl |
|
|||
|
|
|||||
альдегид |
альдегид |
трихлоруксусный |
ацетон |
|||
|
|
|
||||
альдегид
С позиций величины заряда на электрофильном центре наибольшей реакционной способностью обладает трихлоруксусный альдегид, т.к. три электроноакцепторных заместителя способствуют его увеличению. В молекуле муравьиного альдегида замес-
78

титель отсутствует. В молекуле уксусного альдегида метильная группа понижает частичный положительный заряд на углероде карбонильной группы, а значит, понижает и активность. В молекуле ацетона таких электронодонорных заместителей два, а значит, активность ещё ниже. Таким образом, электроноакцепторные заместители в радикале повышают активность оксосоединений в реакциях AN, а электронодонорные заметители – понижают.
С позиций доступности реакционного центра ацетон также является наименее реакционноспособным, т.к. возникают пространственные затруднения для атаки нуклеофилом (реакционный центр «экранирован» двумя крупными углеводородными радикалами).
В целом, альдегиды более реакционноспособны в реакциях нуклеофильного присоединения, чем кетоны.
Механизм реакции нуклеофильного присоединения может быть описан следующим образом:
δ+ |
O |
|
|
|
|
O- |
+ |
|
OE |
|||
|
+ E+Nu- |
|
|
|
|
|
E |
|
|
|
||
R-C |
|
|
|
R-C |
|
Nu |
|
|
R-C |
|
Nu |
|
|
|
|
|
|
|
|||||||
|
-E+ |
|
|
|
|
|||||||
|
H (R') |
|
|
H (R') |
|
|
|
H (R') |
||||
|
1 |
|
|
|
2 |
|
|
|
3 |
|||
Нуклеофильная частица (Nu-) атакует электрофильный центр молекулы оксосоединения (1). π-Связь разрывается гетеролитически, и оба её электрона уходят к атому кислорода. Новая связь C-Nu образуется за счёт электронов нуклеофила. Образовавшаяся отрицательная частица (2) дальше взаимодействует с электрофилом, давая продукт нуклеофильного присоединения
(3).
По приведенному механизму протекает ряд важных реакций альдегидов и кетонов, в которых нуклеофилами являются, на-
пример, H2O, R-OH, HCN, H-, NH3, R-NH2.
79

Примеры реакций нуклеофильного присоединения
Взаимодействие со спиртами. Альдегиды при взаимодейст-
вии со спиртами образуют полуацетали, а при избытке спирта – ацетали. Реакция протекает в присутствии катализатора – газообразного хлороводорода.
|
O: |
|
|
|
|
+ |
|
|
OH |
.. |
|
HCl газ |
|
|
OH |
|
+ |
HO-CH3 |
|||
|
δ+ |
CH3 |
C |
|
|
|||||
CH3 |
C |
-Cl- |
|
CH3 |
C |
H |
|
|||
|
H |
|
|
|
H |
|
|
|
||
|
1 |
|
|
|
2 |
|
|
3 |
|
|
|
|
OH |
|
|
Cl |
- |
|
OH |
|
|
|
CH3 C |
+ |
CH3 |
|
CH3 |
C |
O |
CH3 |
|
|
|
O |
|
|
|
||||||
|
|
H |
H |
|
|
|
|
H |
|
|
4 |
полуацеталь |
|
Молекула этанола не является достаточно активным нуклеофилом для этой реакции. Чтобы увеличить активность электрофильного центра (карбонильный углерод с δ+) и используют кислотный катализ. На первой стадии реакции альдегид (1) взаимодействует с хлороводородом по основному центру (атом кислорода с неподеленной электронной парой), образуя катион, который существует в виде двух резонансных структур (2 и 3). В карбкатионе (3) на электрофильном центре уже полный положительный заряд (а не частичный, как в исходном альдегиде). Таким образом, активность электрофильного центра увеличилась, и он может взаимодействовать со слабым нуклеофилом – молекулой спирта. Новая связь C-O образуется за счет неподеленной электронной пары кислорода, поэтому на нем появляется положительный заряд (4). Для стабилизации этому катиону необходимо отщепить протон водорода. Его принимает анион Cl-. Образуется молекула конечного продукта реакции – полуацеталя.
По такому же механизму происходит дальнейшее превращение полуацеталя в ацеталь:
|
|
|
OH |
HCl газ |
|
|
|
OCH3 |
|||||||
|
|
|
|
|
|
CH3 + CH3-OH |
CH3 |
|
C |
|
O |
|
CH3 + H2O |
||
CH3 |
|
C |
|
O |
|
|
|
|
|
|
|||||
|
|
|
- |
|
|
|
|
||||||||
|
|
|
|
||||||||||||
|
|
|
H |
|
|
|
|
|
H |
||||||
полуацеталь |
диметилацеталь |
|
|
|
уксусного альдегида |
80
