
книги / Современный катализ и химическая кинетика
..pdf9.4. Нефтехимия: реакции с участием низкомолекулярных олефинов —J |
421 |
9.4.3.Катализ в реакциях полимеризации
Большинство низкомолекулярных олефинов, получаемых в хими ческой промышленности, используется для получения полимеров, полный объем производства которых в год составляет около 100 миллионов тонн. Полимеры — макромолекулы, молекулярный вес которых обычно лежит в пределах от 104 до 106, имеющие линейную, разветвленную или сетчатую структуру, построенную из небольших мономерных звеньев типа этилена, пропилена, винилхлорида, сти рола и т. д. Подавляющее число полимеров получают в каталитических реак циях. Здесь мы в качестве примера рассмотрим полимеризацию этилена, про текающую с участием хромового катализатора [24].
Процесс Филлипса, полимеризация этилена с участием хромового катали затора, используется для производства примерно одной трети выпускаемого во всем мире полиэтилена высокой плотности. Процесс был разработан в 1951 г. и постоянно совершенствовался, так что в настоящее время имеется «семей ство» различных катализаторов на основе хрома, которые можно использовать для производства полиэтиленов около 50 сортов, различающихся молекулярным весом макромолекул, степенью их разветвленности и типом сомономера — буте на, гексена или октена. Это разнообразие отражает коммерческий успех про цесса Филлипса. Свойства полимерного продукта могут регулироваться путем изменения разнообразных параметров — температуры кальцинирования катали затора, температуры и давления в процессе полимеризации, размера пор носите ля из кремнезема, а также введением добавок титана или фтора, использующих ся в качестве промоторов, в носитель или даже заменой носителя на оксид алю миния, что приводит к увеличению молекулярного веса макромолекул.
Хромовый катализатор, использующийся в реакциях полимеризации, отли чается от катализаторов других химических реакций тем, что здесь он может расходоваться в силу случайных причин. В процессе реакции полимерные мо лекулы заполняют поры и оказывают сильное внутреннее давление на носи тель. В результате катализатор может разрушиться и попасть в конечный про дукт в виде высокодисперсных частиц.
Из-за малого содержания хрома катализатор Филлипса достаточно слож но охарактеризовать. Типичное содержание хрома составляет 0,5 вес. % или один атом хрома на 1 нм2. Катализатор получают пропиткой носителя вод ным раствором хромовой кислоты. После сушки хром присутствует в катали заторе в форме гидратированного оксида Сг(6+). Кальцинирование является важной ступенью в получении катализатора. Для придания катализатору тре буемой активности в реакции полимеризации кальцинирование следует про водить, по крайней мере, при 550 °C. Высокая температура позволяет обеспе чить связь через кислородные мостики иона Сг6+ с ионами кремния (рис. 9.20). Более того, формируются и островки чистого хрома, что позволяет рассмат ривать его как истинный монокристаллический катализатор. Изолированные ионы Сг6+, однако, полностью координированы ионами кислорода, поэтому они не проявляют активности в реакции полимеризации этилена. Восстанов
9.4. Нефтехимия: реакции с участием низкомолекулярных олефинов |
423 |
Инициирование реакции идет медленно, тогда как процесс полимеризации протекает быстро. В систему можно вводить активаторы типа триэтилалюминия, которые способствуют восстановлению Сг6+ и образованию первичной этильной группы, что позволяет существенно ускорить стадию активации.
Рис. 9.22. Полученные с помощью атомно-силового микроскопа изображения пленок полиэтилена, сформированных на плоской поверхности модельного хромово го катализатора. Узкие светлые полоски — ламеллярные кристаллы. Они фор мируют хорошо известные сферулитовые структуры при кристаллизации рас
плава полиэтилена. В зависимости от толщины слоя рост сферулитов останав ливается на различных стадиях процесса [27]
На рис. 9.22 приведено полученное с помощью атомно-силового микро скопа изображение молекул полиэтилена, сформированных на плоском мо дельном катализаторе Филлипса. Чтобы понять смысл этого изображения, сле дует учесть, что полиэтилен образуется при температуре 160 °C, которая выше его температуры плавления. При охлаждении полиэтилен кристаллизуется с образованием ламеллярных (слоистых) структур, пытающихся упаковаться упо рядоченно параллельно друг другу. Этому упорядочению препятствуют дефек ты и сшивки между различными ламеллями. По истечении короткого времени, связанного с протеканием реакции, на подложке формируется сплошной слой ламеллей полиэтилена, достигающих толщины 80 нм. В этом слое наряду с по лимерными молекулами присутствуют и более короткие цепи парафинов. По мимо уложенных штабелем пластинчатых элементов, относящихся к парафинам и полиэтиленовым ламеллям, на поверхности присутствуют также кристалли ческие пучки молекул полиэтилена, выросшие в виде снопов. При длительном проведении реакции слой существенно утолщается, а его морфология ради кальным образом изменяется. Из рис. 9.22 видно, что на поверхности форми руются упорядоченные домены из полиэтилена диаметром примерно 50 мкм. Средняя толщина пленки составляет 250 нм. В центральной части полиэтиле новая ламелла растет в форме снопа из некоторого центра нуклеации. Действи тельно, ламеллы стараются уложиться параллельно друг другу, но это удается им сделать лишь отчасти, поскольку они несовершенны из-за наличия, например, петель полимерных молекул и разрыхленных выступающих краев. На третьей фо тографии показана финальная стадия роста сферулитов в слое толщиной 420 нм. Центры нуклеации можно еще различить, но они покрыты куполообразными струк турами, как это имеет место при кристаллизации толстых слоев полиэтилена [26].
424 |
Глава 9. Переработка нефти и нефтехимия |
Список литературы
1.Moulijn J.A., Makke М., Van Diepen A. Chemical Process Technology. Chichester: Wiley, 2001.
2.Gosselik J.W. // Cat. Tech. 1998. V. 4. P. 127.
3.http://www.bpamoco.com.
4.Prins R., De Beer V.H.J., Somorjai GA. // Catal. Rev. — Sci. Eng. 1989. V. 31. P. 1.
5.Topsve H, Clausen B.S., Massoth F.E. Hydrotreating Catalysis. Berlin: SpringerVerlag, 1996.
6.Sanders A.F.H., De Beer V.H.J., Van Veen J.A.R., Niemantsverdriet J.W. //
Appl. Surf. Sci.. 1999. V. 144. P. 380.
7.Coulier L., De Beer V.H.J., Van Veen J.A.R., Niemantsverdriet J.W. // Top. Catal. 2000. V. 13. P. 99.
8.Pecoraro T.A., Chianelli R.R. // J. Catal. 1981. V. 67. P. 430.
9.Raybaud P., Hafner J., Kresse G., Touhoat H. // J. Phys. : Condensed Matter. 1997. V. 9. P. 11, 107.
10.Von Ballmoos R., Harris D.H., Magee J.S. In: Handbook of Heterogeneous Catalysis. Vol. 4. /Eds Ertl G., Knozinger H., Weitkamp J. Weinheim: Wiley-WCH, 1997. P. 1955.
11.Moulijn J.A.. Makkee M., Van Diepen A. Chemical Process Technology. Chichester: Wiley, 2001.
12.Sinfelt J.H. In: Handbook of Heterogeneous Catalysis. Vol. 4. /Eds. Ertl G., Knozinger H., Weitkamp J. Weinheim: Wiley-WCH, 19997. P. 1939.
13.Sinfelt J.H. Ц Adv. Chem. Eng. 1964. V. 5. P. 37
14.Van Santen R.A., Niemantsverdriet J. W. Chemical Kinetics and Catalysis. New York: Plenum, 1995.
15.Somorjai G.A. Introduction to Surface Chemistry and Catalysis. New York: Wiley, 1994.
16.Introduction to Zeolite Science and Practice / Eds. Van Bekkum H., Flanigan E.M., Jansen J.C. Amsterdam: Elsevier, 1991.
17.Weitkamp J., Traa Y. In: Handbook of Heterogeneous Catalysis. Vol. 4. /Eds. Ertl G., Knozinger H., Weitkamp J. Weinheim: Wiley-WCH, 19997. P. 2039.
18.Corma A., Martinez A. // Catal. Rev. — Sci. Eng. 1993. V. 35. P. 483.
19.Van Satten R.A., Kuipers H.P.C.E. // Adv. Catal. 1987. V. 35. P. 265
20.Gates B.C. Catalytic Chemistry. New York: Wiley, 1992.
21.Mars P., van Krevelen D.W. // Chem. Eng. Sci. 1954. V. 3. P. 41.
22.Claeser L.C., Brazdil J.F., Hazle M.A., Mehicic M., Crasselli R.K. // J. Chem. Soc. Faraday Trans. I. 1985. V. 81. P. 2903.
23.Niemantsverdriet J. W. Spectroscopy in Catalysis. Weinheim: Wiley-VCH, 2000.
24.McDaniel M.P. // Adv. Catal. 1985. V. 33. P. 47.
25. Thiine P.C., Verhagen C.P., Van den Boer M.J., Niemantsverdriet J.W. //
J.Phys. Chem. B. 1997. V. 101. P. 8559.
26.Arlman E.J., Cossee P. // J. Catal. 1964. V. 3. P. 89.
27.Thiine P.C., Loos P., Lemstra P.J., Niemantsverdriet J. W. // J. Catal. 1999. V. 183.
P. 1.
28.Billmeyer F. W. Textbook of Polymer Science. New York: Wiley Interscience, 1984.
ГЛАВА КАТАЛИЗ И ЗАЩИТА ОКРУЖАЮЩЕЙ СРЕДЫ
10.1.ВВЕДЕНИЕ
В современном обществе востребованы технологии, оказываю щие минимальное воздействие на окружающую среду. В идеале химические процессы должны быть «чистыми», то есть в них не должны образовываться вредные субпродукты и отходы. Более того, сами продукты, например топ ливо, при их использовании не должны создавать проблем для окружающей среды. Водородные топливные элементы (гл. 8) и процессы гидрообессери вания (гл. 9) являются прекрасными примерами таких технологий, в кото рых катализ играет существенную роль. Однако выброса вредных соедине ний не всегда удается избежать, например на тепловых электростанциях или на транспорте, и здесь основанные на катализе технологии очистки помога ют уменьшить уровень загрязнения окружающей среды. Эти технологии яв ляются предметом данной главы.
Транспорт и промышленные предприятия являются основными источ никами загрязнения воздуха в Западном мире. Они являются поставщиками монооксида углерода, оксидов азота (NOJ, оксидов серы (SOx) и органичес ких соединений всех типов. Катализ является незаменимым в конверсии этих соединений в более мягкие по отношению к окружающей среде со единения типа Н2, Н2О и СО2, хотя последний сейчас считается ответ ственным за парниковый эффект. Катализ как способ защиты окружаю щей среды в настоящее время используется во многих крупномасштабных процессах: на тепловых электростанциях для очистки дымовых газов, на транспорте, в котельных, работающих на угле, в ресторанах для удаления ароматических соединений, образующихся при жарке мяса и гамбургеров,
втуалетах для удаления неприятных запахов, для удаления летучих органи ческих соединений в промышленности и для разложения аммиака в сточ ных водах. Здесь мы сосредоточим свое внимание на основных процессах: на каталитической нейтрализации выхлопных газов автомобилей и на сис темах удаления NOx из дымовых газов тепловых электростанций. Мы крат ко обсудим эти процессы, использующиеся катализаторы, а также кинети ку и механизмы реакций.
426Глава 10. Катализ и защита окружающей среды
10.2.КАТАЛИТИЧЕСКАЯ НЕЙТРАЛИЗАЦИЯ ВЫХЛОПНЫХ ГАЗОВ
Транспорт является основным источником загрязнения атмос феры крупных городов. Общее число легковых и грузовых автомобилей, ав тобусов и мотоциклов в мире в 1990 г. составляло около 650 миллионов. Все эти передвижные средства являются источником выхлопных газов, и, по оценкам, примерно 500 000 человек в мире умирает вследствие загрязнения воздуха транспортом. На транспортные средства приходится более полови ны объема продуктов переработки нефти — бензина, дизельного топлива и керосина. Кроме того, транспорт является источником примерно четверти всех выбросов углекислого газа (порядка 200 г/км для легкового автомобиля среднего класса).
Типичные концентрации составляющих выхлопных газов автомобилей, по мимо СО9 и Н2О, представлены в табл. 10.1. Происхождение этих молекул очевидно: так, СО, токсичная составляющая мгновенного действия, появляет ся в результате неполного сгорания углеводородов. Водород всегда присут ствует в пропорции 1/3 по отношению к концентрации СО и появляется в результате разрушения углеводородных молекул. Оксид азота (почти исклю чительно NO) появляется при горении топлива при высоких температурах и ответствен за коричневатый цвет дымки, которая в солнечный день иногда видна над городами.
Таблица 10.1. Типичные концентрации соединений в выхлопных газах [1]
Соединение |
Концентрация |
Углеводородыа |
750 миллионных долей |
№х |
1050 миллионных долей |
СО |
0,68 об. % |
Н2 |
0,23 об. % |
О2 |
0,58 об. % |
а) На основе С3.
Несгоревший бензин и разрушенные молекулы углеводородов типа этилена и пропилена также составляют значительную часть выхлопных газов. Бензин содержит различные добавки: бензол, толуол и разветвленные углеводороды, обеспечивающие необходимое значение октанового числа. Непосредственные выбросы этих летучих соединений, например, на заправочных станциях вносят существенный вклад в загрязнение окружающей среды. Топлива с добавками соединений свинца типа тетраэтилсвинца, повышающего октановое число, в настоящее время стараются не производить, поскольку свинец является отрав
10.2. Каталитическая нейтрализация выхлопных газов |
427 |
ляющим веществом для человек и катализаторов, особенно для родия, исполь зующегося для удаления NO.
Принятый в США в 1970 г. «Закон о чистом воздухе» установил стандарты чистоты воздуха по шести основным загрязняющим элементам — аэрозольным частицам, оксидам серы, монооксиду углерода, оксидам азота, углеводородам и фотохимическим окислителям. Установлены также стандарты для выбросов автомобилей — основного источника монооксида углерода, углеводородов и оксидов азота. Перечень стандартов дан в табл. 10.2. Предельные уровни за грязнений, установленные в Европейском Союзе (1996), легко обеспечиваются при использовании современных катализаторов. Более жесткие стандарты, от носящиеся к транспорту со сверхнизким выбросом вредных веществ, могут быть обеспечены современными катализаторами, но транспортные средства без вредных выбросов, вероятно, появятся, когда двигатели будут работать на водородном топливе.
Таблица 10.2. Стандарты по выбросам (г/км) для транспортных средств,
работающих на бензине
|
СО |
Углеводороды |
*NO |
Углеводород + |
|
|
+ NOx |
||||
|
|
|
|
||
США |
2,11 |
0,25 |
0,62 |
— |
|
США, 1994 |
2,11 |
0,16 |
0,25 |
— |
|
ЕС, 1996 |
2,2 |
— |
— |
0,5 |
|
Япония |
2,1 |
0,25 |
0,25 |
— |
|
Транспортные средства |
|
|
|
|
|
с низким выбросом вредных |
2,11 |
0,05 |
0,12 |
— |
|
веществ |
|
|
|
|
|
Транспортные средства |
1,06 |
|
|
|
|
со сверхнизким выбросом |
0,02 |
0,12 |
— |
||
вредных веществ |
|
|
|
|
|
Транспортные средства |
0 |
0 |
0 |
— |
|
без вредных выбросов |
|||||
|
|
|
|
10.2.1.Катализаторы «трех процессов»
Катализатор «трех процессов», представляющий собой частицы Pt
иRh, нанесенные на керамический монолит, представляет собой замечатель ный пример успеха технологии создания катализаторов. Он позволяет удалять три загрязняющих среду соединения — СО, NO и углеводороды в соответствии со следующими полными реакциями (табл. 10.3).
428 |
Глава 10. Катализ и защита окружающей среды |
||
|
Таблица 10.3. Реакции, протекающие в катализаторе «трех процессов» |
||
|
Реакция |
|
Наиболее эффективный катализатор |
|
со + о2 -> со2 |
Pt, Pd |
|
|
схн, + о, |
со2 |
Pt, Pd |
|
NO + СО N2 |
+ со2 |
Rh, Pd |
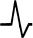
Кроме того, NO восстанавливается Н2 и углеводородами. Для обеспечения одновременного протекания трех реакций (заметьте, что первые две реакции представляют собой процессы окисления, а последняя — восстановления) не обходимо обеспечить определенный состав выхлопных газов, который достига ется при отношении воздух/топливо, равном 14,7 (рис. 10.1). При высоком содержании кислорода в окислении СО расходуется слишком много моно оксида углерода и его не остается на конверсию NO. При низком содержании кислорода NO конвертируется полностью, но углеводороды и СО не окисля ются полностью. Датчик кислорода (А-зонд) устанавливается перед катализато ром, с помощью которого бортовой компьютер поддерживает необходимый баланс топлива и воздуха, поступающих в двигатель.
Рис. 10.1. Эмиссии СО, NOx и углеводородов и уровень сигнала в датчике кислорода как функции отношения воздух/топливо. Значение Л = 1 соответствует отношению воздух/топливо, равному 14,7. Заметим, что все три загрязняющих компонента могут быть конвертированы одновременно только в достаточно узком диапазо не изменения отношения воздух/топливо
10.2. Каталитическая нейтрализация выхлопных газов |
429 |
Каталитическую нейтрализацию выхлопных газов стали применять в США в легковых автомобилях с 1975 года. Первые машины с электронной системой об ратной связи и катализаторами «трех процессов» были выпущены фирмой «Воль во» в 1979 г. для продажи в Калифорнии. В настоящее время все новые автомоби ли с бензиновыми двигателями, продающиеся на Западе, оборудованы катали тическими конверторами. Эти конверторы, безусловно, повышают качество воздуха, но приводят к дополнительному расходу топлива, поскольку фиксиро ванное отношение воздух/топливо снижает эффективность работы двигателей.
Принцип работы А-зонда показан на рис. 10.2. Он представляет собой дат чик кислорода, сделанный по образу и подобию топливных элементов на твер дых оксидах, обсуждавшихся в гл. 8. Оксид, через который проходят ионы кислорода, нагревается джоулевым теплом для обеспечения высокой подвиж ности ионов и малого времени отклика (~1 с).
Электрод из Pt
Выхлопные газы
Газ сравнения
Рис. 10.2. Принцип работы 2-зон |
Электрод из Pt |
да, используемого для регулирова |
|
ния системы впрыска автомобилей, |
|
обеспечивающего нужное отноше |
Отклик |
ние воздух/топливо |
Анализируемый газ |
Содержание кислорода в выхлопных газах сопоставляется с его содержани ем в газе сравнения, в данном случае в воздухе. Величина отклика определяет ся уравнением Нернста
£ |
RT , |
РО2эталон |
|
= - --- |
1П |
РО2выхлопы |
|
|
4F |
|
|
и ее зависимость от содержания кислорода в выхлопных газах показана на рис. 10.3. Заметьте, что сильный отклик при низком содержании кислорода обеспечивает сильное изменение сигнала в окрестности рабочей точки, задава емой стехиометрическим отношением. Приведенное выше соотношение пока зывает, что напряжение стремится к бесконечности, когда содержание кисло рода с одной стороны элемента становится исчезающе малым. В реальности этого не происходит, поскольку в этом случае оксид будет восстанавливаться и появится электронная проводимость. Показания датчика обычно изменяются в диапазоне от 0 до 1 В, если двигаться от нулевого парциального давления кис лорода внутри датчика.
Работа А-зонда основана на диффузии кислорода через твердый электро лит, и поэтому характеризуется некоторым временем задержки (или временем
430 -J Глава 10. Катализ и защита окружающей среды
отклика). Уменьшая толщину оксидной мембраны и увеличивая рабочую тем пературу, можно уменьшить время отклика, но сделать его нулевым невозмож но. Например, если водитель резко нажмет на педаль газа, выхлопные газы приобретут свойство восстановителя. Следовательно, осажденная на катализа торе сера будет гидрироваться, в выхлопных газах появится H2S, придавая им характерный запах тухлых яиц (такой запах иногда появляется при запуске холодного двигателя). Для избежания этого эффекта следует использовать дат чики с более быстрым откликом. В идеале их следует помещать непосредствен но у выхода из каждого цилиндра, поэтому они должны выдерживать высокие температуры.
Ро2, мбар
Рис. 10.3. Отклик Л-зонда датчика кислорода
10.2.1.1.Каталитический нейтрализатор
Типичная насадка, использующаяся для нейтрализации выхлоп ных газов, показана на рис. 10.4. Принципиально важная ее конструкционная особенность состоит в том, что она не должна препятствовать течению выхлоп ных газов, в противном случае мотор будет глохнуть. То есть каталитический реактор должен иметь открытую структуру. Это обеспечивается нанесением каталитически активных частиц на многоканальную решетку, называемую мо нолитом. Катализаторы такого типа хорошо подходят для работы в условиях, когда скорость реакции лимитируется транспортом реагентов вне катализатора (см. также рис. 5.37).
На рис. 10.5 показано устройство такого катализатора. Основная несущая конструкция образована монолитом, покрытым «отмывающим» слоем тол щиной 30—50 мкм. Он представляет собой обычный носитель, состоящий преимущественно из /-А12О3 (70—80 %) и других оксидов типа оксида церия (10—30 %), оксида лантана или оксидов щелочно-земельных металлов (ВаО). В некоторых конструкциях на внешнюю сторону «отмывающего» слоя наносят NiO для поглощения серы. Более плотные оксиды сг-А12О3 или ZrO2 иногда
